充放电过程液相锂离子浓度变化及机理
2021-05-26邵素霞朱振东
邵素霞,朱振东,彭 文,代 娟,吴 浩
(合肥国轩高科动力能源有限公司,安徽 合肥230012)
锂离子电池具有高能量密度、高电压平台、良好的功率性能和长寿命等特点,这使得锂离子电池从一开始商业化便迅速在消费电子产品、动力电池和储能电池领域占据了重要的地位。在锂离子电池的使用过程中,极化的产生会导致电池充放电容量的降低和循环寿命的衰减。在锂离子电池体系内,电池活性材料浸泡在电解液中,电极反应也是在电解液/电极界面进行的,因此研究充放电过程中的电解液中锂离子浓度变化对于明细内部物质迁移与电状态演化有重要意义。如何准确地对电池的各种极化进行定量分析和减小电池的极化以改善电池的性能,是当前研究的热点问题。Wiedmann 等[1]用FIB-SEM 研究了电极内部的质量和电荷输运,发现电极内部存在着严重的锂离子浓度和电位的局部变化,微结构不均匀导致活性物质利用率降低,最终导致容量损失。建立在严格电极动力学理论框架和大量电池数据积累基础上的数学模型,可以评价其电化学性能,这是一种分析电池极化的有效手段。中子衍射技术是一种利用不同材料对中子辐射的遮挡率不同,对材料进行分析的技术。中子辐射的穿透力强,散射长度与原子序数Z 无关,且对轻原子也灵敏,因此,中子对锂离子电池材料中的锂原子和镍锰钴过渡金属原子均非常敏感,我们能够在不破坏锂离子电池结构的前提下对锂离子电池内部Li 的分布进行原位的分析研究。此外原位中子衍射技术[2]亦能直观地研究充放电过程中锂离子在固相扩散中的浓度变化,从而找出影响锂离子在固相扩散和液相扩散中的原因,并探究改善措施,使得不同体系的锂离子电池在不同倍率下均以高效率的形式完成充放电过程,充分发挥其容量性能。为了减小电池的极化,改善充放电性能,有必要研究粒径和电极厚度对固相和液相扩散的影响规律,以期为电池的材料和工艺设计提供指导。Doyle等[3]建立了数学模型研究锂离子电池的性能,此模型基于多孔电极理论,采用Butler-Volmer 方程来描述电极与电解液界面间的电化学过程,使用Fick 定律描述锂离子在活性物质颗粒内部的嵌入与脱出,根据浓溶液理论描述电解液中的锂离子传质过程。通过计算得到电池各个位置的锂离子浓度分布、电化学电位以及交换电流密度等随充放电时间的变化规律,这在传统的试验测试中很难获得;而电化学模拟预测的锂浓度分布能够说明很多问题,但是这毕竟不是真实测量结果,是对锂离子电池电极过程的一种理想假设。Kashkooli等[4]成功开发并验证了一种计算高效的三维RVE(representative volume element)模型,准确预测不同条件下的电极性能,通过重构RVE 微电极模型可以研究充放电过程中固体颗粒内部及极片厚度方向的锂离子浓度变化,此外可获得界面处开路电压分布,研究电池固相扩散及液相扩散极化提供了新的思路和方法。模拟结果发现电极微结构内部的锂分布与基于单粒子模型得到的结果非常不同,锂离子浓度的范围更大,成功地说明了微观结构异质性的影响。电化学仿真、原位中子衍射技术、XCT 成像技术等方法用来研究电池电极反应以及固相和液相锂离子浓度变化,但是这些方法由于成本、使用便捷以及仿真参数准确性的问题在实际应用过程中受到限制。本文以三元Li(Ni0.65Co0.2Mn0.15)O2正极锂离子电池为研究对象,通过三电极电池实时监测充放电过程中液相锂离子浓度变化及其原因,这对于减缓电池极化提高电池倍率性能具有重要作用。
1 实 验
1.1 电池材料
在充满氩气的手套箱中将LiPF6盐溶解在体积比为1∶1∶1 的碳酸乙烯酯(EC)/碳酸二乙酯(DEC)/碳酸甲乙酯(EMC)混合溶剂配制成电解液,LiPF6盐的浓度为1、1.25、1.5、1.75、2 mol/L。在浓差电池和三电极电池中,将锂片(厚度为200 µm,天津产)剪成2 mm宽焊接到镍极耳,得到的锂电极作为参比电极。涂有陶瓷的聚乙烯薄膜(PE,厚度为15 μm)作为隔膜。
1.2 电池制作
浓差电池制作:用铝塑膜做成密封软包浓差电池,电池尺寸为8 cm(宽)×20 cm(长)。为了保证隔膜具有足够的浸润性,将隔膜对折叠成16 层的厚隔膜(1 cm×14 cm,厚度为240 μm),将折叠后的隔膜沿着中间剪开,其中一端浸泡在低浓度的电解液中(1 mol/L),另一端分别浸泡在高浓度的电解液中(1、1.25、1.5、1.75、2 mol/L),浸泡时间大于10 min。将浸泡在不同电解液中的两个隔膜的中间部分连接起来,连接部分用胶带固定,两个隔膜的尾端均插入锂电极,锂电极有镍极耳的一端放置于铝塑膜顶部,组装成如图1(a)所示的5个浓度梯度(1 mol/L/1 mol/L、1 mol/L/1.25 mol/L、1 mol/L/1.5 mol/L、1 mol/L/1.75 mol/L、1 mol/L/2 mol/L)的浓差电池,用电压表测试两个锂电极之间的电压。以上浓差电池在露点小于-40 ℃的干燥室中完成。

图1 (a)浓差电池示意图;(b)不同浓度浓差电池与浓差电压关系;(c)不同层数隔膜三电极电池示意图Fig.1 (a)diagram of concentration battery;(b)relationship of potential and concentration with different concentration in concentration battery;(c)diagram of three electrode battery with different layers separator
三电极电池制作:本文使用我司(合肥国轩高科动力能源有限公司)生产的三元Li(Ni0.65Co0.2Mn0.15)O2(NCM65)和人造石墨电极作为研究电极,我司生产的正、负极电极均为双面涂布,因此需要分别用N-甲基吡咯烷酮(NMP)和去离子水擦去正、负电极的一面,然后将单面涂布NCM622极片和石墨极片用压片机分别冲成4 cm×5 cm和4.2 cm×5.3 cm的正极和负极极片,在露点小于-40 ℃的干燥室中组装成如图1(c)所示的不同隔膜层数软包三电极电池(8 cm×20 cm)。两层隔膜软包三电极电池的正极和负极之间有两层长隔膜(5 cm×14 cm),两层长隔膜之间加入两个锂电极分别作为参比电极1(reference electrode 1,RE1)和参比电极3(reference electrode 3,RE3)。其中正极、负极以及RE1构成三电极电池,用来监控充放电过程中全电池、正极、负极电压,RE1与尾部RE3在充放电过程中为浓差电池,通过实时检测充放电过程中浓差电池电压来计算正负极之间液相锂离子浓度。8 层隔膜软包三电极电池的正负极之间有8层隔膜,正负极之间再加入一个锂电极作为参比电极2(reference electrode 2,RE2),按照正极→1 层隔膜→RE1→6 层隔膜→RE2→1层隔膜→负极的顺序组装,尾部RE3位置不变。在8层隔膜软包三电极电池中正极、负极以及RE1构成三电极电池,用来监控充放电过程中全电池、正极、负极电压,RE1 与尾部RE3 以及RE2 与尾部RE3 在充放电过程中为浓差电池,通过实时检测充放电过程中浓差电池电压来计算靠近正极、靠近负极液相锂离子浓度。
1.3 电池测试
使用新威CT-9004-5V5A-G4 型高精度电池性能测试系统(深圳产)对组装电池进行化成、充放电、GITT 测试。化成以及充放电测试时,以一定的倍率充放电,电压范围为3.0~4.2 V,化成倍率为0.05 C。GITT 测试时,以0.1 C 对电池充/放电10 min,将电池静置10 min 使电极达到平衡,再次以0.1 C充/放电10 min,直到达到电池上下限电压为止,电压范围为3.0~4.2 V,除非特殊说明,本文测试温度均为(25±2)℃。
2 结果与讨论
浓差电池电位与电解质浓度变化的关系式为[5]
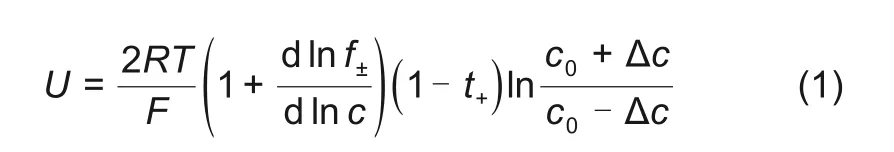
式中,U为浓差电池电压;c0+∆c和c0-∆c分别为两种接触电解液的锂盐浓度;R 为理想气体常数,它的 数值 是8.314 J/(mol·K);F 为法 拉 第 常数,它的数值是96485 C/mol;T为热力学温度,f±为平均活度系数;t+为阳离子迁移数。对式(1)求微分可以得到式(2)[6-9]
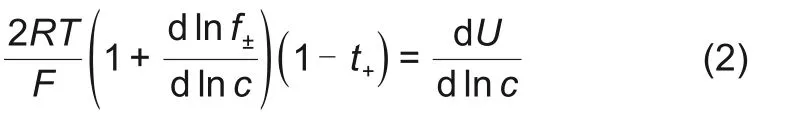
为了得到dU/dInc,首先建立如图1(a)所示浓差电池Li/LiPF6(c0)||Li/LiPF6(chigh),固定c0,调整chigh浓度。
如图1(a)所示的5 个浓度梯度的浓差电池电压数据以及拟合数据如图1(b)和表1所示,由此可以得出dU/dInc为0.0904。

表1 5个浓度梯度浓差电池的电压数据以及拟合数据Table 1 Testing and fitting data of concentration battery with five different concentration gradient
式(1)和式(2)结合,本试验中电解液体系因浓度改变(∆c)而形成的浓差电池电压可表示为
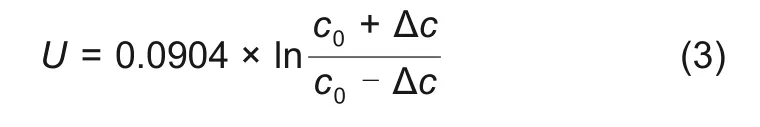
组装如图1(c)所示的三电极电池,由于RE3远离正负极极片,因此认为其所处的区域内锂离子浓度不受充放电过程影响,保持恒定,RE1在正负极极片之间,充放电过程中正负极之间液相锂离子浓度存在波动。RE1 和RE3 相当于形成浓差电池,通过监控RE1 和RE3 之间的电压,就可以得到充放电过程正负极极片之间锂离子浓度变化趋势。图2 分别为2 层隔膜软包三电极电池不同倍率下充放电曲线以及浓差电池电压曲线,由图可以看出,在充电过程中,负极石墨对RE1锂电极电位曲线有3个平台,分别为0.202、0.112、0.080 V,代表负极嵌锂过程。在放电过程中,负极石墨对RE1锂电极电位曲线先后也出现3 个平台,分别为0.080、0.112、0.202 V,代表负极脱锂过程。在充放电过程中,浓差电池的电压也出现3个区间,且出现平台的位置与负极对锂电位相同,说明浓差电池电位与负极有关。
将浓差电池电压代入式(3),已知RE3 处电解液浓度为1 mol/L,由式(3)可以得到充放电过程中2 层隔膜三电极电池正负极之间液相锂离子浓度变化。图3 分别为2 层隔膜三电极电池0.05、0.2、0.5 C 充电、放电过程中正负极之间液相锂离子浓度与负极石墨对RE1锂电极电压关系曲线,由图可知,随着负极石墨对RE1锂电极电位的降低,正负极之间液相锂离子浓度逐渐增加。充电过程中,正负极之间液相锂离子浓度均大于1 mol/L。放电过程中,随着负极石墨对RE1锂电极电位的升高,正负极之间液相锂离子浓度逐渐增加。放电过程中,正负极之间液相锂离子浓度均小于1 mol/L。不同倍率充放电过程中正负极之间液相锂离子浓度表现如下规律:①同倍率下,充电液相锂离子浓度大于放电液相锂离子浓度;②充电过程中,倍率越大,则正负极之间液相锂离子浓度越大,即0.5 C>0.2 C>0.05 C;放电过程中,倍率越大,则正负极之间液相锂离子浓度越小,即0.5 C<0.2 C<0.05 C。恒流恒压充电过程中,恒流段正负极之间液相锂离子浓度逐渐增加,恒压段正负极之间液相锂离子浓度开始降低。

图2 (a)和(b)分别为0.05 C充电和放电过程2层隔膜三电极电池电压曲线以及浓差电池电压曲线;(c)和(d)分别为0.2 C充电和放电过程2层隔膜三电极电池电压曲线以及浓差电池电压曲线;(e)和(f)分别为0.5 C充电和放电过程2层隔膜三电极电池电压曲线以及浓差电池电压曲线Fig.2 (a)and(b)potential curves of three electrode battery with two layers separator and concentration battery during charging and discharging cycles with current of 0.05 C;(c)and(d)potential curves of three electrode battery with two layers separator and concentration battery during charging and discharging cycles with current of 0.2 C;(e)and(f)potential curves of three electrode battery with two layers separator and concentration battery during charging and discharging cycles with current of 0.5 C
充放电过程中电解液中锂离子浓度变化主要受锂离子扩散影响,因此增加锂离子扩散阻力必然会影响锂离子浓度分布。本文采用在正负极之间添加多层隔膜达到这一目的,隔膜在上述2层的基础上添加至8 层,详细电池结构见试验部分描述。图4分别为2 层隔膜三电极电池和8 层隔膜三电极电池充、放电过程中负极石墨对RE1锂电极电位曲线以及液相锂离子浓度曲线。由图可知,2 层隔膜三电极电池的负极对RE1的3个脱嵌锂平台比8层隔膜三电极电池长,说明8 层隔膜三电极电池极化较大。2 层隔膜三电极电池正负极之间液相锂离子浓度变化大于8层隔膜三电极电池,这是因为正负极之间2 层隔膜增加到8 层,增加了液相扩散路径,在同倍率下,相同时间脱出/嵌入的锂离子一定,但是增加隔膜层数,导致液相扩散阻力增加,锂离子的浓度分布就会受到影响,因此2层隔膜的浓度要大于8 层隔膜。另外8 层隔膜三电极电池充放电过程中靠近正极液相锂离子浓度与靠近负极液相锂离子浓度变化趋势一致,两种三电极电池液相锂离子浓度变化与负极平台均相对应,这两种三电极电池充电过程液相锂离子浓度大于放电过程液相锂离子浓度。充电过程中,正极侧锂离子浓度略大于靠近负极侧,放电至30%~40% DOD 区间,负极侧浓度降低较正极侧延后,与锂离子从负极脱出,经过多层隔膜扩散至正极的过程对应。由此可以推测,正极脱锂速度大于负极嵌锂速度,造成充电过程中正极脱出锂离子来不及嵌入负极中,使液相锂离子浓度增加,导致正负极之间电解液中锂离子浓度大于1 mol/L;而放电过程中,负极脱出的锂离子快速嵌入到正极中,负极脱锂速度慢于正极嵌锂速度,正极优先消耗电解液中的锂离子,导致正负极之间电解液中锂离子浓度小于1 mol/L。
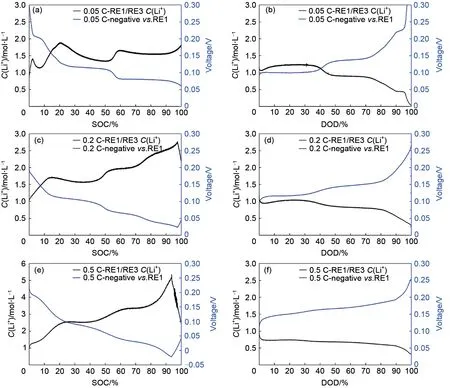
图3 (a)和(b)分别为2层隔膜三电极电池0.05 C充电、放电液相锂离子浓度与负极电压关系曲线;(c)和(d)分别为2层隔膜三电极电池0.2 C充电、放电液相锂离子浓度与负极电压关系曲线;(e)和(f)分别为2层隔膜三电极电池0.5 C充电、放电液相锂离子浓度与负极电压关系曲线Fig.3 (a)and(b)relationship of lithium-ion concentration in liquid phase and the potential of anode during charging and discharging cycles with the current of 0.05 C by three electrode battery with two layers separator;(c)and(d)relationship of lithium-ion concentration in liquid phase and the potential of anode during charging and discharging cycles with current of 0.2 C by three electrode battery with two layers separator;(e)and(f)relationship of lithium-ion concentration in liquid phase and potential of anode during charging and discharging cycles with current of 0.5 C by three electrode battery with two layers separator
为了验证以上猜想,以2层隔膜软包三电极电池为例,采用GITT 测试2 层隔膜三电极电池中正负极表观化学扩散系数。GITT 是在电极上施加一定时间的恒电流,记录并分析在该电流脉冲后的电位响应曲线。
如果电流足够小,扩散系数可以通过下式计算
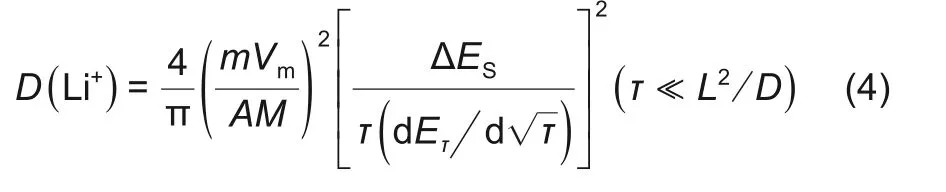
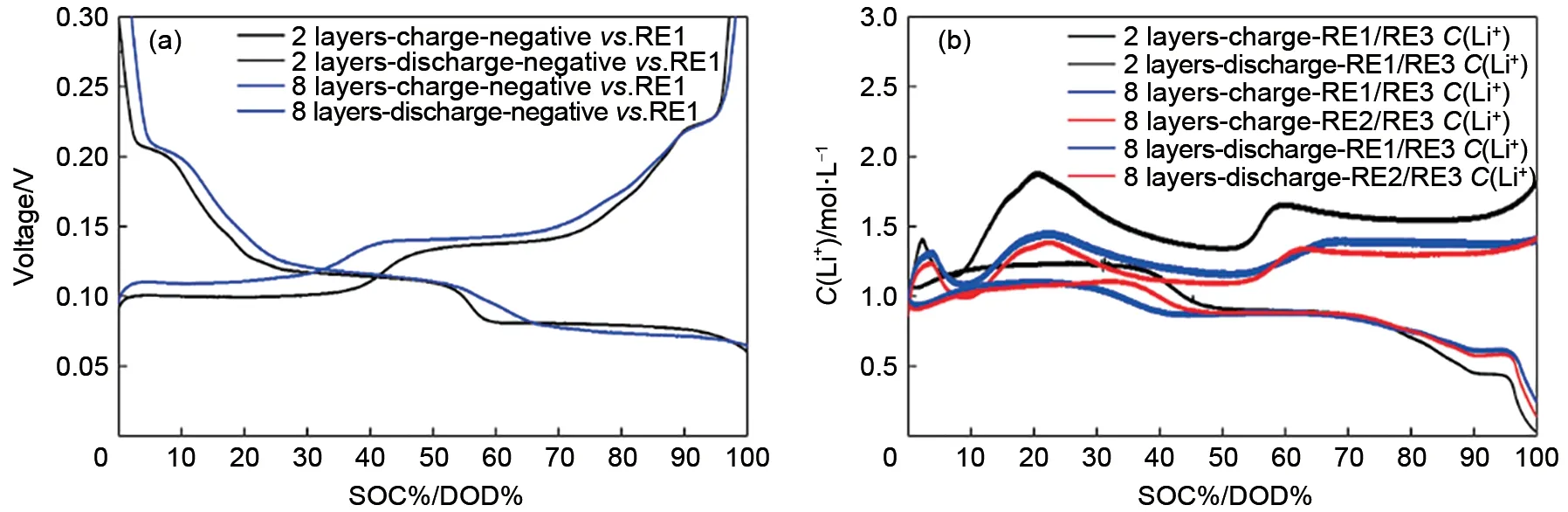
图4 (a)2层隔膜三电极电池和8层隔膜三电极电池充、放电过程中负极石墨对RE1锂电极电位曲线;(b)2层隔膜三电极电池和8层隔膜三电极电池充、放电过程中锂浓度曲线Fig.4 (a)electrode potential curves of anode(vs.RE1)during charging and discharging cycles in three electrode battery with two layers separator and three electrode battery with eight layers separator;(b)curves of lithium-ion concentration during charging and discharging cycles in three electrode battery with two layers separator and three electrode battery with eight layers separator
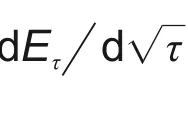
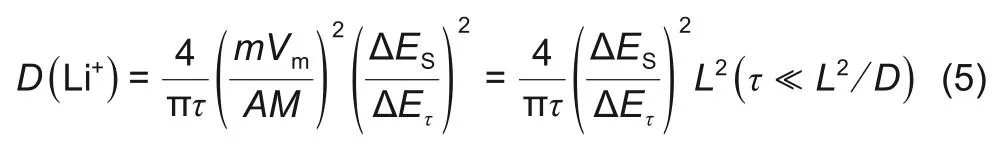
式中,M为电极材料的摩尔质量;m为电池材料质量;I0为脉冲电流;Vm为摩尔体积,Vm=M/ρ,ρ 为电极材料密度;A 为电极面积(这里取几何面积);τ 为脉冲时间,这里为600 s;L 为扩散长度,假设扩散长度等于电极厚度;∆ES为两个连续平衡电位差(∆ES=ES-E0),如图5(b)所示;每个电流脉冲产生过电位是IR 降和∆Eτ之和,如图5(b)所示,上述公式计算的是表观化学扩散系数。
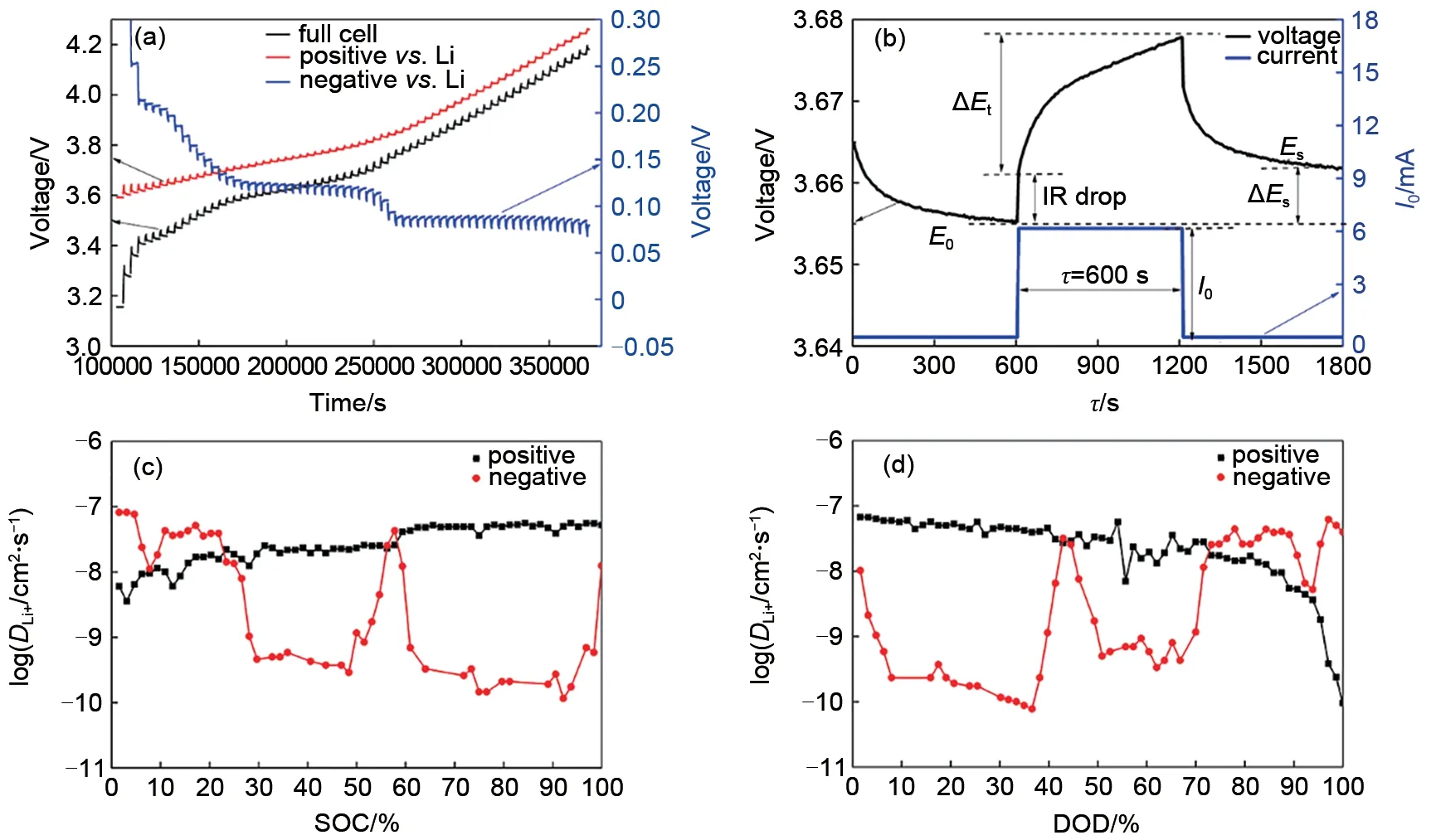
图5 (a)2层隔膜三电极电池GITT充电曲线;(b)充电过程中单次GITT测试外加电流/电压-时间曲线以及参数;(c)和(d)分别为充电和放电过程中正负极表观化学扩散系数曲线Fig.5 (a)curves of GITT during charging in three electrode battery with two layers separator;(b)diagram of voltage and current v.s.time during charging;(c)and(d)curves of apparent chemical diffusion coefficients of positive and negative electrodes during charging and discharging
图5(a)、(b)分别为2层隔膜三电极电池GITT充电工步以及GITT 数据处理。图5(c)、(d)是结合图5(b)根据式(5)计算充电和放电正负极表观化学扩散系数曲线。在充电过程中,正极表观化学扩散系数 随 着SOC 增 加 而 增 加,为3.57×10−9~5.63×10−8cm2/s;负极表观化学扩散系数随SOC增加先降低后增加,再降低,为1.16×10−10~8.21×10−8cm2/s。在50%~60%SOC之间,负极扩散系数有一个突增点,这与文献报道结果一致[12-14]。当SOC<25%,则负极表观化学扩散系数>正极表观化学扩散系数,当SOC>25%,则正极表观化学扩散系数大于负极表观化学扩散系数。这是因为在充电开始阶段,石墨对锂处于高电位,嵌锂量少,这时石墨中的空位多,锂离子迁移进去的阻力小,故扩散系数大。在充电开始阶段,正极NCM65 嵌锂接近饱和,锂离子之间的静电斥力较大,故扩散系数小。因此SOC<25%时,负极表观化学扩散系数大于正极表观化学扩散系数。随着充电的进行,负极石墨发生锂碳化合物相变(两相共存)时扩散系数小,而单相区扩散系数较大;随着充电的进行,正极NCM65嵌锂量不断减少,锂离子迁移阻力小,扩散系数不断增加,因此SOC>25%,正极表观化学扩散系数大于负极表观化学扩散系数。其中负极表观化学扩散系数在20%~100% SOC 有两个平台,这与负极充放电平台以及正负极之间液相锂离子浓度变化趋势对应。由此可以推断正负极之间液相锂离子浓度变化受负极扩散影响。在放电过程中,正极表观化学扩散系数随着DOD 增加而降低,为6.71×10−8~1.81×10−9cm2/s;负极表观化学扩散系数为1.00×10−10~6.19×10−8cm2/s,充电和放电正负极表观化学扩散系数基本相同。电池中的电化学反应,都至少包括两种电极过程电化学反应以及电解质相中的传质过程(电迁移/扩散过程)[15]。电解质相中的传质过程只会引起其中各组分的局部浓度变化,不会引起化学变化。如果某电极反应速度由液相中的传质速度所决定,则不能认为溶液中反应粒子的浓度均匀,当液相对流速度比较小时,许多电极反应的进行速度由液相中反应粒子的扩散速度所控制[16]。电化学反应的速度远远大于传质速度,另外液相扩散速度大于固相扩散速度,而正极固相扩散速度大于负极固相扩散速度。因此负极固相扩散系为整个电极反应的速度控制步骤。充电过程中,正极扩散速度大于负极扩散速度,同一时间内从正极扩散到电解液参比处的锂离子更多,而从电解液中扩散到负极锂离子少,随着充电的进行,锂离子在电解液参比处聚集,导致该处锂离子浓度>1 mol/L。放电过程中,正极扩散速度大于负极扩散速度,同一时间内从负极扩散到电解液参比处的锂离子少,而从电解液中扩散到正极的锂离子更多,随着放电的进行,锂离子在电解液参比处聚集相对较少,导致该处锂离子浓度<1 mol/L。在10% SOC~30% SOC 以及40%SOC~50%SOC处负极固相扩散系数有一个突增点,而在这个区间,正极表观化学扩散系数一直增加。两者共同作用下导致正负极之间液相锂离子浓度在该处也呈现出一定的波动。归根结底,充放电过程中正负极之间液相锂离子浓度的变化反映的是电极反应过程中浓差极化占主导。
3 结 论
通过三电极电池测试充放电过程中正负极之间液相锂离子浓度变化,揭示正负极之间液相锂离子浓度变化规律,结论如下:①在充放电过程中,正负极之间液相锂离子浓度变化出现3个区间,出现位置与负极对锂电位相同;②同倍率下,充电过程正负极之间液相锂离子浓度大于放电过程正负极之间液相锂离子浓度;③充电过程中,倍率越大,则正负极之间液相锂离子浓度越大,即0.5 C>0.2 C>0.05 C;放电过程中,倍率越大,则正负极之间液相锂离子浓度越小,即0.5 C<0.2 C<0.05 C;④增加正负极之间的扩散路径,正负极之间液相锂离子浓度变化趋势保持不变,但靠近正负极侧液相锂离子浓度有一定差异。通过GITT 测试三电极电池正负极表观化学扩散系数可知,正极表观化学扩散系数(3.57×10−9~5.63×10−8cm2/s)大于负极表观化学扩散系数(1.16×10−10~8.21×10−8cm2/s),说明电极过程受负极扩散影响,这一结论验证了正极脱嵌锂速度大于负极,且正负极之间液相锂离子浓度变化受负极扩散控制的猜想。
