Co0.1Fe0.9S2@Li7P3S11正极材料的制备及其在全固态锂电池中的性能
2021-05-26万红利刘高瞻姚霞银
蒋 苗,万红利,刘高瞻,翁 伟,王 超,姚霞银
(1中国科学院宁波材料技术与工程研究所,浙江 宁波315201;2中国科学院大学,北京100049)
锂硫电池作为最有前景的储能器件之一而备受关注,不仅是因为硫正极价格低廉,而且理论比容量和能量密度都比传统正极材料高[1-3]。然而基于有机电解液体系的锂硫电池面临着因有机溶剂燃烧而带来的安全隐患以及多硫化物穿梭效应引起的较差的倍率性能和循环稳定性等问题[4-5]。与之相反,全固态电池采用不可燃无机固体电解质替代有机电解液能有效避免上述问题。此外,无机固体电解质机械强度高,采用金属锂作为负极时,可有效抑制锂枝晶的产生,从而实现更高的能量密度。作为无机固体电解质中的一种,硫化物固体电解质因其高的离子电导率(约10-3~10-2S/cm),已经被广泛应用于全固态锂电池中[6-7]。然而,由于硫的绝缘特性和充放电过程中较大的体积膨胀,全固态锂硫电池依然面临着循环稳定性差的问题[8-9]。
基于阴离子氧化还原反应的过渡金属硫化物具有适中的电压平台,高的理论比容量,被认为是最有希望替代单质硫的正极材料[10-11]。黄铁矿(FeS2)作为过渡金属硫化物中的一种,具有资源丰富、环境友好、价格低廉、离子/电子电导率高等优点,在基于电解液体系的锂离子电池中已经被广泛研究[12-14]。然而,FeS2在充放电过程中易产生应力应变导致电极粉化以及反应产物硫及硫化锂的缓慢的反应动力学性能将直接影响全固态电池的循环和倍率性能,而过渡金属掺杂可以显著提高金属硫化物的可逆转化反应性能。此外,由于外来金属原子的掺入导致原子排列的细微变形会暴露出活性边缘位点以储存锂,从而提高电极材料的倍率和循环性能[15-16]。Wan等[15]报道了通过溶剂热法制备了Co掺杂的FeS2纳米颗粒,将其应用于全固态锂电池正极中,在电流密度为500 mA/g下,循环100圈后,可逆比容量保持在543.5 mA·h/g。其优异的电化学性能主要归因于金属Co 的催化作用提高了转化反应动力学过程。此外,在电极/电解质界面引入缓冲层实现电极界面性能改善也是提高电极材料界面锂离子传输动力学的重要策略之一。通常界面处的锂离子传输性能是电化学反应的决速步骤。通过在电极表面原位包覆电解质能实现电极/电解质更好的接触,降低界面应力应变,从而实现更高的电化学性能。例如,Zhang等[17]通过溶剂热法制备了纳米花状的Fe3S4,随后通过液相法原位沉积Li7P3S11在Fe3S4表面,实现了对电极材料的界面性能改善。室温下,Li/75%Li2S-24%P2S5-1%P2O5/Li10GeP2S12/Fe3S4@Li7P3S11全固态电池在0.1 A/g电流密度下循环200 圈,其可逆比容量仍保持着1001 mA·h/g。因此,将过渡金属掺杂和电解质原位包覆两者结合起来,实现电极材料界面性能和离子导电特性的双重改善,有望实现更高的电化学性能。
本文通过高温溶剂热法制备了Co掺杂FeS2纳米颗粒,纳米尺寸的材料能提高电解质与电极活性物质的接触,还能降低离子传输距离,从而实现锂离子更快速的传输。为了进一步改善电极材料的界面离子传输性能,通过液相法原位包覆Li7P3S11固态电解质在Co掺杂FeS2材料表面并将其应用于全固态锂电池中。全固态锂金属电池Li/75%Li2S-24%P2S5-1%P2O5/Li10GeP2S12/Co0.1Fe0.9S2@Li7P3S11
在电流密度为200 mA/g 下,循环100 圈后,放电比容量保持在670.9 mA·h/g,其优异的电化学性能主要归因于过渡金属掺杂提高了电化学反应动力学性能以及电解质原位包覆改善了电极/电解质的界面锂离子传输特性。
1 实 验
1.1 试 剂
七水合硫酸亚铁(99%,国药集团化学试剂有限公司),七水合硫酸钴(99.5%,国药集团化学试剂有限公司),尿素(99%,上海阿拉丁科技股份有限公司),升华硫(99.95%,上海阿拉丁科技股份有限公司),硫化锂[99.9%,阿法埃莎(中国)化学有限公司],五硫化二磷(99%,上海阿拉丁科技股份有限公司),乙二醇(99%,上海阿拉丁科技股份有限公司),N,N-二甲基甲酰胺(99.9%,上海阿拉丁科技股份有限公司),无水乙腈(99.8%,上海阿拉丁科技股份有限公司)。
1.2 材料制备
1.2.1 FeS2及Co 掺杂FeS2纳米颗粒(Co0.1Fe0.9S2)的制备
称取2.0 mmol FeSO4·7H2O、25 mmol升华硫和10 mmol 尿素加入到30 mL N,N-二甲基甲酰胺和40 mL 乙二醇的混合溶剂中,充分搅拌溶解后,转移到100 mL 的水热反应釜中,在180 ℃下反应12 h。反应结束后,将所得产物分别用去离子水、无水乙醇清洗3遍,随后进行冷冻干燥24 h,最终获得FeS2。Co0.1Fe0.9S2的制备方案与上述一致,只是将其中的0.2 mmol FeSO4·7H2O 替代为0.2 mmol CoSO4·7H2O来获得。
1.2.2 Li7P3S11包覆Co0.1Fe0.9S2的纳米颗粒(Co0.1Fe0.9S2@Li7P3S11)的制备
称取0.049 g Li2S 和0.101 g P2S5溶解在20 mL无水乙腈中,形成均一的混合溶液,然后称取0.85 g Co0.1Fe0.9S2加入到上述溶液中,磁力搅拌24 h。随后进行减压抽滤和真空干燥,获得前驱体粉末。最后在氩气气氛下,将前驱体粉末在260 ℃下烧结1 h,获得Co0.1Fe0.9S2@Li7P3S11。
1.3 表征方法
采用X 射线衍射(XRD, Bruker AXS D8 Advance)对样品的晶体结构进行表征。利用S4800 型场发射扫描电子显微镜(SEM)和Talos F200透射电子显微镜(TEM)对样品的形貌、结构进行观察。使用扫描透射显微镜-能量散射谱(STEMEDS)对样品的元素分布进行分析。
1.4 全固态电池的制备流程及电化学测试
将FeS2或Co0.1Fe0.9S2@Li7P3S11纳米颗粒与Li10GeP2S12固体电解质以及导电添加剂Super P 按照质量比4∶5∶1称取一定量,置于研钵中研磨一段时间后形成复合正极。然后将100 mg 的Li10GeP2S12和50 mg 的75%Li2S-24%P2S5-1%P2O5固体电解质粉末依次加入到直径为10 mm 的聚四氟乙烯套筒中,并在240 MPa 的压力下将固体电解质粉末压成双层固体电解质片。然后将正极均匀铺在Li10GeP2S12电解质的一侧,在240 MPa的压力下进行压制,最后再将锂片贴附在双层电解质的另一侧,在360 MPa的压力下完成电池组装。
电池的充放电测试在武汉蓝电电池测试系统LAND CT-2001A上完成。分别对固态电池的充放电性能、循环性能进行测试,截止电压为1.0~3.0 V,充放电环境为室温条件。采用Solartron 1470E 多通道电化学工作站对固态电池的循环伏安(CV)和电化学阻抗谱(EIS)进行测试。CV 测试电压范围为1.0~3.0 V,扫描速率为0.2 mV/s。EIS 测试电压振幅为15 mV,频率范围为10~106HZ。
2 结果讨论
2.1 结构分析
为了研究FeS2和Co0.1Fe0.9S2@Li7P3S11复合材料的结构,分别对其做了XRD测试,其结果如图1所示。通过对比FeS2的标准PDF 卡片可以发现,Co0.1Fe0.9S2@Li7P3S11复合材料的晶体结构并没有发生变化,也没有生成新相。此外,在Co0.1Fe0.9S2@Li7P3S11峰谱上并没有发现Li7P3S11的衍射峰,其原因可能是Li7P3S11含量太少或者是Co0.1Fe0.9S2结晶性太强导致Li7P3S11的衍射峰被掩盖住了。

图1 FeS2和Co0.1Fe0.9S2@Li7P3S11的XRD图Fig.1 XRD patterns of FeS2 and Co0.1Fe0.9S2@Li7P3S11
2.2 形貌分析

图2 (a)FeS2和(b)Co0.1Fe0.9S2@Li7P3S11的SEM图;Co0.1Fe0.9S2@Li7P3S11的(c)TEM图和(d)STEM-EDS图Fig.2 SEM images of(a)FeS2 and(b)Co0.1Fe0.9S2@Li7P3S11;(c)TEM image and(d)STEM-EDS mapping of Co0.1Fe0.9S2@Li7P3S11
图2(a)为纯FeS2的SEM 图像,从图中可以看出,直径为200 nm 左右的FeS2无规则纳米颗粒在空间中随机排列。图2(b)为Co0.1Fe0.9S2@Li7P3S11的SEM图,对比纯FeS2可以看出,Co0.1Fe0.9S2@Li7P3S11的颗粒尺寸也在200 nm 左右,但是并没有观察到Li7P3S11电解质颗粒包覆在其表面,原因可能是电解质颗粒尺寸较小。纳米尺寸的材料既能有效提高Li+的传输速度,又能增大活性物质与电解质之间的接触面积。为了说明电解质Li7P3S11包覆在Co0.1Fe0.9S2的表面,采用TEM和STEM-EDS进行进一步表征。图2(c)是Co0.1Fe0.9S2@Li7P3S11的TEM图。从图2(c)中可以看出Co0.1Fe0.9S2@Li7P3S11呈现100~200 nm左右的规则纳米球状,其结果与SEM结果相吻合。图2(d) 为纳米球形的Co0.1Fe0.9S2@Li7P3S11的STEM-EDS 图。红色P 元素来源于Li7P3S11固体电解质,证实了电解质Li7P3S11均匀分布在Co0.1Fe0.9S2的表面。
2.3 电化学性能分析
为了研究Co0.1Fe0.9S2@Li7P3S11和FeS2的反应机理,将制备的电极材料应用于全固态电池中,测试其在1.0~3.0 V之间的循环伏安曲线。图3(a)显示的是Co0.1Fe0.9S2@Li7P3S11前3 圈的CV 曲线,在首次阴极扫描过程中,在1.8 V 附近出现了一个较弱还原峰,对应于Li+嵌入到FeS2中形成的Li2FeS2嵌锂化合物。在1.5 V 附近的强还原峰,对应于转化反应生成的单质Fe 和Li2S。在首次阳极扫描过程中出现的两个氧化峰1.9 V和2.5 V,分别对应于Li2FeS2的生成以及Li2FeS2发生转化反应生成FeSy和S。在随后的两圈扫描中,其CV曲线基本重合,说明Co0.1Fe0.9S2@Li7P3S11具有很高的可逆性。相比于Co0.1Fe0.9S2@Li7P3S11,FeS2的首次阴极扫描的还原峰位置向左发生一定程度的偏移(弱还原峰位置在1.7 V 左右,强还原峰位置在1.4 V 左右),表现出相对较低的电化学反应过程。对比两者CV曲线,可以发现,Co0.1Fe0.9S2@Li7P3S11的电化学反应动力学过程得到增强,其原因一方面在于Co 掺杂的催化效果,另一方面得益于电解质原位包覆改性了电极/电解质界面离子传输性能。
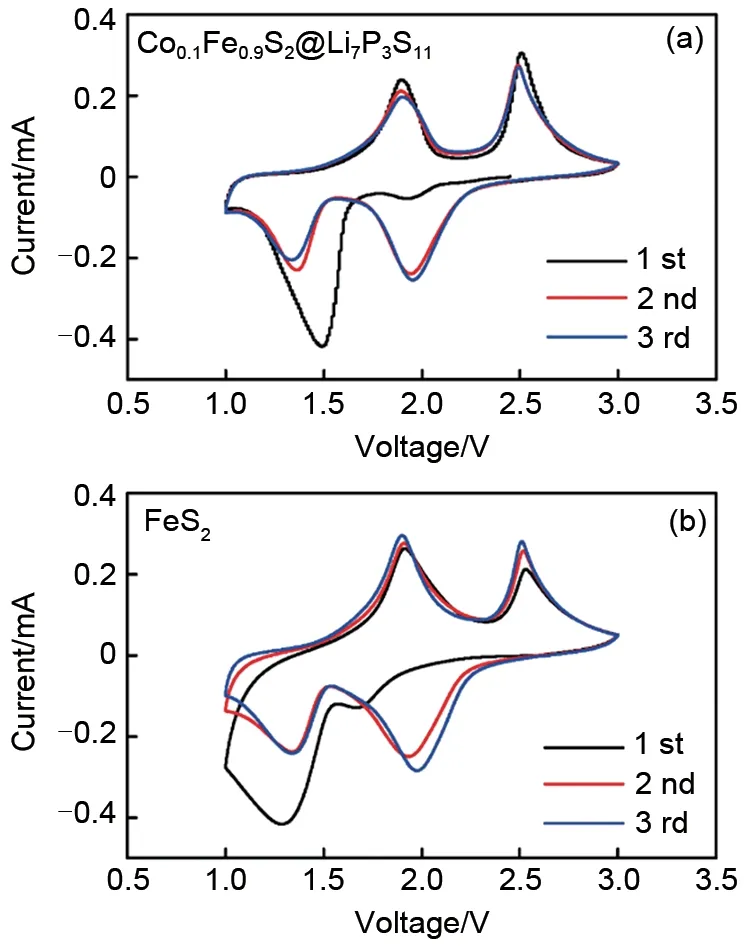
图3 (a)Co0.1Fe0.9S2@Li7P3S11和(b)FeS2在1.0~3.0 V的循环伏安曲线Fig.3 CV profiles of(a)Co0.1Fe0.9S2@Li7P3S11 and(b)FeS2 in the range of 1.0~3.0 V
图4 显 示了Co0.1Fe0.9S2@Li7P3S11和FeS2在 不同电流密度下的充放电曲线。由图可以很明显看出,Co0.1Fe0.9S2@Li7P3S11的倍率性能比FeS2更好。在电流密度为100、200、500 和1000 mA/g 下,Co0.1Fe0.9S2@Li7P3S11的放电比容量分别为881.6、786.4、697.1 和648.2 mA·h/g。相比之下,FeS2仅放出686.8、614.2、521.3和373.9 mA·h/g的放电比容量。
图5(a)、(b)为Co0.1Fe0.9S2@Li7P3S11和FeS2在200 mA/g 电流密度下的充放电曲线。Co0.1Fe0.9S2@Li7P3S11和FeS2的首圈放电比容量分别为882.1 和812.2 mA·h/g,首次库仑效率分别为83.2%和73.8%。FeS2电极在首次充放电曲线中,可以看到一个放电平台(约1.4 V)和两个充电平台(1.9、2.5 V),这和CV曲线一致。但是50圈后,可以看到FeS2充放电平台坍塌严重,其主要原因在于纳米Fe的团聚及离子/电子绝缘体Li2S的产生,导致反应动力学性能急剧下降以及容量衰减[15,18]。而Co0.1Fe0.9S2@Li7P3S11保持了很好的充放电平台,此外,由图还可以看出,相较于FeS2,Co0.1Fe0.9S2@Li7P3S11的充放电平台更长更平缓,说明改性后的正极材料具有更小的极化和更好的反应动力学性能。图5(c)显示了Co0.1Fe0.9S2@Li7P3S11和FeS2在100圈内的循环稳定性。在电流密度为200 mA/g 下,FeS2首圈放电比容量为812.2 mA·h/g,循环100 圈后放电比容量仅为153 mA·h/g。相较于纯FeS2,Co0.1Fe0.9S2@Li7P3S11的循环性能更好,首圈放电比容量为882.1 mA·h/g,循环100圈后放电比容量为670.9 mA·h/g。其优异的电化学性能主要归因于过渡金属Co 的掺杂具有催化的作用,能有效降低反应活化能,最终使电化学反应动力学显著提高[15]。而电解质Li7P3S11原位包覆不仅能改善电极/电解质固固接触,形成良好稳定的界面层,降低界面阻抗,还能有效缩短锂离子传输路径,进一步提高电池的循环和倍率性能[17,19]。

图4 (a)Co0.1Fe0.9S2@Li7P3S11和(b)FeS2的倍率充放电曲线Fig.4 The rate performances of(a)Co0.1Fe0.9S2@Li7P3S11 and(b)FeS2 cathodes under different current densities

图5 (a)Co0.1Fe0.9S2@Li7P3S11和(b)FeS2在1.0~3.0 V的恒流充放电曲线;(c)Co0.1Fe0.9S2@Li7P3S11和FeS2在1.0~3.0 V、200 mA/g下的循环曲线;(d)Co0.1Fe0.9S2@Li7P3S11和FeS2首圈和循环100圈后的EIS曲线Fig.5 Galvanostatic charge-discharge profiles of(a)Co0.1Fe0.9S2@Li7P3S11 and(b)FeS2 cathode in the range of 1.0~3.0 V;(c)cycling stability of Co0.1Fe0.9S2@Li7P3S11 and FeS2 cathode in the range of 1.0~3.0 V at 200 mA/g;(d)nyquist plots for Co0.1Fe0.9S2@Li7P3S11 and FeS2 cathode after 1st and 100th cycles
为了进一步理解FeS2和Co0.1Fe0.9S2@Li7P3S11电极材料的容量变化机制,测试了两者首圈和循环100 圈后的EIS。如图5(d)所示,曲线与实轴Z’对应的交点为欧姆阻抗,来自于电极材料和固体电解质内部阻抗。可以看到,首次充放电后,FeS2对应的欧姆阻抗为94.3 Ω,而Co0.1Fe0.9S2@Li7P3S11欧姆阻抗为91 Ω。尽管两者用的是同样电解质,但是Co0.1Fe0.9S2@ Li7P3S11欧姆阻抗仍比FeS2要低。循环100 圈后,FeS2的欧姆阻抗由94.3 Ω 增加到196 Ω,并且在中频区域出现了半圆,对应于电荷转移阻抗,主要来自于活性物质与电解质接触产生的界面阻抗。而Co0.1Fe0.9S2@Li7P3S11表现出比FeS2更低的欧姆阻抗和电荷转移阻抗,循环100圈后,欧姆阻抗仅增加到了136.7 Ω,并且在中频区未看见明显的半圆,说明其较小的界面阻抗,原因在于Li7P3S11表面包覆改性了电极/电解质界面锂离子传输特性。因此,通过对比循环前后阻抗的变化说明Co0.1Fe0.9S2@Li7P3S11拥有更加稳定的循环性能。
3 结 论
本文通过溶剂热法制备了Co0.1Fe0.9S2纳米颗粒,并在其表面原位包覆了一层Li7P3S11电解质,制备了Co0.1Fe0.9S2@Li7P3S11纳米复合材料。在室温200 mA/g 电流密度下,Co0.1Fe0.9S2@Li7P3S11纳米复合材料首圈放电比容量为882.1 mA·h/g,循环100圈后,放电比容量保持在670.9 mA·h/g。其结果表明,原位包覆Li7P3S11电解质以及过渡金属掺杂能提高FeS2正极材料的可逆比容量和循环稳定性。其原因一方面在于电解质原位包覆改善了电极/电解质界面锂离子传输特性并提高了稳定性;另一方面,过渡金属的掺杂能有效提高电化学反应动力学过程。
