短小芽孢杆菌非编码RNA Bpsr145的鉴定及初步探究
2021-05-25徐云帆贺婷停王海燕
宋 婷,徐云帆,贺婷停,覃 佳,黄 宇,王海燕
(四川大学生命科学学院/生物资源与生态环境教育部重点实验室,四川 成都 610065)
【研究意义】过去10年,细菌小非编码 RNA (small non-coding RNA,又称sRNA) 的发现和功能识别已经受到广泛研究。sRNA通常是由50~500个核苷酸组成,主要由细菌染色体的基因间隔区编码产生,绝大多数sRNA不编码蛋白质,由于sRNA的不完全碱基配对机制使一个sRNA可以与多个靶基因作用,调节不同的生物学过程[1]。短小芽孢杆菌(Bacilluspumilus)属于芽孢杆菌属,是一类重要的生防细菌,它可以分泌抗菌肽、抗菌蛋白以及抗菌素等多种物质,对于多种致病病原菌均有明显的抑制作用,如Zheng Min等[2]研究发现B.pumilus对于芒果炭疽病的抑制率高达94.28 %。对短小芽孢杆菌中的sRNA研究可以揭示其更多作用机制。【前人研究进展】目前已有大量sRNA被报道,功能得到研究的sRNA大多来自于革兰氏阴性菌大肠杆菌和沙门氏菌。如大肠杆菌中,GcvB是一个长度为206 nt的sRNA,主要功能是调控氨基酸转运和多肽转运相关基因的表达[3];sRNA RyhB可以通过与铁储存蛋白(如Bfr)和非必需的铁硫蛋白(如超氧化物歧化酶sodB,sdhCDAB操纵子)等基因的mRNA结合而抑制这些蛋白的产生[4]。另外在其他菌株中也有少量发现,如Robert Hertel等[5]发现枯草杆菌的sRNA AprAs可以通过与aprmRNA结合抑制枯草杆菌蛋白酶的表达,阻止该sRNA转录可以提高Apr蛋白表达量,蛋白酶活性增加约4倍;另外,Jiakun Qi等[6]证明了sRNA s015可以通过提高LactococcuslactisF44的耐酸性而提高乳链菌肽的产量。【本研究切入点】B.pumilusSCU11是实验室早期从土壤中分离并经过复合诱变得到的菌株,前期采用链特异性转录组测序技术研究了该菌在发酵过程中9个时间点的转录组,并利用生物信息学技术预测出84个大于50 nt的候选非编码sRNA,Bpsr145是一个长209 nt的候选非编码sRNA,在不同时间表达水平有较大差异。【拟解决的关键问题】通过Northern blotting和独立转录验证Bpsr145的表达,使用不同的程序对其序列保守性、二级结构以及靶标基因进行分析,建立敲除菌株为探究该sRNA的功能奠定基础。
1 材料与方法
1.1 菌株和质粒
B.pumilusSCU11是实验室早期从土壤中分离并经过复合诱变得到的;pSUGV4[7]和pUCETs[8]均是E.coli-Bacillus穿梭载体。
1.2 RNA提取和Northern blotting
新鲜的菌液在7500 r/min条件下离心10 min收集菌体,利用TRizol方法提取RNA。Northern杂交电泳的上样量为10 μg总RNA,用2 %的琼脂糖甲醛变性电泳,电泳条件:65 V, 2 h;将RNA转移到带正电荷的尼龙膜上,转膜液为20×SSC,过夜转膜;然后使用紫外交联仪进行交联,能量为1600×100 μJ/cm;杂交、洗涤、显色:按照Roche公司的DIG Northern Starter Kit试剂盒方法进行。
1.3 独立转录载体的构建
以pSUGV4为载体,构建独立转录质粒。以基因组DNA为模板,Bpsr145-F/R (F: 5’-CCAAGCTTGCATGCCTGCAGAGTAGATGCCTTAGCAGATGTGG TC-3’, R: 5’-CGGTACCCGGGGATCCTAGACAAAC CCTCGCATTCGG-3’) 为引物扩增得到包括Bpsr145启动子和终止子的完整序列片段,将该片段通过TAKARA公司的In-fusion试剂盒插入经PstI和BamHI双酶切的pSUGV4质粒,连接产物转化大肠杆菌,得到重组质粒pSUGV4 (145) 。
1.4 敲除载体的构建
以实验室构建的温度敏感型质粒pUCETs为载体,构建基因敲除质粒。首先在编码Bpsr145的基因上、下游区域分别设计用于同源重组的同源臂,以基因组DNA为模板,Bpsr145-1F/R(1F:5’-CAAGCTTGCATGCCTGCAGATGGTGAGAGTGGGGC
AGA-3’, 1R:5’-CGTCATCATCTGTATGAATCTCCTTGCAAATCTTCTTGAGC-3’) 和Bpsr145-2F/R (2F:5’-GAACGATGACCTCTAATAATTGTCCTTGCAAATC TTCTTGAGC-3’,2R: 5’-CGGTACCCGGGGATCCAATGGGACAGTCATCGCCT-3’) 为引物扩增得到上、下游同源臂Flank1 (742 bp) 和Flank2 (676 bp) ,以质粒pSUGV4为模板,kan-F/R (F: 5’-GATTCATACAGATGATGACG-3’, R:5’-CAATTATTAGAGGTCATCGTTC-3’) 为引物扩增出kan基因片段 (1047 bp) ,利用重叠PCR将3个片段连接起来得到Flank1-kan-Flank2 (2465 bp) 片段。将该融合片段通过TAKARA公司的In-fusion试剂盒插入经PstI和BamH I双酶切的pUCETs质粒,连接产物转化大肠杆菌,得到敲除载体pUCETs-145。
1.5 短小芽孢杆菌电转化实验
根据前期实验室建立优化的电转化方法[8]进行。
1.6 RNA结构分析
Mfold Web服务器用于预测折叠RNA的结构,包括sRNA和靶标mRNA[9]。
1.7 靶基因的预测
使用2个不同程序获得靶基因预测:CopraRNA[10]和TargetRNA2[11],CopraRNA是使用的本地服务器版本,TargetRNA2可从网页上获取:http://cs.wellesley.edu/~btjaden/TargetRNA2/。
1.8 生长曲线测定
将保存的菌株划线在1 %的牛奶LB平板上37 ℃过夜活化,选取单菌落接种于LB液体培养基,震荡过夜。以4 %比例转入50 mL LB培养基中,于37 ℃摇床中180 r/min振荡培养,隔一定的时间进行取样,适当稀释用分光光度计测定OD600nm数值。
1.9 胞内蛋白SDS-PAGE
将2个菌株过夜活化,以1 %比例分别转种于LB培养基中培养18 h,将2个菌悬液调整至OD600nm值为1.0,取6 mL稀释菌液用PBS缓冲液洗2次,然后用0.6 mL PBS缓冲液重新悬浮,取0.5 mL菌液以1∶1的比例与100~200 μm规格的玻璃珠混合,在细胞研磨机器上研磨,然后取出破壁后的样品与loading buffer混匀,100 ℃变性10 min后各取20 μl样品进行SDS-PAGE。
2 结果与分析
2.1 转录组数据揭示Bpsr145是一个差异表达的sRNA
前期采用链特异性转录组测序技术研究了B.pumilusSCU11在发酵过程中不同时间的转录组,从中预测出84个候选非编码sRNA。本研究首先对转录组数据中Bpsr145在不同时间点的表达水平进行分析,比较该sRNA及其邻近染色体区域的reads覆盖情况,了解Bpsr145和附近基因的转录水平。研究发现Bpsr145的表达量在不同时间点变化较大(图1-A),24 h之前表达水平很低,从36 h开始出现显著升高,48 h表达量达到峰值,然后开始下降,由此初步推测Bpsr145发挥功能的主要时期是在36~60 h。Bpsr145位于染色体RI02_RS03660(编码假设蛋白)和RI02_RS03665(编码甲硫氨酸氨基肽酶)2个基因的间隔区,运用生物信息学方法分析发酵48 h时Bpsr145及其上下游基因编码区的reads覆盖情况(图1-B),结果显示:Bpsr145与上游基因反向部分重叠,由不同的链转录产生;与下游基因转录方向相同但是距离较远,并且中间间隔区域在不同时间点几乎没有reads覆盖。综合这些可以推测Bpsr145是一个独立转录的sRNA。
2.2 Bpsr145的实验验证
Bpsr145的生物信息学分析显示该sRNA是一个独立转录的sRNA,但仍需进一步实验验证,Northern blotting被认为是验证sRNA的金标准。以LB培养基中培养48 h的短小芽孢杆菌总RNA 作为样品进行Northern blotting实验,结果显示出一条清晰的杂交条带,说明Bpsr145在B.pumilusSCU11中真实转录,实际大小与预测的209 nt接近(图2-A)。
通过异源表达实验验证Bpsr145是否能独立转录。Bacillussubtilis168是芽孢杆菌的模式菌株,B.subtilisWB600是敲除B.subtilis168 中6个蛋白酶基因的改造菌株,将Bpsr 145序列与其基因组对比,并未发现同源序列,因此用该菌株作为Bpsr145异源表达的宿主。利用短小芽孢杆菌电转化方法,将包含Bpsr145启动子和终止子完整序列的重组质粒pSUGV4 (145) 转入B.subtilisWB600中,得到转化菌株WB600-GV4 (145),提取转化菌株的RNA,用特异性引物进行RT-PCR(图2-B),结果显示插入的Bpsr145片段能在B.subtilisWB600发生独立转录,表明短小芽孢杆菌中Bpsr145是一个独立的转录单元。
为了揭示Bpsr145在不同培养条件下的表达情况,分别用LB完全培养基和M9基本培养基培养B.pumilusSCU11,提取不同培养时期的RNA样品通过Northern blotting分析Bpsr145的差异表达情况。结果(图2-C)显示,在LB培养基中,Bpsr145在12 h时开始出现表达,24 h表达水平达到最高,在36~60 h又出现第2次逐步增加的趋势。在M9基本培养基中,不同的时间点都有表达且差异不大,说明Bpsr145在胁迫条件下表达水平更高。
2.3 Bpsr145的生物信息学分析
细菌非编码RNA研究表明,除了极少数的sRNA具有高度保守的特性外,大多数sRNA的序列保守性范围相对狭窄,通常只在同一属或同一种的不同菌株中存在一定的保守性。将Bpsr145序列进行nBlast比对,得到该序列与43个芽孢杆菌基因组间的保守性结果:与Bpsr145具有全长相似性的有36个菌株,相似性大于96 %,其中有15个菌株序列一致性达到了100 %,包括B.pumilus,Bacillusaltitudinis以及Bacilluscellulasensis的一些菌株,图中显示了该序列与36个菌株之间的系统进化树(图3-A),还有7个菌株只与Bpsr145序列的后半段 (77~209 bp) 具有相似性,包括B.subtilis和B.atrophaeus的一些菌株。另外通过Mfold软件对Bpsr145的二级结构进行预测(图3-B),结果显示该sRNA具有小调控RNA广泛存在的分子内碱基配对的特征结构,包含多个茎环结构,sRNA的二级结构决定了靶标特异性,它们的特定区域负责维持其稳定性并与靶标mRNA的RBS和/或编码序列(CDS)结合。
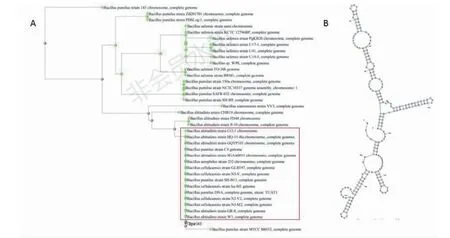
A:系统进化树,内部红色框表示含有与Bpsr145完全一致的序列的15个芽孢杆菌基因组;B:二级结构A: Phylogenetic tree of Bpsr145, the inner red box indicates 15 genomes which have the completely conserved sequence with Bpsr145;B: Secondary structure图3 Bpsr145序列保守性和二级结构分析Fig.3 Analysis of sequence conservative and secondary structure of Bpsr145
大多数位于基因间隔区的sRNA是通过与靶mRNA间不完全的碱基配对来发挥调控作用,配对区通常约10~25 bp。本实验采用TargetRNA2和CopraRNA对Bpsr145进行靶基因预测,两种软件分别预测出41和200个靶基因,结果总结在韦恩图中(图4-A)。两种软件均预测到的靶基因只有5个(图4-B),其中3个有注释信息,其余2个为未知基因:queG编码tRNA环氧鸟苷还原酶,与tRNA修饰相关;prepB编码蛋白质-精氨酸磷酸酶,与氨基酸的磷酸化相关;hepT编码庚二烯基二磷酸合酶组分Ⅱ,参与甲萘醌-7(维生素K2-7)侧链的生物合成。其他的靶基因主要涉及能量产生与转变、无机离子的转运与代谢、细胞能动性等相关功能。通过分析靶标mRNA功能,可以预测sRNA参与调节的相关生物学过程。
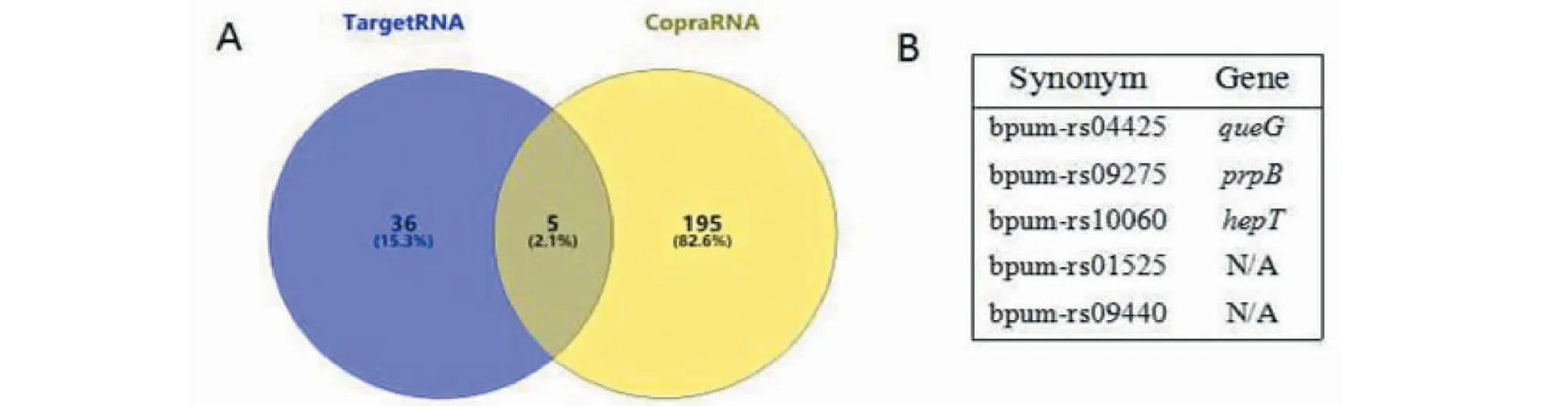
A:维恩图显示了由TargetRNA2和CopraRNA预测到的靶基因;B: 2个软件均预测到的靶基因A: Venn diagram shows the target genes predicted by TargetRNA2 and CopraRNA;B: The target genes are predicted by two programs图4 Bpsr145调控的靶基因预测Fig.4 Prediction of target genes
2.4 Bpsr145敲除菌株的构建及与野生型菌株对比
生物信息学分析、Northern blotting和独立转录实验结果表明,Bpsr145是B.pumilusSCU11中独立转录、差异表达的sRNA,要进一步研究该sRNA在短小芽孢杆菌中所参与的生理功能,最直接的方法就是建立sRNA的敲除菌株。利用带有温度敏感型复制起点的E.coli-Bacillus穿梭载体pUCETs构建Bpsr145敲除载体pUCETs-Bpsr145,然后通过电转化的方法将载体转入野生型菌株SCU11内,筛选基因敲除菌株,通过PCR和测序验证染色体上Bpsr145被kan基因取代,Bpsr145基因被成功敲除,将敲除菌株命名为B.pumilusSCU11 (Δ145) 。
首先对敲除菌株与野生型菌株在LB培养基中的生长情况进行比较,2个菌株的生长曲线显示 SCU11 (Δ145) 在进入对数期后比野生型菌株长得慢但差别不是很大,培养至24 h,野生型菌株SCU11进入稳定期,敲除菌株SCU11 (Δ145) 菌株直接进入衰亡期(图5-A)。另外测定了2个菌株在M9基本培养基中的生长曲线,得到的结果与LB培养基的结果一致,两株菌没有明显差别(结果未显示)。为了检测Bpsr145的敲除是否影响某些蛋白的表达水平,收集培养至18 h的菌株提取胞内蛋白进行SDS-PAGE分析(图5-B),发现突变菌株与野生菌株在胞内蛋白产生上也无显著差别。
除此以外,根据靶基因的预测及其涉及的生物学过程,对菌株在不同温度下(低温25 ℃,正常培养温度37 ℃以及高温45 ℃)和铁胁迫条件下 (10 μmol/L FeSO4) 的生长状况以及菌株的运动性进行测定,结果均未发现明显的表型差异。
3 讨 论
Bpsr145是笔者在短小芽孢杆菌SCU11转录组数据库中预测到的一个新的非编码sRNA,本研究通过Northern blotting和独立转录实验证实Bpsr145的真实转录,长度与预测大小209 nt相近。进一步对Bpsr145所在基因间隔区域进行开放阅读框分析,发现了一个长138 bp的开放阅读框,该开放阅读框与Bpsr145的转录方向相同,起始密码子位于Bpsr145序列中间,终止于Bpsr145的3’端后面22个碱基的位置。由于Bpsr145确切的转录起始位点并未确定,所以Bpsr145基因是否同时也编码一个小肽呢?过去常认为sRNA是不编码蛋白质的,但是随着研究的深入发现某些sRNA同时还可以编码小肽,这类sRNA被称为双功能sRNA。例如大肠杆菌中的sRNA SgrS就是一个双功能的sRNA,既具有与靶标mRNA碱基配对功能,又可以编码一个长43个氨基酸的小肽SgrT[12]。另外Matthias Gimpel 等[13]发现枯草芽孢杆菌中的SR1也是一个具有明确双功能的sRNA,一方面,它以RNA形式与精氨酸代谢相关的转录激活因子abrCmRNA的SD序列结合,抑制abrCmRNA的翻译;另一方面,SR1还能编码一个长39个氨基酸的小肽SR1P,SR1P能与GapA蛋白结合,从而稳定gapAmRNA。到目前为止,已报道的双功能sRNA数量很少,Bpsr145是一个单纯的非编码sRNA还是双功能的sRNA,这些还有待更多的实验证实。
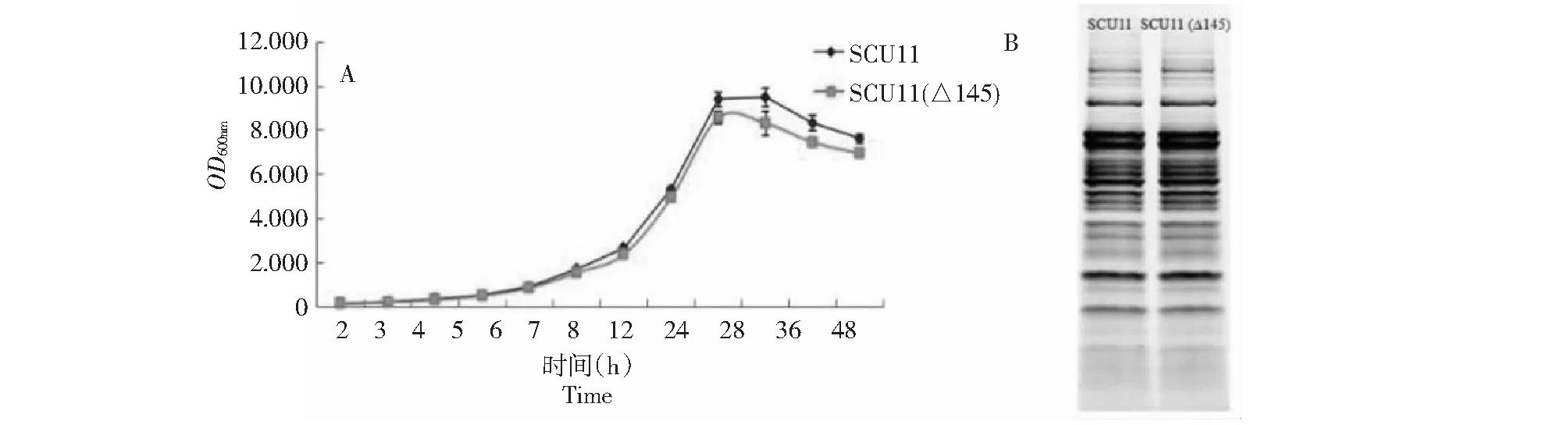
A:生长曲线;B:SDS-PAGE实验A: Growth curve;B: SDS-PAGE图5 敲除菌株与野生型菌株对比研究Fig.5 Comparative study between knock-out and wild strain
本实验构建了sRNA Bpsr145的突变菌株,结果发现Bpsr145的敲除对菌株生长过程无明显影响,胞内蛋白的SDS-PAGE分析也显示胞内表达水平高的蛋白条带无明显区别,但并不排除低表达水平的蛋白存在差异。根据已经研究出功能的sRNA来看,sRNA的主要作用是参与各种胁迫应答及毒力基因的表达,包括渗透压胁迫、酸性胁迫或氧化胁迫等,如大肠杆菌中sRNA RprA,在渗透压刺激下通过碱基配对来促进RpoS合成,使其适应环境[14];又如sRNA OxyS在氧化应激过程中被诱导产生,OxyS可以抑制fhlA和rpoSmRNA的翻译,他们分别编码RNA聚合酶的转录基活因子和σs亚基[15]。综合对Bpsr145靶基因的预测结果,其中desK与温度信号传导相关,fur与铁离子代谢相关,flgD与细菌的运动性相关,本研究对2个菌株不同温度下的生长状况、铁胁迫下生长状况、以及菌株的运动性进行了测定,结果2个菌株的生长均并未出现明显差异,说明Bpsr145可能不参与这些生理功能的调控,或者Bpsr145在这些功能中只起到协调作用,对表型的影响并不明显。其他研究者也有类似的发现,很多时候sRNA突变菌株并不会产生明显的表型变化[16]:一方面的原因可能是由于很多sRNA主要发挥协调作用而非核心调节因子,另一方面可能因为大多数的sRNA是细菌胁迫应答的产物,因此突变菌株的表型改变可能是针对特定生理条件下的细微变化。
4 结 论
本课题通过Norther blotting和独立转录实验证实sRNA Bpsr145是存在于B.pumilusSCU11中的一个sRNA,并通过Northern blotting实验进一步确认了该sRNA在不同培养条件不同生长时期存在着明显的差异表达,这也表明Bpsr145可能在某个生理过程中发挥着作用。对Bpsr145缺失菌株进行了初步分析,目前为止并没有确认Bpsr145的具体功能,但是通过对短小芽孢杆菌sRNA的研究,一方面可以丰富芽孢杆菌sRNA数据库,另外也为研究短小芽孢杆菌的作用机制提供一个新思路。
