带叶兜兰菌根真菌的鉴定及其促生作用
2021-05-25王晓国闫海霞李秀玲何荆洲周主贵
王晓国,闫海霞,李秀玲,何荆洲,周主贵*
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西农业科学院花卉研究所,广西 南宁 530007)
【研究意义】兰科菌根(OM)是兰科植物原球茎或成年植株根部与特定真菌形成的共生体,在自然界中,几乎所有的兰科植物均具有菌根,其生长和繁殖过程全部或部分依靠菌根提供养分[1]。1929年,Catoni从兰科植物中分离到真菌并在培养基上诱导形成子实体,从而极大推动了OM真菌的研究[2]。1992年,Currah建立已发现的OM真菌15属29种2个腐生类群的基本检索表,为OM真菌的分类研究提供了可靠依据和有效手段[3]。已有研究表明,大多数OM真菌已得到分离和鉴定,结合现有文献已确定OM真菌有5个类群300余种,随着检测技术和分离方法的改进,更多的OM真菌还将会被发现和报道[4]。兜兰属是兰科植物中最具特色的一个类群,主要分布于东南亚、南洋群岛及太平洋西南大洋洲岛屿国家[5],因其野生种受到过度采集和自然生境受到严重破坏[6],分布区和种群数量已急剧减少[7],其全属植物已被列入“野生动植物濒危物种国际贸易公约”(CITES)附录Ⅰ而受到严格保护[8]。兜兰在我国主要分布于西南地区和华南部分地区[9-10],广西西北部是野生带叶兜兰(PaphiopedilumhirsutissimumLindl.ex Hook)的主要分布区域,近年来广西的野生带叶兜兰分布破碎化现象加剧,种群恢复工作刻不容缓。菌根真菌的筛选和应用可提高带叶兜兰繁育的成功率,但带叶兜兰的菌根真菌种类多而杂,而迄今关于其OM真菌促生作用的研究较少。因此,鉴定带叶兜兰根段分离获得的OM真菌并分析其促生作用,对带叶兜兰种群恢复和其他种类野生兜兰的保育具有重要意义。【前人研究进展】与兰科植物形成菌根的真菌多为担子菌门的蜡壳菌(Sebacinaceae)、角担菌(Ceratobasidiaceae)、胶膜菌(Tulasnellaceae)和革菌(Thelephoraceae)等专一性较强的真菌[11],也有一些报道认为锈病菌(Pucciniomycotina)和镰刀菌(Fusarium)等真菌可与兰科植物形成菌根[12-13]。此外,OM真菌的群落结构受到多种因素影响,如有些OM真菌存在于干燥的环境,而其他真菌仅在非本地的种植园内存在[14]。不同类型兰科植物的OM真菌群落也不尽相同,侯天文等[15]研究发现,同一生境27属73种附生兰和地生兰的OM真菌群落中只有10种同时存在于附生兰和地生兰中。真菌随着植物生长季节和营养需求变化呈相似的变化规律,不同生长时期的植物需要OM真菌种类不尽相同,其中需求峰值出现在生长期而果期对OM真菌的需求大幅下降[15]。此外,对种子萌发具有促进作用的OM真菌不一定有利于种子萌发后植株生长[15-16],一些植物在种子萌发时需要的OM真菌多样性较成年后的需要更多[17],而一些在种子萌发时需要更多特异性的OM真菌[18]。【本研究切入点】目前,针对兰科植物的研究主要集中在其菌根真菌的群落组成与环境因子的关系及种子萌发方面,鲜见关于促生真菌筛选研究的报道。【拟解决的关键问题】对所收集的野生带叶兜兰根段组织分离获得的OM真菌进行形态观察和ITS序列分析鉴定,并分析部分真菌的促生作用,以期筛选出可用于兜兰保育的有效OM真菌,为带叶兜兰种群恢复和自然回归及其他种类野生兜兰的保育提供科学依据。
1 材料与方法
1.1 试验材料
野生带叶兜兰根段样品于2017年9月采自广西乐业县,收集后装于自封袋,适量填充原生境苔藓或腐殖质后带回实验室置于4 ℃短期保存。带叶兜兰组培苗带瓶炼苗10 d后移至灭菌基质中炼苗3 d,用于开展促生菌株筛选试验。
1.2 试验方法
1.2.1 OM真菌分离 采用常规组织分离法分离OM真菌[13]。对带叶兜兰根段进行镜检,选取具有菌丝团的根段,在流水下冲洗干净,用75 %酒精浸泡8 min进行表面消毒后,无菌水冲洗2次,将其浸泡于10 %次氯酸钠中充分摇动消毒8 min,再用无菌水冲洗8次后置于无菌滤纸上吸干表面水分,将根段切成1~2 mm小段后,用灭菌镊子撕开根皮将外皮层转移并贴在PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水定容至1000 mL)上,每皿放置2个根段皮层。取最后1次表面消毒的无菌水洗涤液涂布于PDA平板上检测有无杂菌污染。在25 ℃恒温培养箱培养7 d待菌落长出后,采用尖端菌丝法进行菌落分离纯化,经反复纯化直至得到纯化菌落。将纯化的菌株分别转移至斜面培养基保存备用。
1.2.2 OM真菌鉴定 结合形态学和分子生物学鉴定方法对带叶兜兰菌根真菌进行鉴定。在培养过程中,观察菌株的生长速度、菌落大小、质地和边缘等形态特征及其孢子、产孢结构和菌丝体等显微结构特征,对照相关资料及《真菌鉴定手册》初步确定菌根真菌的分类学地位。同时将纯化后的菌根真菌菌株接种至PDA固体培养基上25 ℃恒温培养。待菌丝长满培养基后,用刀片刮取菌丝,加液氮研磨成粉末后,采用CTAB基因组DNA法提取菌丝基因组DNA。ITS区段的PCR扩增采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCCG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR反应体系30.0 μl:2×TaqPCR MasterMix 15.0 μl,10 μmol/L的上下游引物各0.5 μl,模版DNA 1.0 μl,ddH2O 13.0 μl。扩增程序:95 ℃预变性4 min,95 ℃ 30 s,57 ℃ 30 s,72 ℃ 45 s,进行35个循环;72 ℃延伸5 min。PCR产物经1 %琼脂糖凝胶电泳检测后,送至生工生物工程(上海)有限公司进行测序。测序结果进行校对后,通过GenBank的Blast进行在线同源性比对,结合形态学鉴定结果明确带叶兜兰菌根的分类地位。
1.2.3 促生作用试验 将准备筛选的菌株接种到液体PDA培养基中,100 r/min、25 ℃培养10 d。培养好的菌液离心后收集菌丝并用无菌水清洗,再用无菌水稀释10倍浇灌。为确保接种成功,在种植带叶兜兰组培苗出瓶苗时用无菌水稀释的菌液蘸根,然后在接种15和30 d时再各浇灌1次,每次每株浇灌5 mL,对照组只浇灌无菌水。随机将接种后的带叶兜兰幼苗摆放在试验大棚中,温度控制在25 ℃左右,相对湿度为65 %~80 %,光照12 h/d。每个处理3次重复,每个重复30株苗,期间浇水保持基质湿润。
1.2.4 测定项目及指标 将初步筛选具有一定促生作用的10株菌株接种至带叶兜兰幼苗90 d后,清洗植株上的泥土并用吸水纸吸干植株表面水分,统计叶片数和根数,使用游标卡尺测量叶长和根长,使用分析天平秤量鲜重。
1.3 统计分析
试验数据采用SPSS 16.0进行差异显著性分析,以Graphpad 8.0制图。
2 结果与分析
2.1 OM真菌的形态观察及初步判定
OM的主要特征是在根皮细胞内形成特殊的菌丝团结构。带叶兜兰的大多数OM真菌分布在根的外皮层细胞中,多为致密或疏松的菌丝团,少数细胞内有菌丝团消解形成的针状结晶(图1)。显微镜检测结果表明,用于组织分离的153个根段中有143个根段内有OM真菌共生形成的菌丝团结构,占总根段数的93.75 %。
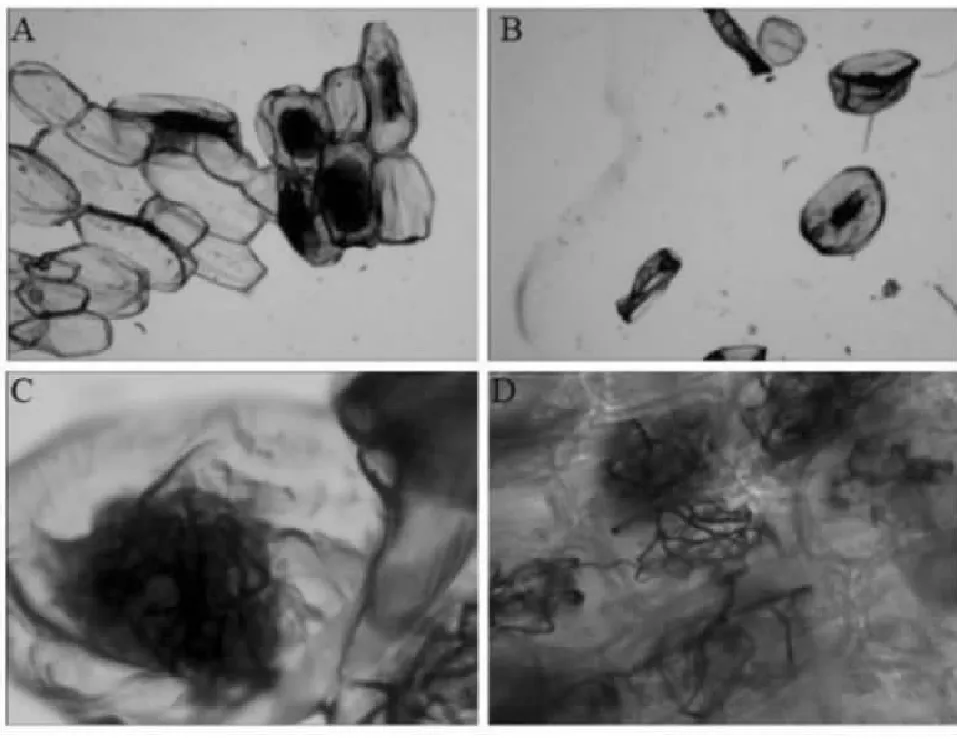
A:根段中的菌丝团;B:针状结晶;C:致密型菌丝团;D:疏松型菌丝团A:Hyphae in root;B:Needle-shaped crystal;C:Loose pelotons;D:Dense pelotons图1 带叶兜兰菌根的显微结构(20×)Fig.1 Microstructure of nutrition root seedling of P. hirsutissimun(20×)
用镊子撕开根皮,将外皮层贴在培养基上进行OM真菌分离培养,共分离出OM真菌134株。依据菌落形态、有无孢子产生和菌丝结构等进行初步判断。其中,菌落白色、淡黄色或淡红色,分生孢子呈长椭圆状或镰刀状的菌株判定为镰刀菌属(Fusarium)真菌,共42株;菌落黑灰色、有同心轮纹,气生菌丝少、子座球形的为炭球菌属(Daldinia)真菌,共20株;菌落乳白色,气生菌丝较多,菌丝成念珠状或菌丝直角分支的菌株判定为胶膜属(Tulasnella)真菌,共20株;不产孢或孢子形态不明确的未知菌根真菌30株(图2)。此外,仍有22株菌株通过基本形态只能判定到科水平。因此,依据形态特征可将大部分菌株进行分类学初步判定,而小部分菌株的显微结构极相似,依据形态学鉴定很难确定其归属,但其菌落形态存在明显差异,可进一步进行ITS序列比对分析以判定其分类地位。
2.2 OM真菌的鉴定和种类组成
对获得的OM真菌rDNA ITS序列进行比对,序列相同的判定为同一种,序列相似度在98 %以上、菌落形态和菌丝结构相似的判定为另一种,共得到82个序列,归为82种。将上述序列分别与GenBank中公布亲缘关系相近的菌种进行Blast在线比对,确定菌株的分类学地位。结果(表1)显示,鉴定的82种菌株可归为8属,隶属于2门5纲5目。其中5属归于子囊菌门(Ascomycota),其余3属归于担子菌门(Basidiomycota);在纲分类水平上,粪壳菌纲 (Sordariomycetes)为优势菌群,占总菌株数的31.3 %;在属水平上以镰刀菌属(Fusarium)、炭球菌属(Daldinia)和胶膜菌属(Tulasnella)为优势属,分别占总菌株数的31.3 %、14.9 %和14.9 %。
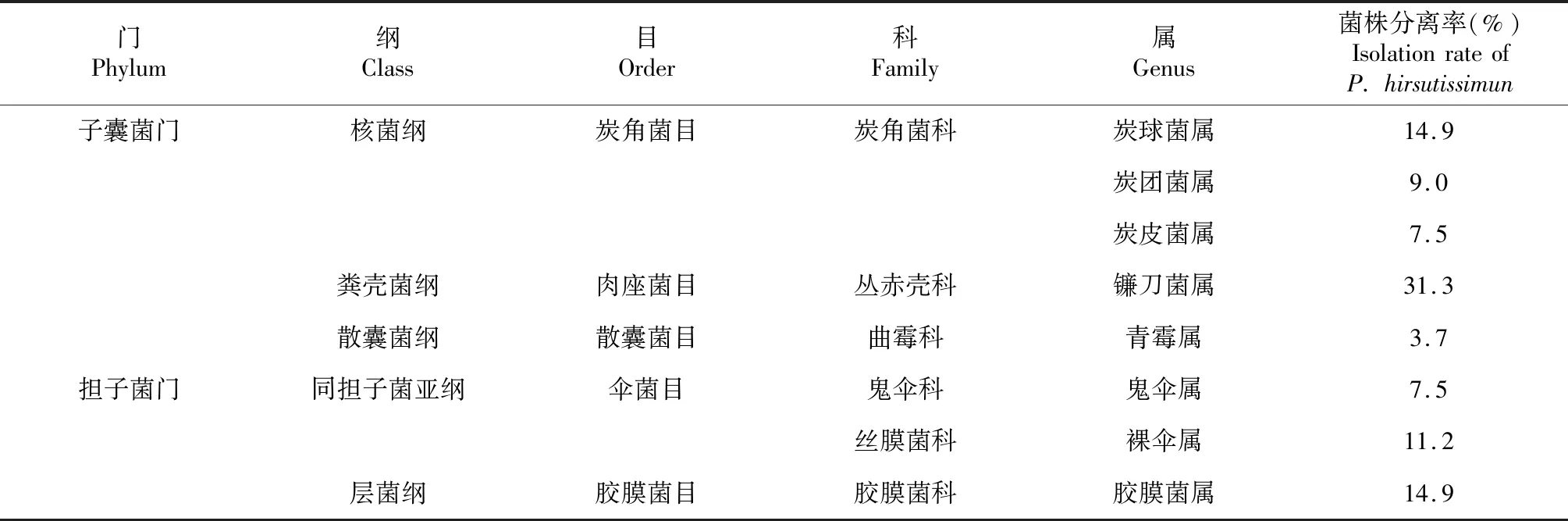
表1 带叶兜兰OM真菌的类群组成Table 1 The composition of orchid mycorrhizal fungi in roots of P. hirsutissimun
2.3 促生作用分析
将分离得到的134株菌株接种至带叶兜兰幼苗(组培苗)进行促生菌株初步筛选,结果有10株菌株表现出一定的促生作用,分别为A-8(镰刀菌属)、C-3(炭团菌属)、B-2(胶膜菌属)、G-6(炭皮菌属)、A-4(镰刀菌属)、A-6(胶膜菌属)、H-3(胶膜菌属)、H-2(胶膜菌属)、A-1(镰刀菌属)和A-11(镰刀菌属)。采用蘸根法结合浇灌法将这10株菌株接种至带叶兜兰组培苗培养90 d后,仅有4株菌株(A-6、A-8、B-2和C-3)对带叶兜兰组培苗的生长指标具有显著(P<0.05,下同)或极显著(P<0.01,下同)促生作用,其余菌株的促生效果不显著(P>0.05)(图3)。其中,胶膜菌属菌株A-6对带叶兜兰幼苗鲜重、叶长、叶数、根长和根数的促生作用均极显著大于CK(分别增大148.20 %、54.15 %、46.18 %、81.25 %和49.03 %);其次为镰刀菌属A-8,对带叶兜兰幼苗鲜重、叶长和根长的促生作用均极显著大于CK(分别增大54.18 %、60.38 %和33.65 %);胶膜菌属B-2对带叶兜兰鲜重、根数和根长的促生作用均极显著大于CK(分别增大65.53 %、33.41 %和47.81 %);其后为炭团菌属C-3,对带叶兜兰组培苗鲜重和根长的促生作用均极显著大于CK(分别增大36.05 %和45.93 %),对叶长的促生作用显著大于CK (18.11 %)。可见,A-6对带叶兜兰组培苗各生长指标的促进效果最好,A-8对带叶兜兰组培苗鲜重和叶长等的促进效果较明显,B-2对带叶兜兰组培苗鲜重、根长和根数等的促进效果较佳。说明不同属菌根真菌菌株对带叶兜兰组培苗的促生作用不同,预示不同属OM真菌对带叶兜兰植株的促生机制或促生能力存在差异,要实现利用内生菌促进带叶兜兰植株特定组织生长,必须先有针对性地筛选促进该组织生长的特定菌株。

A-1:炭球菌菌落(C-3);B-1:炭团菌菌落(G-6);C-1:胶膜菌菌落(A-4);D-1:胶膜菌菌落(H-2);E-1:胶膜菌菌落(A-6);F-1:胶膜菌菌落.(B-2);G-1:镰刀菌菌落(A-8);H-1:胶膜菌菌落(H-3);A-2:炭球菌菌丝(C-3);B-2:炭团菌菌丝(G-6);C-2:胶膜菌菌丝(A-4);D-2:胶膜菌菌丝.(H-2);E-2:胶膜菌菌丝(A-6);F-2:胶膜菌菌丝.(B-2);G-2:镰刀菌孢子(A-8);H-2:胶膜菌菌丝(H-3)A-1:Colony morphology of Daldinia sp.(C-3);B-1:Colony morphology of Hypoxylon sp.(G-6) ;C-1:Colony morphology of Tulasnella sp.(A-4);D-1:Colony morphology of Tulasnella sp.(H-2);E-1:Colony morphology of Tulasnella sp.(A-6);F-1:Colony morphology of Tulasnella sp.(B-2);G-1:Colony morphology of Fusarium sp.(A-8);H-1:Colony morphology of Tulasnella sp.(H-3);A-2:Mycelium morphology of Daldinia sp.(C-3);B-2:Mycelium morphology of Hypoxylon sp.(G-6) ;C-2:Mycelium morphology of Tulasnella sp.(A-4);D-2:Mycelium morphology of Tulasnella sp.(H-2);E-2:Mycelium morphology of Tulasnella sp.(A-6);F-2:Mycelium morphology of Tulasnella sp.(B-2);G-2:Mycelium morphology of Fusarium sp.(A-8);H-2:Mycelium morphology of Tulasnella sp.(H-3)图2 部分带叶兜兰菌根真菌的菌落和菌丝形态Fig.2 The colony and mycelium morphology of some mycorrhizal fungi from P. hirsutissimun

各小图中图柱上*表示差异显著(P<0.05),**表示差异极显著(P<0.01)* on the bar represented significant difference(P< 0.05),** represented extremely significant difference(P<0.01)图3 接种不同菌根真菌菌株对带叶兜兰幼苗生长指标的影响Fig.3 Effect of incoulation with different mycorihizal fungi strains on the seedling growth of P. hirsutissimun
2.4 菌根真菌rDNA ITS序列的系统发育分析
通过序列对比,选择32株有代表性菌株的rDNA ITS序列与下载的相似性最高的序列进行多序列比对,采用非加权组平均法(UPGMA),通过Tajima-Nei模块构建聚类树状图(图4),处于同一分支的菌株亲缘关系较近,可以判定为同一属;ITS区进化速度较快,在真菌的属、种间存在明显的丰富变异,可用其进行属及以下水平鉴定。

图4 基于rDNA ITS基因序列的部分菌根真菌的系统发育进化树Fig.4 Phylogenetic tree constructed from rDNA ITS sequences of mycorrhizal fungi isolated from P. hirsutissimun
3 讨 论
兰科植物在种子萌发或原球茎发育期对营养的需求完全依靠真菌,随着植株的生长,成年兰科植物植株具有光合作用能力后对OM真菌的依赖逐渐减弱,根中真菌定殖也呈减少趋势[19]。一些附生兰和地生兰对生长环境要求极为苛刻,其根系主要起固定植株作用,对养分的吸收能力不强,仍需依靠OM真菌提供的氮、磷和水分维持生长[20]。带叶兜兰多见于地生或石上浮生,为半附生种类,本研究中的153个根段均采自石上附生的带叶兜兰,其中有93.75 %根段检测到菌根真菌共生形成的菌丝团结构,说明带叶兜兰成年植株由于生长环境的缘故对OM真菌的依赖程度仍较高。
已有研究表明,兰科植物与特定类群OM真菌发生的共生关系并不随着地理区域的变化而变化[19],但是兰科植物除能与专一的真菌类群形成菌根外,还能与某些真菌类群形成菌根[21]。胶膜菌属为兰科植物专一性较强的真菌,均能与杓兰属和兜兰属的多数兰科植物形成OM真菌[5-9];杏黄兜兰和硬叶兜兰菌根中分离到真菌类群的镰刀菌为优势菌群[22-23];Rasmussen[4]也将镰刀菌属归为OM真菌。本研究从带叶兜兰根段中分离到134株OM真菌,归属于82种8属,其中镰刀菌属、碳球菌属和胶膜菌属为优势菌属,表明本研究分离到的镰刀菌属真菌为带叶兜兰的OM真菌。
不同生长阶段带叶兜兰植株体内的OM真菌种类和组成通常存在明显差异,从成年植株上分离到的OM真菌不一定能促进种子萌发,能促进种子萌发的真菌也不一定具有促生作用[24]。有些真菌即使能形成共生菌根,也不具有促进种子萌发或促进植株生长的作用[25]。本研究中,仅有少数菌根真菌对带叶兜兰组培苗具有显著促生作用,其中胶膜菌属真菌A-6对带叶兜兰组培苗的促生作用最大,其余胶膜菌属真菌均无显著促生作用,而无显著促生作用的胶膜菌属真菌是否在一些极端环境条件下产生保护植株或促进种子萌发的作用,有待进一步探究。此外,镰刀菌属真菌A-8也可促进带叶兜兰植株生长,与陈娟等[26]研究认为镰刀菌可促进杏黄兜兰生长、Jiang等[27]研究认为镰刀菌对黄花白芨也有促生作用的观点一致,说明镰刀菌对兰科植物的促生作用较普遍;炭团菌属C-3对带叶兜兰生长也具有促进作用,然而目前鲜见此类真菌可促进其他兰科植物生长的研究报道,因此,其形成菌根后仍需进行再分离以确定其为OM真菌或能分解木质纤维以利于带叶兜兰生长。
4 结 论
带叶兜兰根段多数定殖有OM真菌,其中的镰刀菌属、炭团菌属和胶膜菌属为优势菌属。胶膜菌属菌株A-6对带叶兜兰组培苗的促生效果最佳,镰刀菌属菌株A-8次之,胶膜菌属菌株B-2和炭团菌属菌株C-3的促生效果也较明显,这些菌株可作为保育和人工栽培带叶兜兰的菌种资源储备。
