基于高通量测序的淮山根际土壤真菌多样性分析
2021-05-25劳承英申章佑周灵芝韦本辉李艳英黄渝岚
劳承英,申章佑,周灵芝,韦本辉,李艳英,胡 泊,黄渝岚,周 佳
(广西农业科学院经济作物研究所,广西 南宁 530007)
【研究意义】淮山(DioscoreaoppositaThunb.)为药食同源的薯蓣科薯蓣属一年生或多年生单子叶缠绕性藤本植物[1],其块茎肥厚、美味、滋补,深受广大消费者喜爱,极具经济价值和市场前景[2]。但淮山块茎垂直向下生长的习性使其采收难度增加,采收成本很高[3]。为降低种植和采收难度,改变深挖沟的种植和收获方式,韦本辉等[4]发明了淮山定向结薯栽培方法(专利号:ZL200510018294.1),使淮山块茎沿着定向膜倾斜生长以方便采收,不仅节省大量人工和成本,且产出的淮山块茎粗大、笔直,产量和品质均有所提高。淮山袋料种植方法(专利申请号:CN201610241942.8)的原理与定向结薯栽培方法基本相同,是按照淮山品种特性和环境要求制作可满足其生长要求的袋料(细碎松土与肥料的混合物),最后在袋料上种植淮山和收获薯块。不管是定向结薯栽培的土壤还是袋料种植的土壤,其理化性质及微生物种类和数量均与淮山的生长和产量密切相关。已有研究表明,高通量测序(High-throughput sequencing)技术可全面、准确地获得微生物的群落结构信息,已在水稻、玉米、枸杞和油蒿等作物根际土壤的微生物研究中广泛应用[5-9],且明确了这些作物根际微生物的群落组成和多样性,但在淮山根际土壤中的应用效果尚不清楚。因此,研究淮山定向结薯栽培和袋料种植方式下淮山根际土壤微生物的种群结构,对创造有益微生物生存环境及提高袋料种植淮山的产量和质量具有重要意义。【前人研究进展】土壤微生物种群结构和多样性受土壤类型、植被类型和空气温湿度等多种自然因素及耕作、施肥和除草等人为因素的影响[10]。在不同的农业生态系统中,施用化肥土壤的微生物群落多样性与不施用化肥土壤的微生物群落存在显著差异[11]。马莹[12]研究发现,以稀释平板法测定的河南省温县怀山药土壤微生物量以细菌占多数,占总量的84.28 %~93.35 %,其次是放线菌,占6.54 %~15.64 %,而真菌仅占0.07 %~0.11 %。孙凯宁等[13]研究显示,山药连作和轮作的土壤微生物占比排序为细菌>放线菌>真菌。雷锋杰等[14]采用第二代高通量测序技术分析野生抚育模式、农田栽参模式和伐林栽参模式下人参根部的内生真菌多样性,结果发现野生抚育模式下人参根部内生真菌的Chao1指数、ACE指数和Shannon指数均高于伐林栽参模式,农田栽参模式下这3种指数均最低,表明栽培模式会显著影响人参根部内生真菌的形成及其多样性。张红霞等[15]进行连作山药根际土壤和根茎高通量测序,结果显示山药根际土壤的细菌优势群落有变形菌、绿弯菌、酸杆菌和放线菌,且土壤pH对细菌群落结构及分布具有重要影响。康捷等[16]对麻山药不同时期根际土壤进行高通量测序也发现,麻山药的根际土壤细菌多样性和丰富度在苗期、花期和收获期间无显著差异,细菌的最优菌群是变形菌门和酸杆菌门,真菌的最优菌群是放射毛霉属和被孢霉属。刘元等[17]应用GSS高通量测序技术测定怀山药根和茎的内生真菌,结果表明其根的内生真菌多样性略低于茎,葡萄孢盘菌属和链格孢属分别为根和茎的优势菌群。【本研究切入点】相比传统的微生物平板培养法和生物标记法等土壤微生物研究方法,高通量测序技术具有覆盖度更高的基因数据优势,能更真实地反映土壤微生物的多样性和丰富度,但目前以高通量测序技术对不同种植方式淮山根际土壤真菌多样性进行分析的研究鲜见报道。【拟解决的关键问题】采用高通量测序技术,通过Illumina HiSeq测序平台分析定向结薯栽培和袋料种植两种方式下淮山根际土壤真菌群落的多样性和分布规律,探明淮山袋料种植方式的土壤生态环境,为利用微生物多样性指导淮山科学种植提供参考依据。
1 材料与方法
1.1 试验材料
试验地位于广西南宁市隆安县那桐镇大滕村(东经107°52′22″,北纬22°58′11″),供试淮山品种为桂淮2号。试验地前茬作物为香蕉,种植前测定土壤速效氮含量为131.2 mg/kg,速效磷含量为34.7 mg/kg,速效钾含量为593.5 mg/kg,有机质含量为30.0 g/kg,pH 5.85。
1.2 试验方法
1.2.1 试验设计 两种种植方式的淮山均于2017年4月21日种植。设定向结薯栽培和袋料种植2个处理,3次重复,共6小区。定向结薯栽培是在起垄的垄面上斜挖一条深约15.0 cm的种植沟,斜度与水平面约成25°角,在沟上铺设淮山定向栽培专用模具(一种淮山种植的U型塑料薄膜槽,规格为长120.0 cm、宽7.5 cm、深3.5 cm),在铺设的模具上覆土约3.0 cm后播种淮山种薯,使淮山块茎膨大期的块茎顺着铺设的模具定向生长(图1);袋料种植是先在种植地上开一条深约25.0 cm、长1.2 m,斜度与水平面约成15°角的种植槽,在槽内铺设经裁剪好的塑料薄膜(普通加厚塑料膜,长120.0 cm、宽50.0 cm),并用圆形铁管或木条压紧,抽出铁管或木条后回填细碎松土,最后将塑料膜交叠成袋状,并将肥料施在头部喇叭口位置,即成袋料。种植时将种薯种在料袋头部喇叭口处,并在种薯上覆土约8.0 cm,使淮山块茎膨大期的块茎沿着塑料膜斜向下生长(图2)。

图1 淮山定向结薯栽培法Fig.1 Schematic of conventional orientation planting method of yam
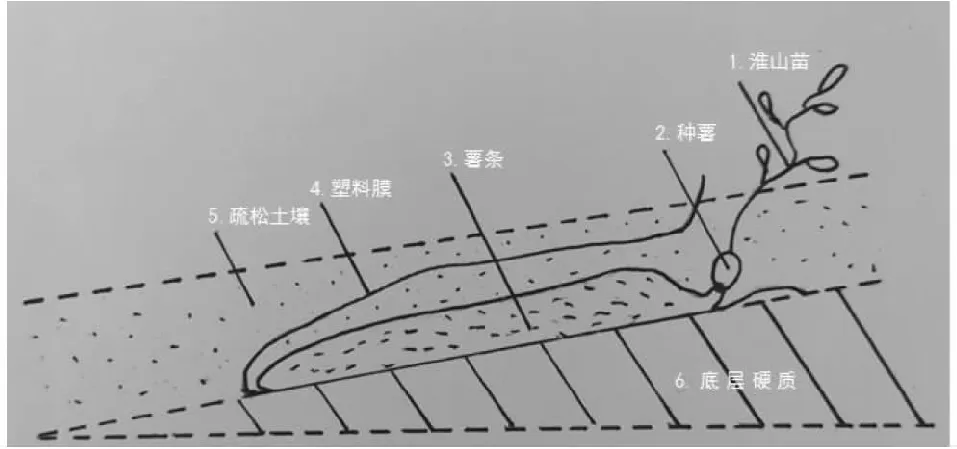
图2 淮山袋料种植法Fig.2 Schematic of bag material planting method of yam
1.2.2 样品采集 于收获期(2018年4月15日)采集淮山根际20.0 cm深的土壤样品,每小区按照S形选取6个点的土壤混匀合成1个土样,淮山定向结薯栽培的土壤样品标记为DX,袋料种植的土壤样品标记为DL。采集的样品置于50 mL无菌管,迅速放在液氮中带回实验室-80 ℃冻存,用于土壤微生物DNA提取和后续高通量测序。
1.2.3 土壤DNA提取及HiSeq测序 参照Soil DNA Kit 试剂盒说明提取土壤总DNA,根据所扩增的ITS1区域特点,基于Illumina HiSeq测序平台,利用双末端测序(Paired-end)方法,构建小片段文库进行双末端测序。通过对序列(Reads)拼接过滤和操作分类单元(OTU)聚类,进行物种注释和丰富度分析。根据物种注释结果,选取每个土壤样品在不同分类水平上丰富度排名靠前的物种及其相对丰富度制图;再对OTU进行Alpha多样性指数等的统计和分析。样品测序与分析委托北京诺禾致源科技股份有限公司完成。
1.3 统计分析
利用Uparse软件[18]对样品的全部Effective Tags进行聚类,以97 %的一致性(Identity)将序列聚类成为OTUs。使用Qiime Version 1.9.1[19]与Unit数据库[20]进行物种注释分析,并分别在门(phylum)、纲(class)、目(order)、科(family)、属(genus)和种(species)分类水平统计各样本的群落组成。使用Qiime Version 1.9.1计算Chao1、Shannon、Simpson、ACE指数和覆盖度(coverage),以SAS 9.0进行方差分析。
2 结果与分析
2.1 土壤真菌的测序结果和多样性指数
利用Illumina HiSeq测序平台对ITS1区进行测序,从淮山定向结薯栽培和袋料种植方式的土壤样品中得到用于构建操作OTU且获得注释信息的序列分别为83 457和78 991条,分别包含725和668个OUTs;两种种植方式土壤样品的测序覆盖度均为99.90 %,表明测序深度包含了样品中的绝大多数真菌,测序数据量合理。由表1可知,淮山定向结薯栽培和袋料种植的ACE指数为730.72和683.41、Chao1指数为720.87和679.48,Shannon为5.15和4.49,Simpson指数为0.91和0.88,表明袋料种植淮山土壤的真菌多样性和丰富度均低于定向结薯栽培,但方差结果显示,二者各指数间的差异不显著(P>0.05,下同),即二者的真菌多样性和丰富度相近。
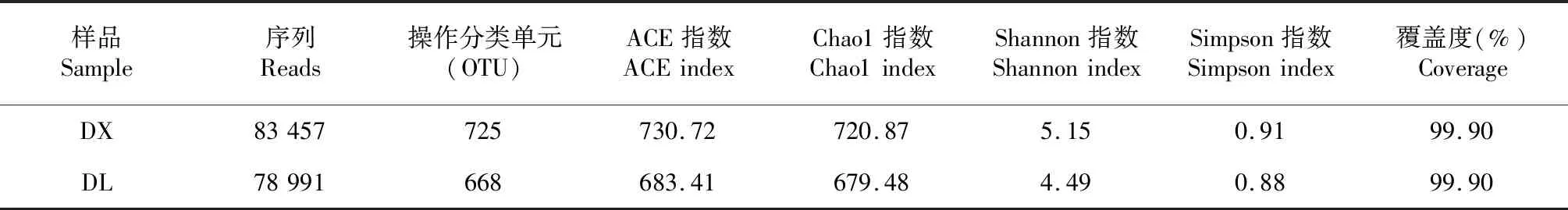
表1 淮山不同种植方式的土壤真菌高通量测序结果Table 1 Illumina HiSeq sequencing results of the fungal community in different planting methods of yam
2.2 在门水平上的土壤真菌群落丰富度分析
从图3可看出,在两种种植方式下,淮山根际土壤的真菌群落在门水平上主要有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、新丽鞭毛菌门(Neocallimastigomycota)和其他门,其中,第一优势门均为子囊菌门,其次均为担子菌门;子囊菌门和担子菌门在不同种植方式中的相对丰度总和均超过90.00 %(子囊菌门和担子菌门在定向结薯栽培淮山土壤中的相对丰度分别为80.29 %和11.09 %,在袋料种植淮山土壤中的相对丰度分别为63.95 %和27.47 %)。方差分析结果显示,在门水平上两种种植方式土壤不同菌门的相对丰度均无显著差异,说明不同淮山种植方式在门水平上未改变土壤真菌群落的相对丰度。
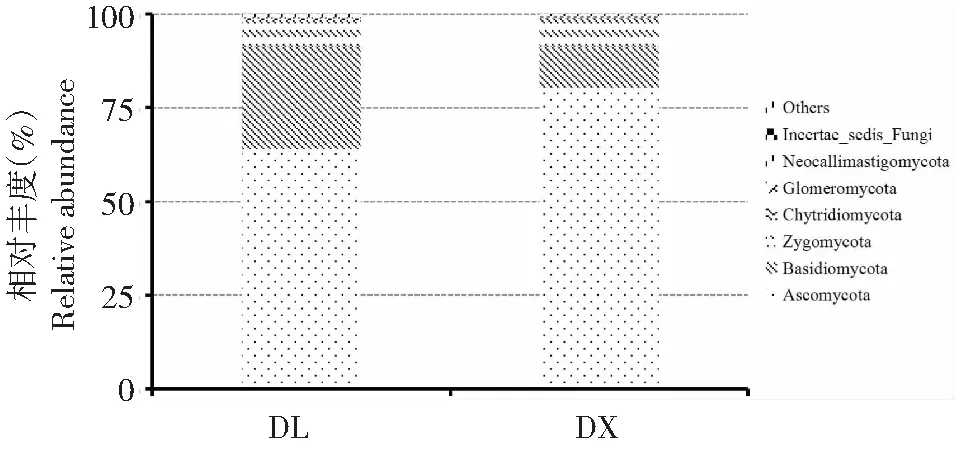
图3 两种种植方式淮山根际土壤真菌群落在门水平上的相对丰度Fig.3 Rhizosphere soil fungal relative abundance of yam on the phylum level of two planting methods
2.3 在纲水平上的土壤真菌群落丰富度分析
两种种植方式淮山根际土壤真菌群落在纲水平上分为23个类群,排名前10位的有锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)、伞菌纲(Agaricomycetes)、Incertae-sedis-Zygomycota、散囊菌纲(Eurotiomycetes)、座囊菌纲(Dothideomycetes)、Incertae_sedis_Ascomycota、盘菌纲(Pezizomycetes)、球囊菌纲(Glomeromycetes)和节担菌纲(Wallemiomycetes)(图4)。其中,粪壳菌纲为定向结薯栽培淮山根际土壤真菌群落的第一优势菌纲,相对丰度达36.37 %,其次为锤舌菌纲,相对丰度为31.14 %;而锤舌菌纲为袋料种植淮山根际土壤真菌群落的第一优势菌纲,相对丰度为29.45 %,其次为粪壳菌纲,相对丰度为28.26 %。此外,袋料种植淮山根际土壤真菌群落的伞菌纲相对丰度也较高,为26.68 %。方差分析结果显示,在纲水平上,两种种植方式下的土壤真菌群落只有伞菌纲的相对丰度间均存在显著差异(P<0.05),其他类群菌纲的相对丰度间差异不显著;淮山袋料种植与淮山定向栽培土壤的真菌群落结构总体上相似,相对丰度只存在个别差异。
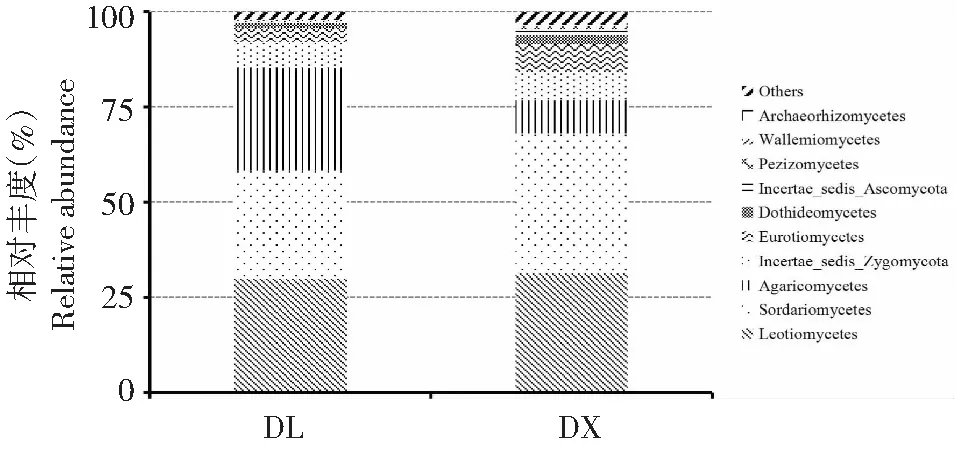
图4 数量排名前10位的两种种植方式淮山根际土壤真菌群落在纲水平上的相对丰度Fig.4 Top 10 of rhizosphere soil fungal relative abundance of yam on the class level of two planting methods
2.4 土壤真菌群落在目水平上的丰富度分析
两种种植方式淮山根际土壤的真菌群落在目水平上均分为78个类群,排名前10位的有白粉菌目(Erysiphales)、肉座菌目(Hypocreales)、Geastrales、散囊菌目(Eurotiales)、粪壳菌目(Sordariales)、微囊菌目(Microascales)、被孢霉目(Mortierellales)、糙孢孔菌目(Trechisporales)、炭角菌目(Xylariales)和格孢腔菌目(Pleosporales)(图5)。其中,第一优势菌目均为白粉菌目,其次为肉座菌目;在定向结薯栽培方式中,白粉菌目和肉座菌目的相对丰度分别达30.44 %和23.14 %,在袋料种植方式中分别为28.78 %和21.02 %。方差分析结果显示,在目水平上,两种种植方式下的土壤真菌相对丰度间均无显著差异,说明两种淮山种植方法在目水平上未改变土壤真菌群落的相对丰度。
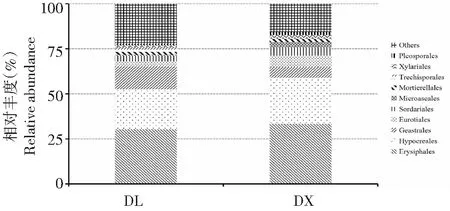
图5 数量排名前10位的两种种植方式淮山根际土壤真菌群落在目水平上的相对丰度Fig.5 Top 10 of rhizosphere soil fungal relative abundance of yam on the order level of two planting methods
2.5 在属水平上的土壤真菌群落丰富度分析
在属水平上,定向结薯栽培淮山根际土壤的真菌群落分为216个类群,袋料种植淮山的根际土壤真菌群落分为202个类群,排名前10位的有Microidium、镰刀菌属(Fusarium)、Nidulariopsis、帚枝霉属(Sarocladium)、青霉菌属(Penicillium)、头束霉属(Cephalotrichum)、Purpureocillium、粗糙孔菌属(Trechispora)、Gibellulopsis和Cosmospora(图6)。其中,两种种植方式淮山根际土壤的第一优势菌属均为Microidium,第二优势菌属均为镰刀菌属,第三优势菌属均为Nidulariopsis;在定向结薯栽培方式的根际土壤真菌中,Microidium、镰刀菌属和Nidulariopsis的相对丰度分别为30.44 %、10.90 %和5.44 %,在袋料种植方式的根际土壤真菌中,Microidium、镰刀菌属和Nidulariopsis的相对丰度分别为28.78 %、14.62 %和11.89 %。方差分析结果显示,在属水平上,两种种植方式下的土壤真菌相对丰度均无显著差异,说明两种淮山种植方法在属水平上也未改变土壤真菌群落的相对丰度。
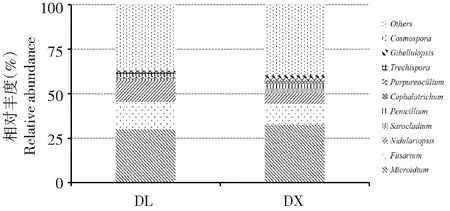
图6 数量排名前10位的两种种植方法淮山根际土壤真菌群落在属水平上的相对丰度Fig.6 Top 10 of rhizosphere soil fungal relative abundance of yam on the genus level of two planting methods
3 讨 论
子囊菌门真菌多数为腐生真菌,主要降解土壤中木质素和角质素等难降解的有机质[21],是土壤中真菌的优势菌门[22],在各种土壤生态系统中进化速率较快[23];担子菌门真菌多数为腐生或寄生真菌,也是土壤中的重要分解者,在土壤养分循环中发挥重要作用[24-26]。本研究中,淮山定向结薯栽培和袋料种植两种种植方法土壤的子囊菌门和担子菌门相对丰度总和均超90.00 %,说明两种种植方式土壤中所含的优势真菌类群能保障该种植方式下土壤的养分循环,淮山袋料种植方式具有可行性,可在旱坡地和石山地等非耕地种植;在属水平上,淮山定向结薯栽培和袋料种植两种种植方法土壤的第一优势真菌属为Microidium,是在感染白粉病的西印度醋栗根茎叶上被发现和命名并分类为白粉菌科的一个新的亚属[27],但目前暂未查阅到有关Microidium特性的报道;第二优势真菌属为镰刀菌属,是一类全球性分布的真菌,可在土壤中越冬越夏,并侵染多种植物,使植物发生较难防治的枯萎病[28-29]和根腐病[30-32]等多种病害[33],主要侵染寄主植物维管束系统,破坏输导组织维管束,并在代谢过程中产生毒素危害寄主作物,导致作物萎蔫死亡,影响作物品质和产量。已有研究表明,镰刀菌是引起香蕉枯萎病[29]、山药根腐病[30]、大蒜根腐病[31]和三七根腐病[32]等的主要菌类。谭雪莲等[34]、蔡柏岩等[35]研究显示,镰刀霉菌等土传病原真菌繁殖增多会抑制土壤细菌活性,降低各种土壤酶活性,最终导致土壤环境恶化,表明病原菌属的微小变化可能会破坏真菌群落原有结构的平衡,从而导致淮山真菌病害发生。本研究结果表明,淮山两种种植方式下土壤真菌的第二优势真菌属均为镰刀菌属,说明两种种植方式种植的淮山均有可能发生根腐病,而袋料种植方式土壤镰刀菌属的相对丰度高于定向结薯栽培土壤,表明袋料种植的淮山感染根腐病风险高于定向结薯栽培。在实际生产中,可利用微生物菌剂改善土壤微生态环境,做好根腐病的预防工作,以保证袋料种植淮山的产量和品质。
本研究采用高通量测序技术揭示两种种植方式下淮山根际土壤真菌群落的多样性,发现不同淮山种植方式在门、纲、目和属水平上均未改变其根际土壤真菌群落的相对丰度(除伞菌纲外),表明两种淮山种植方式下土壤真菌的群落组成相似,淮山袋料种植方式可行,推广应用前景可期。
4 结 论
在不同分类水平上,淮山袋料种植方式中土壤根际真菌的优势类群与定向结薯栽培方式基本相同,表明淮山袋料种植方式具有可行性;袋料种植方式土壤中的镰刀菌属相对丰度高于定向结薯栽培方式土壤,可作为改善淮山袋料种植土壤生态环境的参考依据。
