PD-1单抗联合安罗替尼、紫杉醇和顺铂在晚期食管癌中近期疗效及安全性分析
2021-05-24马晓颖翟学丽谭诗书王祥
马晓颖 翟学丽 谭诗书 王祥
食管癌是我国常见的消化道恶性肿瘤之一,早诊率低,大部分患者初次确诊时已属于局部晚期或出现转移,预后差,其五年生存率仅为10%[1]。对于晚期食管癌患者,目前以铂类、紫杉类及氟尿嘧啶等联合化疗为首选,但疗效有限,如何进一步提高疗效是临床医师的首要任务。近年,靶向和免疫治疗为多种肿瘤患者提供了新选择[2,3]。免疫检查点抑制剂在晚期食管癌中的研究也初显成效[4]。我国自主研发的抗血管生成小分子靶向药物安罗替尼在多种肿瘤中看到了一定的疗效,本研究予以PD-1单抗联合安罗替尼、紫杉醇和顺铂治疗晚期食管癌,通过分析其近疗效及安全性,为晚期食管癌患者治疗提供新思路。
1 资料与方法
1.1 一般资料 选取2019年6月~2020年6月在本院确诊的14例晚期食管癌患者为研究对象。其中男10例,女4例;中位年龄52岁,全部患者均经病理组织学确诊的Ⅲ、Ⅳ期食管鳞癌患者。纳入标准:所有患者均有客观肿瘤大小指标可评价疗效,既往未接受过系统抗肿瘤治疗的患者,美国东部协作肿瘤组(ECOG)体能状况(PS)评分:0~1分,预期存活至少6个月以上,且无严重心、脑血管疾病,无严重肝肾功能障碍,患者知情同意。
1.2 方法 采用PD-1单抗(特瑞普利单抗)联合安罗替尼、紫杉醇和顺铂治疗,1次/3周。静脉滴注特瑞普利单抗(200 mg,d1)、紫杉醇脂质体(150 mg/m2,d1)、顺铂(20 mg/m2d1~3),口服安罗替尼(8 mg,d1~14),4~6周期后予以特瑞普利单抗单药或联合安罗替尼维持治疗。直至疾病进展或出现不可耐受的毒性反应。每次治疗前检查血常规、肝肾功能及心电图,治疗2次后行增强CT检查评价疗效。
1.3 观察指标及判定标准 ①记录患者症状改变及不良反应;②按实体瘤疗效评价标准(RECIST)客观评价疗效。ORR=CR+PR,DCR=CR+PR+SD。
1.4 统计学方法 采用SPSS19.0统计学软件处理数据。计数资料以率(%)表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 近期疗效 14例患者中其中CR有1例、PR有9例、SD有3例、PD有1例,ORR为71.4%,DCR达92.9%。
2.2 不良反应 主要不良反应为白细胞、粒细胞缺乏,其次为乏力、消化道反应以及手足皮肤反应、转氨酶升高、高血压以及咳血,患者均可耐受,经治疗后好转或缓解。无治疗相关死亡患者。见表1
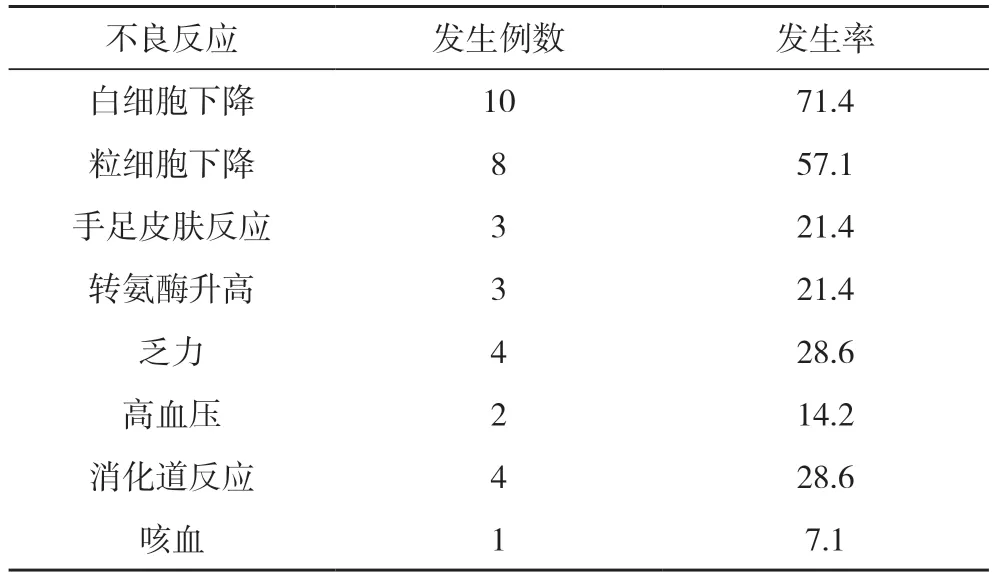
表1 14例患者治疗过程中的不良反应发生情况(n,%)
3 讨论
食管癌是最常见的恶性肿瘤之一,我国是食管癌高发区,全球近半数的食管癌发生于中国。大约90%食管癌为食管鳞癌。食管癌恶性程度高,侵袭性强,预后差,中位生存期一般只有7~12个月。从肿瘤的病因出发,食管癌是一个涉及多因素、多阶段、多基因变异积累的复杂肿瘤。除了与饮食习惯、遗传易感性、真菌病毒等有关,还与营养等其他因素有关。近年来有研究发现与食管癌发生发展密切相关的还有某些微量元素如硒、锌、铜、铁和钙在体内及土壤中的含量变化。很多遗传学和分子学家从染色体和基因水平对食管癌的发病原因进行更深入的研究,发现在食管癌肿瘤细胞中有很多异常表达的基因,食管上皮细胞的正常生长发育因受到了这些抑癌基因的突变或杂合性缺失的影响,导致细胞在分化过程中异型增加,引起细胞癌变。此外有研究认为食管腺癌发病高危因素为肥胖和胃食管反流,肥胖可使腹腔内压增高,引起胃食管反流疾病,频发的反流反复刺激食管黏膜而导致食管上皮细胞的慢性损伤,导致癌前病变的发生。被称为内源性二级胺的物质,如牛黄胆酸、鹅胆酸等存在于反流液中,他们能够与胃液中的亚硝酸盐反应生成致癌物亚硝酸,从而导致食管等部位的肿瘤发生。从肿瘤的生物学特征出发,食管癌是一个异质性比较强的肿瘤,具有高频率的非同义突变、放射敏感性等生物学特征,中国食管癌患者的肿瘤生物学特征方面又与国外存在一定差异,其主要体现的是内皮生长因子受体(EGFR)路径信号传导、与细胞周期活跃相关的几大特征性细胞信号传导通路。因此与国外相比治疗策略也有差异。
化疗是食管癌不可或缺的治疗手段,在综合治疗中起着重要作用,在晚期食管癌中目前国内外指南推荐的方案是氟尿嘧啶类药物/紫杉类药物联合铂类药物,较多临床试验证实化疗可改善晚期食管癌患者的生存,提高患者的生活质量[5]。以顺铂为主的铂类单药有效率为21%左右。目前铂类已被公认为是治疗食管癌联合化疗方案中的主要药物之一,与其他化疗联合可将有效率提高到25%~35%。紫杉类药物一线治疗晚期食管癌有效率为25%~30%,中位生存时间4.2个月,联合铂类有效率可达60%。临床疗效明显提高。但总体疗效仍较差。如何进一步提高化疗疗效,降低毒副作反应、延长生存是我们研究的重点。
在肿瘤细胞的发生发展过程中,还伴随着细胞基因的突变,同时表达一些新的抗肿瘤抗原。机体的免疫系统可识别这些新的抗原,并通过天然和活动性免疫机制杀伤肿瘤。另外,免疫逃逸也是肿瘤细胞常见的现象。如果免疫原性低机体就不能有效免疫应答,肿瘤细胞还可凭借多种方式逃避免疫系统的监控而生长增值。肿瘤免疫治疗是通过提高肿瘤免疫细胞的免疫原性以及增强对效应细胞杀伤的敏感性,激发和增强机体的抗肿瘤免疫应答。PD-1是近年来发现一种负性共刺激分子。PD-1与程序性死亡受体配体1(PD-L1)之间的相互作用可以抑制T细胞迁移、增值和分泌细胞毒性介质,使肿瘤细胞逃避机体的免疫监控和杀伤。另外,PD-L1也可通过与抗原递呈细胞(APC)上的CD80结合,抑制免疫应答。许多人类肿瘤组织中均可检测到PD-L1蛋白的表达,肿瘤细胞上的PD-L1因为肿瘤特殊部位微环境的影响,表达增多,肿瘤的发生和生长与PD-L1表达密切相关,PD-L1表达可诱导抗肿瘤T细胞的凋亡。PD-1抑制剂及PD-L1抑制剂是免疫治疗的重要组成部分,通过阻断相互作用,恢复T淋巴细胞的抗肿瘤活性,增强免疫应答,减少肿瘤细胞的增值及转移。近年来,PD-1在食管癌中有了初步的研究,研究人员采用免疫组化法检测食管鳞癌的手术标本中PD-1表达情况,结果发现PD-1在正常的食管组织中的表达率为5.3%,在癌旁不典型增生组织中的表达率为20.9%,在肿瘤组织中的表达率为60.2%,由此表明,PD-1在肿瘤组织中的表达率最高。关于PD-1/PD-L1在食管癌治疗中的研究已经开始崭露头角。2018年的美国临床肿瘤学会(ASCO)上KEYNOTE-180研究[6]报告了Pembrolizumab在三线晚期食管鳞癌患者的疗效,ORR为14%,无进展生存期(mPFS)和总生存期(mOS)分别为2.1个月和5.8个月,且安全性可耐受,中国学者报到了国产PD-1单抗卡瑞利珠单抗在晚期食管鳞癌中的研究,ORR为33.3%,DCR为56.7%。mPFS为3.6个月。在二线治疗上2019年ESMO大会报告了KEYNOTE-181研究[7]的中国人群分析结果显示mOS为12.0个月、ORR为24%。尽管这些研究明确了PD-1在晚期食管癌中的疗效。但是PD-1单药治疗客观有效率相对不高,联合治疗是未来的趋势。且有研究表明化疗治疗能够导致肿瘤组织中PD-L1的表达发生变化。因此临床上治疗肿瘤患者时常采用化疗联合PD-1增加疗效。
抗血管生成靶向治疗是近几年来新的抗肿瘤治疗策略,它能针对性有效阻止新生血管的生成。一旦肿瘤组织的血供和营养被减少或阻断,肿瘤细胞的生长就会被有效的抑制。在血管构成上,内皮细胞、周细胞和平滑肌细胞等细胞组成了新生血管,在缺氧情况下肿瘤组织可产生血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)和成纤维细胞生长因子(FGF),它们分别通过与内皮细胞、周细胞和平滑肌细胞表面的络氨酸激酶受体结合,新生血管的信号通路被激活。安罗替尼是我国自主研发的新型多靶点的小分子受体酪氨酸激酶抑制剂(TKI)药物,通过抑制血管内皮细胞生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、c-Kit等激酶来阻止新生血管的生成和抑制肿瘤生长与发展。VEGFR-2酪氨酸激酶的腺苷三磷酸与安罗替尼的吲哚基团相结合后,VEGFR-2可被有效的抑制,进而抑制血管新生。此外,在淋巴管生成过程中发挥重要作用的是VEGFR-3,安罗替尼还高效地作用于VEGFR-3的表面,在一定程度上抑制了肿瘤细胞转移。安罗替尼还可以抑制间质上皮转化因子(Met)、VEGFR-2的磷酸化和下游信号通路的激活,从而抑制肿瘤的生长。另外有临床前试验表明安罗替尼可增强肿瘤细胞对化疗的敏感性。其在肺癌、软组织肉瘤、肝癌等多个瘤种都取得较好的疗效。ALTER0302试验在晚期NSCLC患者研究中表明安罗替尼组对比安慰剂PFS和mOS都有延长。NCT01878448试验[8]表明安罗替尼在常规治疗失败的晚期STS患者具有很好的临床获益。另外安罗替尼在NCI-H1975细胞源性肿瘤移植模型中研究提示安罗替尼治疗治疗晚期肿瘤患者的临床疗效可通过检测血清趋化因子配体(CCL2)水平的变化来判断。我们还需进一步的研究该药的生物标志物及耐药机制。并积极探索安罗替尼如何更好的与化疗、靶向、免疫相结合。
本研究采用免疫、靶向、化疗联合治疗,结果提示PD-1单抗联合安罗替尼、紫杉醇和顺铂治疗晚期食管癌DCR达92.8%,近期临床疗效较好,不良反应可耐受。PFS及OS目前在进一步观察中,值得期待。本研究中免疫、靶向、化疗联合治疗在晚期食管癌中的取得了较好的疗效。为晚期食管癌一线治疗提供了的新治疗模式。但联合用药过程中药物剂量、强度以及治疗疗程需进一步评估。
