重组耐热β-葡萄糖苷酶的固定化及其对黄酮糖苷的定向转化
2021-05-20解静聪
解静聪,徐 浩,张 宁,杨 静,赵 剑
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
黄酮类化合物是一类在自然界中广泛存在的次级代谢产物,其母核结构为2-苯基色原酮。目前较为常见的黄酮类化合物主要是黄酮醇类、黄酮类以及异黄酮类。据报道,黄酮类化合物具有广泛的生物活性,在抗肿瘤、降血糖、抗病毒、抗衰老、保护心脑血管、免疫调节和预防骨质疏松等方面具有显著的功效[1],已成为目前研究的热点。作为次级代谢产物,黄酮类化合物常与葡萄糖等单糖以O-糖苷形式存在于植物体内,因此从植物原料中提取获得的黄酮类化合物通常为黄酮糖苷。研究表明,黄酮苷元的生物活性及生物利用率显著高于黄酮糖苷[2],如银杏黄酮苷元的抗氧化功效是黄酮糖苷的7倍[3]。黄芩素(黄芩苷元)较其糖苷形式黄芩苷更易被人体吸收[4]。槲皮素是一种黄酮醇,具有抑制多种肿瘤细胞生长,同时抑制肿瘤血管生成的功效[5-7]。大豆苷元是最为常见的一种异黄酮,在大豆中含量较高,其对多种癌细胞具有抗增殖和抗转移功能[8]。同时,大豆苷元对心脑血管也具有显著的保护作用[9]。淫羊藿素是一种特殊的异戊烯基黄酮醇,同时也是淫羊藿黄酮中的稀有组分,具有广泛的生物活性。淫羊藿素对肝癌、乳腺癌、膀胱癌及结肠癌等肿瘤细胞增殖具有显著的抑制作用[10-13]。生物酶法具有选择性强、转化效率高等优点,目前已被应用于黄酮糖苷的糖基脱除转化[14-15]。
目前,制约生物酶大规模应用的瓶颈之一是其使用成本过高。酶的固定化技术不仅保证了生物酶本身高效专一的优势,而且可以实现酶蛋白多次重复回收,可控连续化反应,以及高稳定性贮存的目标[16],提高了生物酶的利用率,降低了酶使用成本,能够有效地节省酶制备的能源和资源,符合可持续发展战略的要求。作者所在实验室的前期研究中,从极端嗜热微生物燃球形菌IgnisphaeraaggregansDSM17230的基因组中克隆了一种耐热β-葡萄糖苷酶基因IgagBgl1,并在大肠杆菌中实现了高效异源表达,该重组耐热β-葡萄糖苷酶能够有效地转化多种黄酮糖苷,生成生物活性更强的黄酮苷元。本研究对耐热β-葡萄糖苷酶的固定化及其性能,以及对黄酮糖苷的转化展开了研究,以期进一步提高酶的稳定性,实现对重组酶的多次重复使用,从而降低重组酶在黄酮糖苷生物转化方面的使用成本。
1 实 验
1.1 原料、试剂和仪器
对硝基苯基-β-D-葡萄糖苷(pNPG)购自Sigma公司,异槲皮素、槲皮素、大豆苷、大豆苷元、淫羊藿次苷I以及淫羊藿素的标准品(纯度均大于99.5%)均购自于中国科学院成都生物研究所。海藻酸钠、氯化钙和戊二醛等试剂均为分析纯。重组耐热β-葡萄糖苷酶(2 000 U/mL,pH值6.0)由本实验制备纯化浓缩并保存于-20 ℃。
HH-2数控水浴锅,上海维诚公司;Synergy HTX全波段读板机,美国BioTek公司;Avanti JXN-30冷冻离心机,美国Beckman Coulter公司。
1.2 固定化重组酶制备方法及单因素试验优化
配制不同质量分数(1%、 1.5%、 2%、 2.5%和3%)的海藻酸钠溶液,取1 mLβ-葡萄糖酶液(酶活力2 000 U/mL,pH值6.0)分别添加到100 mL不同质量分数海藻酸钠溶液中,充分混匀。再向混合溶液中加入戊二醛并充分混匀,于4 ℃下静置2 h。此时混合溶液中β-葡萄糖酶酶活力约为20 U/mL。将混合溶液缓慢滴入500 mL氯化钙溶液中,将过滤得到的颗粒置于质量分数4%的氯化钙溶液中硬化,再将过滤所得颗粒于4 ℃下置于0.025%的戊二醛溶液中进行2.5 h再交联。以25 mmol/L 柠檬酸-磷酸氢二钠缓冲溶液(pH值6.0)冲洗过滤所得颗粒。吸干颗粒表面水分后,进行真空干燥获得固定化酶颗粒[17-19]。
优化重组酶固定化条件的单因素设计:在制备重组酶固定化颗粒过程中,向海藻酸钠-耐热β-葡萄糖酶混合溶液中添加戊二醛,戊二醛的最终质量分数分别为0%、 0.5%、 1%、 1.25%、 1.5%和2%;将海藻酸钠-耐热β-葡萄糖酶-戊二醛混合溶液滴加至氯化钙溶液中,氯化钙溶液的质量分数分别为1%、 1.5%、 2%、 2.5%、 3%和3.5%;所形成的酶固定化颗粒被置于质量分数4%的氯化钙溶液中硬化,硬化时间分别为1、 1.5、 2、 2.5、 3、 3.5和4 h。
1.3 游离酶、固定化酶的活力测定
在170 μL去离子水中加入10 μL 500 mmol/L柠檬酸-磷酸氢二钠缓冲溶液(pH值3.0~8.0)及10 μL 20 mmol/LpNPG溶液,在95 ℃水浴锅中孵育10 min后,再加入0.15 μgβ-葡萄糖苷酶(游离)或0.3 mg不同条件下制得的固定化酶颗粒,反应10 min后加入600 μL 1 mol/L 碳酸钠溶液,终止反应并显色。离心后取上清液在405 nm下测定吸光度值。酶活力定义为在最适酶反应条件下,每分钟水解pNPG释放1 μmol对硝基苯酚所需的游离酶(或固定化酶)的量为1个游离酶(或固定化酶)活力[20]。
酶的固定化率以载体颗粒上所固定的酶的酶活作为评价指标,在最适酶反应条件下,固定化酶显示的酶活性与固定化体系中所添加游离酶的总活性的比值即为固定化酶的固定化率。
1.4 酶学性质的测定
1.4.1最适反应pH值和最适反应温度 最适酶反应pH值测定:柠檬酸-磷酸氢二钠缓冲溶液pH值在 3.0~8.0 范围内,95 ℃条件下,在1.3节所述酶活力测定体系下检测游离酶和固定化酶的最适反应pH值。以不同反应pH值下测得最大酶活力值作为相对酶活力100%。
最适酶反应温度测定:在50~100 ℃范围内,每隔5 ℃在1.3节所述酶活力测定体系下检测游离酶和固定化酶的酶活力。以不同反应温度下测得最大酶活力值作为相对酶活力100%。
1.4.2热稳定性测定 将游离酶和固定化酶分别置于20 mmol/L pH值6.0缓冲溶液中,于90 ℃条件下水浴孵育3 h,在孵育10、 20、 40、 60、 80、 100、 140和180 min后分别取样,置于冰浴中。以置于20 mmol/L pH值6.0缓冲溶液冰浴的游离酶和固定化酶为对照(相对酶活力100%),在1.3节所述酶活力测定体系下,测定不同孵育时间的游离酶和固定化酶的酶活力。其他条件下的酶活力情况以酶活力损失率表示。
1.4.3酸碱稳定性测定 将游离酶和固定化酶分别置于不同pH值(3.0~8.0)的20 mmol/L缓冲溶液中,然后置于70 ℃条件下水浴孵育1 h后在冰浴下保存,在1.3节所述酶活力测定体系下,分别对游离酶和固定化酶样品的酶活力进行测定。以不同pH值缓冲液冰浴下保存的游离酶和固定化酶样品的酶活力值作为对照,其他条件下的酶活力情况以酶活力损失率表示。
1.4.4固定化酶重复使用性能测定 取固定化酶0.3 mg,在1.3节所述酶活力测定体系下进行反应,以冰浴终止反应,离心后分离出固定化酶颗粒,再次添加到酶活力测定体系中进行反应,循环使用20次,测定固定化酶颗粒的酶活力,评价其重复过程中残余酶活力的变化情况。
所有试验所得数据均为3次平行试验的平均值。
1.5 固定化酶转化黄酮糖苷生成黄酮苷元
以3种50 g/L黄酮糖苷(异槲皮素、大豆苷和淫羊藿次苷I)分别作为底物,于固定化酶转化黄酮糖苷的反应体系中添加20 μL底物,5 μL二甲基亚砜作为助溶剂及475 μL柠檬酸-磷酸氢二钠缓冲溶液(25 mmol/L,pH值7.0)。在酶转化体系中,添加33 mg固定化酶颗粒,在最适酶条件(95 ℃,pH值7.0)下反应2 h,分别转化获得槲皮素、大豆苷元和淫羊藿素。在保温10、 20、 40、 60、 80、 100和120 min后分别取样,加入适量甲醇稀释样品,进行HPLC检测并获得底物的转化率。
1.6 黄酮糖苷的HPLC检测及其标准曲线绘制
1.6.1标准品溶液的配制 将6种标准品分别配置为1 g/L的母液,稀释至终质量浓度为0.01、 0.02、 0.04、 0.06、 0.08、 0.10、 0.15和0.20 g/L的标准溶液。
1.6.2异槲皮素和槲皮素的标准曲线绘制 固定相为Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇与质量分数0.1%乙酸水溶液的混合溶液(体积比55 ∶45),流速为0.8 mL/min,在360 nm处检测吸光度值。以峰面积为纵坐标(Y),标准品质量浓度为横坐标(X)绘制标准曲线。异槲皮素的标准曲线:Y=393.894X+2.471,R2=0.997 3;槲皮素的标准曲线:Y=415.461X+1.045,R2=0.993 5。
1.6.3大豆苷和大豆苷元的标准曲线绘制 方法与槲皮素类似,只是流动相中甲醇与质量分数0.1%乙酸水溶液体积比40 ∶60,检测波长254 nm。大豆苷的标准曲线:Y=385.93X+6.620,R2=0.994 1;大豆苷元的标准曲线:Y=499.752X+5.534,R2=0.997 8。
1.6.4淫羊藿次苷I和淫羊藿素的标准曲线绘制 固定相为Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm),经乙腈和0.1%乙酸水溶液的混合溶液进行梯度洗脱(0~20 min乙腈和0.1%乙酸水溶液的体积比为70 ∶30~90 ∶10),流速为0.8 mL/min,检测波长270 nm。淫羊藿次苷I的标准曲线:Y=502.549X+2.192,R2=0.999 1;淫羊藿素的标准曲线:Y=587.514X+3.574,R2=0.999 5。
2 结果与分析
2.1 固定化重组耐热β-葡萄糖苷酶的条件优化
2.1.1海藻酸钠质量分数 当氯化钙质量分数为2%,戊二醛质量分数为1.5%,颗粒硬化时间为3 h时,考察海藻酸钠质量分数对固定化酶的影响。如表1所示,当海藻酸钠质量分数为1.5%时,固定化效果最好。随着海藻酸钠质量分数的提高,重组酶固定化的效果呈显著降低的趋势。当海藻酸钠质量分数低于1.5%时,固定化酶颗粒的重组酶回收率较低,这可能是由于低质量分数海藻酸钠形成的凝胶空隙大小不利于重组酶的吸附固定。因此,海藻酸钠质量分数为1.5%是制备该重组耐热β-葡萄糖苷酶固定化颗粒的最适条件。
2.1.2氯化钙质量分数 选择海藻酸钠质量分数为1.5%,其他条件同2.1.1节,考察氯化钙质量分数对固定化酶的影响,结果如表1所示。
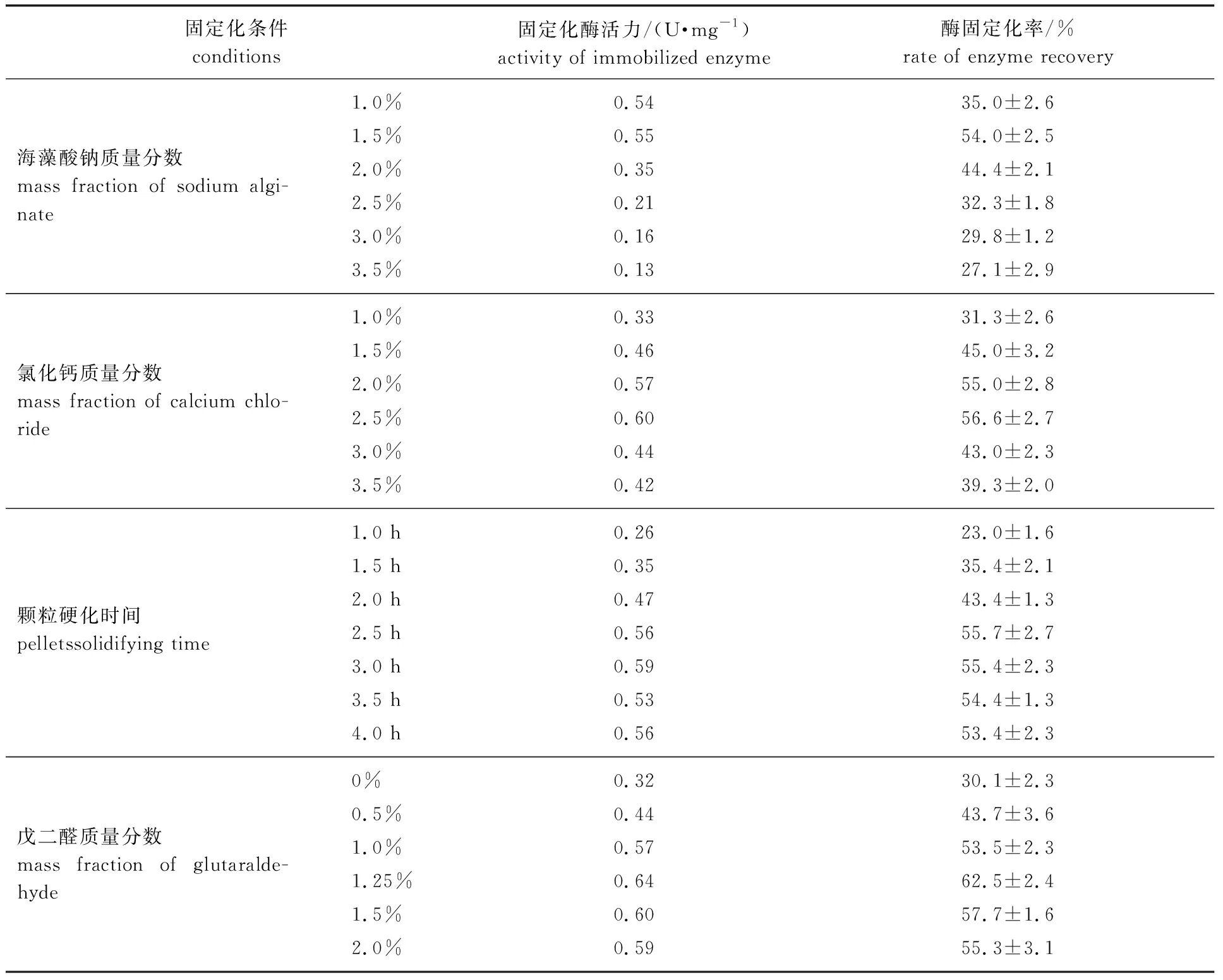
表1 不同条件对固定化酶的影响
由表1可知,氯化钙质量分数为2.0%和2.5%时,重组酶固定化率较高,固定化效果较好。海藻酸钠与钙离子可通过离子交换不可逆地形成海藻酸钙凝胶,当氯化钙质量分数低于1.5% 时,可能导致凝胶的交联作用强度降低,不利于重组酶的吸附固定,特别是当氯化钙质量分数为1.0%时,所制得凝胶颗粒的机械强度显著低于高浓度氯化钙溶液中制备的凝胶颗粒。考虑到固定化效果和机械强度的平衡,选择氯化钙质量分数为2.5%。
2.1.3颗粒硬化时间 固定化凝胶颗粒的硬化是外部溶液中钙离子逐渐置换凝胶内部钠离子,形成内部交联体系的过程。选择海藻酸钠质量分数为1.5%、氯化钙质量分数为2.5%,其他条件同2.1.1节,考察颗粒硬化时间对固定化酶的影响,结果如表1所示。重组酶的固定化率随颗粒硬化时间的延长呈先增加后基本不变的趋势,硬化时间为2.5 h时达到最佳值。这可能是由于孵育时间过短,凝胶中离子交换不够彻底,导致交联体系稳定性不足,影响了重组酶的吸附和固定,最终导致了凝胶颗粒中重组酶固定化率偏低的结果。因此,选择颗粒硬化时间为2.5 h。
2.1.4戊二醛质量分数 戊二醛是酶固定化中常用的交联剂,其两端的醛基活性较强,可促进载体和重组酶交联状态的形成,提高凝胶颗粒的结构稳定性。在海藻酸钠质量分数1.5%、氯化钙质量分数2.5%和颗粒硬化时间2.5 h条件下,考察戊二醛质量分数对固定化酶的影响,结果如表1所示。由表1可以看出,重组酶固定化后的固定化率随戊二醛质量分数的升高显著提高,当戊二醛质量分数达到1.25%时,凝胶颗粒对酶的固定化效果达到最佳;随着戊二醛质量分数的继续升高,固定化效果无显著提高。特别是当戊二醛质量分数提高至2.0%时,反而显著降低了固定化酶的固定化率。因此,选择戊二醛质量分数为1.25%。
由此可见,重组耐热β-葡萄糖苷酶固定化的较佳条件为:在pH值6.0,室温条件下,海藻酸钠质量分数1.5%,氯化钙质量分数2.5%,戊二醛质量分数1.25%,硬化时间为2.5 h。在此条件下,酶固定化率可达62.5%。
2.2 固定化酶与游离酶的酶学性质比较
2.2.1固定化酶的最适反应pH值和温度 固定化重组酶是期望其在保有游离酶优异性质的同时,在酶稳定性和酶重复使用等方面有所提高,达到降低酶使用成本的最终目的。因此,固定化重组酶的酶学性质也是评价其固定化效果的重要因素。
根据2.1节较优固定化条件,制备获得了重组耐热β-葡萄糖苷酶的固定化酶。将固定化酶分别置于95 ℃的不同pH值缓冲溶液体系中,测酶的活力和稳定性,结果如图1(a)所示。固定化酶较游离酶的最适合反应pH值向中性略有偏移。同时,固定化酶相比游离酶具有更宽的适应范围。这是因为固定化载体上的负电荷可能改变了重组酶表面水化层的电荷分布,使得酶分子在碱性条件也下显示出较高的酶活力。

图1 固定化酶的最适反应pH值(a)和最适反应温度(b)
在游离酶与固定化酶各自最适pH值,测定游离酶与固定化酶的最适反应温度,结果如图1(b)所示。与游离酶相比,固定化酶的最适反应温度为95 ℃,与游离酶相比未显示出显著的变化。当反应温度在60~100 ℃之间,固定化酶的相对酶活力均高于游离酶,可能是酶分子与海藻酸钙凝胶的交联作用提高了酶分子的结构稳定性,使得固定化酶在高温条件下稳定性优于游离酶,从而提高了固定化酶在高温条件下的催化性能。
2.2.2固定化酶的热稳定性 将固定化酶置于pH值6.0缓冲溶液中,按照1.4.2节操作测固定化酶在90 ℃条件下的热稳定性,结果见图2。固定化酶较游离酶显示出更好的热稳定性,在90 ℃下保温3 h 后酶活力损失率为10%左右,在相同条件下游离酶的酶活力损失率约为28%,可能是酶分子与固定化介质之间的多点交联,稳定了酶分子的三维结构,从而增强了酶蛋白天然构象的稳定性,延缓了高温条件下酶蛋白的失活过程。

图2 固定化酶的热稳定性
2.2.3固定化酶的酸碱稳定性 将固定化酶分别置于95 ℃的不同pH值缓冲溶液体系中,测酶的酸碱稳定性,结果见图3。固定化酶的酸碱稳定性变化趋势与游离酶一致,但固定化酶的酶损失率在pH值3.5~8.0条件下均略低于游离酶。可能是由于海藻酸钠凝胶对酶分子表面水化层的稳定性具有增强作用。
2.2.4固定化酶的重复使用性能 固定化酶经过10次重复使用后,其残余酶活力如图4所示,固定化酶仍能保留75%左右的残余酶活力。重复使用20次后,虽然残余酶活力显著下降,但仍能保留55%以上的残余酶活力。重复使用后固定化酶活力下降的原因可能是,固定化酶颗粒在最适反应温度和终止反应温度之间反复变化,影响了固定化酶与介质之间交联结构的稳定性,使得酶分子从固定化介质中释放出来,从而导致其固定化酶活力的降低。

图4 固定化酶重复使用的稳定性Fig.4 The reusable stability of the immobilized enzyme
2.3 固定化酶转化黄酮糖苷生成黄酮苷元性能的比较
异槲皮素、大豆苷及淫羊藿次苷I经固定化酶转化为槲皮素、大豆苷元和淫羊藿素的时效曲线见图5。
由图5可知,2 g/L异槲皮素经固定化酶转化 100 min后,几乎完全转化为1.294 g/L的槲皮素,摩尔转化率为99.37%。2 g/L大豆苷经固定化酶转化 80 min 后,得1.455 g/L的大豆苷元,摩尔转化率为97.21%。2 g/L淫羊藿次苷I经固定化酶转化 120 min 后,生成1.427 g/L的淫羊藿素,其摩尔转化率为97.93%。固定化酶对3种黄酮糖苷均具有好的转化能力,槲皮素、大豆苷元及淫羊藿素的产率分别为0.776、 1.091和0.714 g/(L·h)。

图5 异槲皮素(a)、大豆苷 (b)及淫羊藿次苷I (c)的酶转化时效曲线
3 结 论
3.1采用包埋交联法固定化重组耐热β-葡萄糖苷酶,通过单因素试验得到最优制备条件为:在pH值6.0,室温条件下,酶活力20 U/mL,海藻酸钠质量分数1.5%,氯化钙质量分数2.5%,戊二醛质量分数1.25%,硬化时间2.5 h,固定化酶颗粒的酶活力为0.64 U/mg,酶固定化率可达62.5%。
3.2酶学性质测试结果表明:固定化酶与游离酶的最适反应温度均为95 ℃,固定化酶和游离酶分别在pH值7.0和6.5时具有最高酶反应效率。固定化酶在90 ℃下保温3 h后,仍具有90%左右的残余酶活力,重复使用10次后仍具有75%左右的残余酶活力。
3.3在95 ℃,pH值7.0条件下,添加固定化酶颗粒33 mg,异槲皮素、大豆苷以及淫羊藿次苷I这3种黄酮糖苷分别在100、 80和120 min内能够高效转化,生成活性更强的黄酮苷元槲皮素、大豆苷元和淫羊藿素,其摩尔转化率分别为99.37%、 97.21%和97.93%,其产率分别为0.776、 1.091和0.714 g/(L·h)。
