缺氧对人前列腺癌细胞PC3和LNCaP生物学特性的影响
2021-05-19郭爱鑫杨丽雅周晓光何佳璘郭一鸣王慧萍宋黎明
郭爱鑫,杨丽雅,周晓光,何佳璘,郭一鸣,王慧萍*,宋黎明*
(1.北京协和医学院研究生院,北京 100730;2.国家卫生健康委科学技术研究所,北京 100081;3.首都医科大学附属北京朝阳医院,北京 100020)
前列腺癌(prostate cancer)是男性生殖系统最常见的恶性肿瘤,发病率高居第2位,仅次于肺癌[1-2]。近20年来随着人口老龄化及生活条件的改善,我国前列腺癌发病率也逐年增加[3]。前列腺癌确诊时多为晚期[4],临床应用去势疗法后易产生耐药而转化为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),患者的生存期大大缩短[5]。有证据表明缺氧是许多实体肿瘤微环境改变的主要特征,肿瘤局部缺氧是造成其转移的重要因素之一[6-9]。因此,本研究通过检测缺氧微环境对人源雄激素非依赖性前列腺癌细胞系PC3和人源雄激素依赖性前列腺癌细胞系LNCaP增殖、转移、侵袭变化的影响,以期深入了解缺氧微环境对前列腺癌恶性生长作用的相关机制,为临床诊疗及相关研究提供思路。
材料与方法
一、研究材料
1.实验细胞来源:人源雄激素非依赖性前列腺癌细胞系PC3(编号:3111C0001CCC000115)和人源雄激素依赖性前列腺癌细胞系LNCaP(编号:3111C0001CCC000040)均购自中国医学科学院基础医学研究所细胞资源中心,本实验室常规传代培养、冻存。
2.主要试剂:兔抗人E钙粘蛋白(E-cadherin)单克隆抗体(3195T)、兔抗人波形蛋白(Vimentin)单克隆抗体(5741T)购自美国CST公司,E-cadherin、Vimentin正反引物购自华大基因,BCA蛋白浓度试剂盒、凝胶试剂盒及结晶紫染色液购自北京索莱宝公司,cDNA第一链合成试剂盒和SuperReal 荧光定量预混试剂购自天根公司,Transwell小室和Matrigal基质胶购自美国康宁公司,Trizol裂解液购自美国Invitrogen公司。
二、研究方法
1.实验分组:两种前列腺癌细胞分别进行常氧和缺氧培养,常氧组放置于普通培养箱,培养条件为21%O2、5%CO2和74%N2。缺氧组细胞放置于缺氧培养箱,培养条件为1%O2、5%CO2和94%N2。常氧组和缺氧组细胞按照实验需要选择不同时间培养后行后续实验检测。
2.细胞增殖检测试剂盒(CCK-8)检测细胞增殖情况:选择对数生长期细胞,制备细胞悬液(6~8×103个/100 μl)均匀接种入96孔板中。将常氧组和缺氧组细胞放于不同培养箱分别孵育不同时间(0、4、8、12、16、20、24、48、72 h),每组设置3个复孔。孵育不同时间后每孔加入10 μl CCK-8溶液,继续分别在常、缺氧培养箱内孵育(PC3细胞继续孵育4 h,LNCaP细胞继续孵育1 h)。酶标仪测定450 nm处的吸光度(A值),计算各个时间点的相对增殖情况。相对细胞增殖率=[(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100%。实验重复3次。
3.实时荧光定量PCR(qRT-PCR)实验:培养细胞加入0.25%胰酶消化后,2 000g离心得细胞沉淀(1.5×106个),加入1 ml Trizol提取总RNA,使用FastQuant cDNA第一链合成试剂盒进行反转录,获取cDNA。E-cadherin 引物(5′-ATTCTGATTCTGCTGCTCTTG-3′,5′-AGTCCTGGTCCTCTTCTCC-3′)、Vimentin引物(5′-AATGACCGCTTCGCCAAC-3′,5′-CCGCATCTCCTCCTCGTAG-3′)和内参蛋白β-actin引物(5′-TGTGATGGTGGGAATGGGTCA-3′,5′-TTTGATGTCACGCACGATTTCC-3′)。使用SuperReal荧光定量预混试剂(SYBR Green)进行Real-Time PCR反应,按照说明书配置20 μl体系,上机设备ABI 7500,40个循环后采用2-△△Ct法计算结果。
4.蛋白印迹(Western blotting)实验:同方法3中获得细胞沉淀,利用100 μl含磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液提取细胞总蛋白,BCA法蛋白定量后分装、-70℃保存。取上述提取液(含蛋白约30 μg)进行10% SDS-PAGE电泳(电泳条件为70 V 20 min,110 V 1 h)。将电泳分离后的蛋白质转移至硝酸纤维素膜上,5%的脱脂奶粉封闭30 min、TBST洗脱后分别加入封闭液稀释的E-cadherin兔抗人抗体(1∶1 000稀释)、Vimentin兔抗人抗体(1∶1 000)及β-actin单克隆抗体(1∶1 000),4℃孵育过夜。洗膜后加入相应的HRP标记山羊抗小鼠IgG或HRP标记山羊抗兔IgG,室温孵育1 h后洗膜。膜抗原-抗体复合物用ECL法染色显示,GE Healthcare凝胶成像系统进行检测分析。
5.细胞划痕实验:根据前面的细胞增殖实验情况,PC3细胞分别缺氧培养0、8和24 h,LNCaP细胞分别缺氧培养0、24和48 h观察肿瘤细胞的迁移能力变化。收集各组细胞以3×105/孔接种至6孔板。细胞汇合度接近100%时,用200 μl枪头在6孔板内画横竖两条直线,宽度保持一致,PBS洗3次,清除漂浮细胞,加入无血清或含5%血清的培养基,放入缺氧培养箱中培养,于40倍倒置显微镜下观察,并分别于一定时间后在同一部位拍照。计算划痕愈合率即迁移率,划痕愈合率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%,实验重复3次。
6.Transwell实验:预先用无血清RMPI-1640培养基将50 mg/L的人工基底膜(Matrigel)1∶10稀释后,包被Transwell小室底部膜,37℃风干过夜,水化基底膜,于37℃放置2 h后置于24孔板中。将各组细胞消化制成细胞悬液,将含1×105细胞的200 μl悬液加入上室,下室加入750 μl含10% FBS的RMPI-1640培养基,每组设3个复孔,放入37℃、5%CO2、1%O2、94%N2饱和湿度环境的温育箱中培养,分别在24和48 h后取出小室,吸弃上室培养基,用棉签轻拭去上室细胞,4%多聚甲醛固定15 min,结晶紫染色10 min,PBS洗涤3次,于100倍倒置显微镜下随机选取5个视野拍照计数。培养24和48 h后计数下室和上室细胞数,计算侵袭率[下室细胞数/(上室细胞数+下室细胞数)×100%]。
三、统计学方法

结 果
一、不同缺氧时间培养后PC3和LNCaP细胞的增殖情况
采用CCK-8法检测细胞的增殖能力,本实验用同一时间点缺氧与常氧的相对增殖率与0 h时两组的相对增殖率比较来表示每一时间点的细胞增殖活性。实验结果显示,与其他时间点比较,PC3细胞在缺氧4 h时增殖活性最高(P<0.05),为0 h时的2.95倍;4 h后增殖活性开始下降,20 h降至最低,为0 h组的0.96倍(P<0.05);20 h后增殖活性又开始上升,48 h细胞增殖活性是0 h的1.95倍(图1A)。
LNCaP细胞在缺氧培养0~16 h时间段增殖活性逐渐升高,16 h时达最高,为0 h时的4.76倍(P<0.05);16 h后增殖活性降低,48 h和72 h分别为0 h时的0.97和0.84倍,差异均有统计学意义(P<0.05)(图1B)。

注:与其他组比较,*P<0.05图1 PC3与LNCaP细胞在缺氧不同时间点的增殖活性变化
二、不同缺氧时间培养后PC3和LNCaP细胞中E-cadherin和Vimentin的mRNA表达变化
采用RQ表示mRNA 相对表达量(RQ=2-△△Ct)。PCR结果显示,在PC3细胞中,缺氧8 h时E-cadherin的mRNA表达水平显著高于0 h时的表达水平(RQ=1.38,P<0.05),然后表达呈降低趋势,在48 h时表达最低(RQ=0.21,P<0.05)(图2A)。对LNCaP细胞而言,不同时间的缺氧培养E-cadherin的mRNA表达水平均显著下降(P<0.01),在72 h时E-cadherin的mRNA相对表达量最低(RQ=0.31,P<0.05)(图2B)。
Vimentin的mRNA表达情况与E-cadherin不同。PC3细胞中,Vimentin的mRNA表达随缺氧时间延长而增强(P<0.05),并在72 h时达到最高(RQ=2.31,P<0.05)(图3A)。LNCaP细胞中,Vimentin的mRNA表达同样随缺氧时间延长而增强(P<0.01),在48 h时达到最高(RQ=58,P<0.01),72 h时表达量则出现了下降(RQ=42,P<0.05)(图3B)。
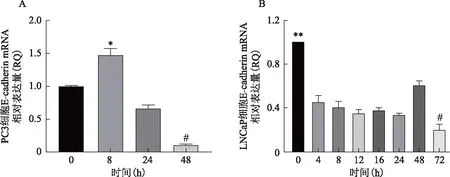
注:与0 h组比较,*P<0.05;与其他组比较,**P<0.01,#P<0.05;RQ=2-△△Ct图2 PC3与LNCaP细胞在缺氧不同时间点E-cadherin的mRNA表达水平变化
三、不同缺氧时间培养后前列腺癌PC3和LNCaP细胞中E-cadherin和Vimentin蛋白水平表达变化
由于PC3细胞E-cadherin的mRNA水平在48 h内变化差异较大(图2A),因此检测其蛋白水平时根据预实验增加4 h、12 h、16 h时间点以便更清晰观察。采用目标蛋白与内参归一化后的相对值RW来表示蛋白相对表达量,结果发现,两种细胞系在缺氧不同时间点E-cadherin蛋白表达水平均显著低于0 h时的蛋白水平(P<0.01)。其中PC3细胞在48 h时蛋白表达最低(RW=0.43,P<0.05)(图4A);而LNCaP细胞在72 h时表达最低(RW=0.37,P<0.05)(图4B)。
检测Vimentin的蛋白表达水平显示,PC3细胞的各缺氧时间点(4 h除外)及LNCaP细胞的各缺氧时间点的蛋白表达水平均显著高于0 h组(P<0.01),PC3细胞在48 h时表达最高(RW=2.64,P<0.05)(图5A),LNCaP细胞在72 h时表达最高(RW=5.63,P<0.05)(图5B)。

注:与其他组比较,**P<0.01,*P<0.05;RW是目标分子与内参归一化后的相对值图5 PC3与LNCaP细胞在缺氧不同时间点Vimentin的蛋白表达情况
四、前列腺癌细胞PC3和LNCaP不同缺氧时间培养后的细胞迁移率变化
细胞划痕实验结果显示,PC3细胞缺氧8 h时,其划痕面积显著小于常氧组,迁移率显著上升[(30.14±1.26)% vs.(18.26±0.84)%](P<0.01);缺氧24 h时,划痕面积进一步缩小,且同样小于常氧组,迁移率显著上升[(47.65±1.56)% vs.(32.49±2.46)%](P<0.01)(图6)。
LNCaP细胞缺氧24 h时,其划痕面积也显著小于常氧组,迁移率显著上升[(32.92±1.94)% vs.(19.18±0.55)%](P<0.01);缺氧48 h时,划痕面积同样进一步缩小,且小于常氧组,迁移率显著上升[(56.14±0.72)% vs.(45.12±2.01)%](P<0.01);因LNCaP细胞缺氧培养8 h组迁移率与对照组无显著差别,因此延长了观察时间即增加48 h时间点检测(图7)。

注:与同时间点的常氧组比较,**P<0.01图6 前列腺癌PC3细胞不同缺氧时间点的细胞迁移情况

注:与同时间点的常氧组比较,**P<0.0图7 前列腺癌LNCaP细胞不同缺氧时间点的细胞迁移情况
五、前列腺癌细胞PC3和LNCaP不同缺氧时间培养后的细胞侵袭情况
根据穿过基底膜的细胞数作图统计,结果显示,PC3细胞缺氧8 h时[(14 835.25±271.84)vs.(10 868.18±344.31)个]和24 h时[(23 848.06±664.43)vs.(19 091.34±521.32)个]穿过基底膜细胞数量均显著多于常氧组,侵袭能力显著增强(P<0.01)(图8)。

A:细胞结晶紫染色,×200;B:细胞计数统计图:与同时间点的常氧组比较,**P<0.01图8 前列腺癌PC3细胞的Transwell实验结果
LNCaP细胞缺氧24 h时[(11 852.19±453.71)vs.(7 697.48±158.32)]和48 h时[(24 187.26±529.84)vs.(18 432.37±234.46)]穿过基底膜细胞数量也均显著多于常氧组(P<0.01),侵袭能力显著增强;与划痕实验相同,LNCaP细胞延长观察时间,增加48 h时间点检测(图9)。

A:细胞结晶紫染色,×200;B:细胞计数统计图:与同时间点的常氧组比较,**P<0.01,***P<0.001图9 前列腺癌LNCaP细胞的Transwell实验结果
讨 论
据统计2018年全球有近130万前列腺癌新发病例和35.9万死亡病例,占男性恶性肿瘤发病率的13.5%;占男性恶性肿瘤死亡率的6.7%,高居第5位。目前临床常用的去势疗法总有效率为70%~80%,但治疗18~24个月后易复发转化为CRPC,CRPC患者的中位生存期只有1~2年。
前列腺癌的发生发展是一个多阶段、涉及多基因改变的复杂过程,即由正常上皮转化为上皮过度增生,增生发生变异并演进至癌及侵润与转移[10]。有研究表明,前列腺癌的生物学行为如增殖分裂、侵袭及转移等,除了与遗传易感性相关外,还依赖于特定的细胞因子及其相关的微环境,其中缺氧微环境引起了更多关注[6-7]。在肿瘤组织中,因为细胞快速且无限制的增殖分裂,会出现局部组织缺氧,适应缺氧并存活下来的细胞进而继续增殖、迁移侵袭和浸润到其他细胞,最终导致癌症的发生发展。迄今为止,缺氧对晚期前列腺癌恶性生长的影响机理尚未明确,但缺氧诱导因子1α(hypoxia inducible factor 1,HIF-1α)在其中扮演着重要的角色[6-7]。本课题组前期研究结果发现常氧状态下晚期前列腺癌的恶性生长依赖于新生血管生成和PI3K/AKT信号通路[11-12],而上述效应和通路与HIF-1α密切相关,因此我们推测缺氧可能促进晚期前列腺癌的恶性增殖与迁移。本实验主要观察体外前列腺癌细胞在不同缺氧时间导致的低氧微环境下所发生的动态变化,为进一步阐明低氧与晚期肿瘤细胞的侵袭转移提供新的思路。
去势治疗对早期雄激素依赖性的前列腺癌细胞起到了良好效果,但转化成CRPC后,肿瘤细胞在缺乏雄激素的状态下依旧能很好地生长[13-14]。因此,本文选用雄激素依赖性前列腺癌细胞系LNCaP和雄激素非依赖性前列腺癌细胞系PC3来观察其恶性生长的特性。
从细胞增殖实验可以看出两种前列腺癌细胞增殖活性随着缺氧时间的增加不断反复变化。在缺氧0~20 h时肿瘤细胞增殖活性显著升高(P<0.05),但期间也有升高和降低的波动,提示缺氧时前列腺癌细胞的增殖是一个动态变化的过程。推测缺氧初期,细胞密度急剧上升发生接触抑制,细胞的增殖速率有所下降,相关基因级联调控使前列腺癌细胞对缺氧做出应激反应,癌细胞增殖能力、侵袭转移能力增强,癌细胞发生转移,细胞密度下降。细胞增殖曲线同样提示一定程度的缺氧可代偿性增强细胞的增殖能力,但随缺氧时间的延长反而起到抑制的作用(LNCaP细胞在缺氧48和72 h时存活率显著低于常氧组),确切机理尚需要进一步实验研究。
缺氧微环境会促进肿瘤细胞的迁移和侵袭。本研究通过细胞划痕和Transwell实验也发现在不同缺氧时间下两种前列腺癌细胞的迁移速率加快、穿透基底膜数量增加,证实缺氧促进了肿瘤细胞的迁移和侵袭能力。但同等条件(起始细胞量相同和缺氧时间24 h时)下PC3细胞迁移侵袭速率大于LNCaP细胞,表明PC3细胞恶性程度要高于LNCaP细胞。本研究同时发现LNCaP细胞之间更具有粘附性,常多个细胞粘连成团导致细胞不易移动,转移和侵袭能力较弱。而雄激素非依赖性前列腺癌PC3细胞生长形态为典型的长梭形,细胞独立生长不发生粘连,这种形态学特点使其更具侵袭性。从细胞划痕和侵袭实验也可以看出LNCaP细胞迁移速度缓慢,贴壁不牢固,侵袭能力较弱,因此适当延长时间到48 h作为观察点。PC3细胞在同等条件下迁移速率快,侵袭能力强而对人体更具有威胁性,也提示CRPC是临床上治疗的难点和研究重点。
很多研究发现肿瘤细胞包括前列腺癌细胞的转移总是伴随上皮间充质转化(epithelial-mesenchyme transformation,EMT)的转变[15-16],其主要的特征有细胞黏附分子(如E-cadherin)表达的减少、角蛋白细胞骨架转化为以Vimentin为主的细胞骨架,从而获得间充质细胞特性。E-cadherin是典型的上皮细胞特异性标志物,可介导细胞之间互相粘附,调节正常细胞间连结的形成和维护[17-18]。Vimentin对于维持正常细胞的结构完整性和上皮到间质过渡非常重要,有助于转移性癌细胞的侵入性表型转化[19-20]。在EMT过程中,癌细胞脱去上皮细胞的某些特性,如细胞间的黏附性、细胞极性,发生细胞骨架改变,向间充质表型转变并获得高度的运动性和侵袭性。由于CCK-8实验发现缺氧对细胞的增殖是一个随时间变化的动态过程,因此,我们观察了不同缺氧时间处理下前列腺癌细胞这两个重要分子的mRNA和蛋白表达水平以判断是否发生EMT以及EMT过程是否也随缺氧时间变化。实验发现无论在mRNA水平还是蛋白水平随着缺氧时间的增加两种前列腺癌细胞E-cadherin的表达量均逐渐减少(P<0.05),而Vimentin表达量逐渐增多(P<0.05),表明缺氧状态下前列腺癌细胞发生典型的EMT。但这种转化是实时动态变化的,提示缺氧下的EMT转化可能是一个可逆的动态变化的过程,具体机理需进一步实验研究。
综上所述,本文通过模拟体内缺氧微环境观察缺氧对前列腺癌两种细胞系恶性生长的影响,表明一定程度的缺氧不仅能够增强前列腺癌细胞的增殖、迁移和侵袭,并且能够诱导EMT发生;同时发现缺氧促进癌细胞恶性生长是一个动态变化的过程。缺氧总体上有促进前列腺癌恶性生长的趋势,但在个别时间点也会出现抑制的情况,说明即使E-cadherin等分子在晚期肿瘤恶性生长中起到关键作用但仍不能作为治疗和观察预后的单一靶标,这为研究针对缺氧动态变化的抗晚期前列腺癌研究提供了实验基础。
