不同内膜准备方案对卵巢储备功能低下患者冻胚移植妊娠结局的影响
2021-05-19李赛姣尚叶王笑臣尹太郎杨菁
李赛姣,尚叶,王笑臣,尹太郎,杨菁*
(1.武汉大学人民医院生殖医学中心,武汉 430060,2.湖北省辅助生育与胚胎发育医学临床研究中心,武汉 430060)
卵巢储备功能低下(DOR)指卵巢内存留的可募集卵泡数量及质量均下降,临床表现为排卵障碍、生殖内分泌紊乱及控制性超促排卵(COH)过程中对促性腺激素(Gn)反应差、获卵少、优质胚胎少以及周期取消率高等,导致患者妊娠结局较差。DOR的发病率约占不孕症的10%,且发病率及占比仍在不断升高[1-2]。冻融胚胎移植(FET)是辅助生殖技术的一个重要组成部分,目前已在DOR患者中得到广泛运用,并被多项随机对照试验(RCT)研究证实其临床妊娠率和活产率可达到甚至高于新鲜周期胚胎移植,同时低体重儿及早产儿的出生比率低于新鲜周期胚胎移植[3-6]。目前对于DOR患者IVF促排卵方案选择的研究较多,但对于DOR患者选用何种FET内膜准备方案的研究较少[7-8]。FET周期常规的内膜准备方案包括自然周期(NC)、促排卵周期、人工周期即激素替代周期(HRT)及促性腺激素释放激素激动剂降调节后激素替代周期(GnRH-a+HRT)等。本研究旨在通过比较NC、HRT以及GnRH-a+HRT三种子宫内膜准备方案对DOR患者FET临床妊娠结局的影响,探讨适合DOR患者的FET子宫内膜准备方案。
资料与方法
一、研究对象
回顾性分析2016年1月至2019年2月于武汉大学人民医院生殖中心行FET的DOR患者的临床资料。纳入标准:(1)符合DOR的诊断标准,即符合以下任意2项即可诊断:年龄≥40岁、基础窦卵泡计数(AFC)≤7、抗苗勒管激素(AMH)≤1.1 ng/ml、基础卵泡刺激素(bFSH)≥10 U/L[9-11];(2)患者移植1~2枚卵裂期胚胎或囊胚,包括至少1枚优质胚胎。排除标准:(1)移植日内膜厚度≤7 mm;(2)夫妻任一方染色体异常者;(3)反复着床失败或复发性流产病史者;(4)合并子宫内膜异位症、子宫腺肌症;(5)合并子宫畸形者(单角子宫、双子宫、残角子宫、子宫纵隔、双角子宫);(6)存在未治疗的子宫内膜病变如宫腔粘连、子宫内膜息肉及黏膜下肌瘤等。
本研究共纳入582个周期,根据子宫内膜准备方式分为3组:GnRH-a+HRT组(n=153)、HRT组(n=314)和NC组(n=115)。再以女方年龄40岁为界,分为≥40岁及<40岁,分别进行不同内膜方案妊娠结局的统计。
二、研究方法
1.NC方案:于月经周期第10~12天开始B超监测子宫内膜及卵泡情况,结合血或尿LH值确定排卵日,当主导卵泡直径>15 mm时测定血清E2、LH、P水平,当内膜厚度达到8 mm及以上且卵泡直径达到18 mm、P<0.32 pmol/L、LH<20 U/L且雌激素没有下降,则当天肌肉注射HCG(珠海丽珠)10 000 U,隔日肌肉注射黄体酮(浙江仙琚)20 mg;若LH≥20 U/L或P>0.32 pmol/L或雌激素下降,则当日注射HCG 5 000~10 000 U,次日肌肉注射黄体酮20 mg/d,第3天或5天后移植卵裂期或囊胚期胚胎。移植后肌肉注射黄体酮20 mg/d,口服地屈孕酮片(达芙通,雅培,荷兰)10 mg/次,每日两次,HCG 2 000 U肌肉注射,每3日1次,连续3次,继续黄体支持至11周左右。
2.HRT方案:于月经第3天开始服用戊酸雌二醇(补佳乐,拜耳医药,法国)3~6 mg/d,月经第10~12天开始行B超及血清E2、LH、P水平检查,根据结果调整戊酸雌二醇的剂量,雌激素给药时间至少维持10天,当内膜厚度≥8 mm且呈A或B型,同时双侧卵巢无成熟卵泡时,给予黄体酮40 mg/d肌肉注射,第3天或第5天后移植卵裂期或囊胚期胚胎,移植后黄体酮肌肉注射40 mg/d,地屈孕酮片10 mg/次,每日两次,戊酸雌二醇维持原剂量,并继续黄体支持至11周左右。
3.GnRH-a+HRT方案:月经第1~5天B超检查后,肌肉注射注射用醋酸亮丙瑞林微球(贝依,上海丽珠)3.75 mg或醋酸曲普瑞林(达菲林,益普生,法国)3.75 mg,通常于给药28~30 d后复查性激素及B超检查,如达到垂体降调节标准(E2<183.5 pmol/L、LH<5 U/L、FSH<5 U/L、子宫内膜厚度<5 mm),采用HRT方案(方法同HRT组)准备内膜,移植后黄体支持同HRT组。
4.FET及黄体支持:IVF、胚胎冷冻和复苏均按本中心常规进行。若移植当天子宫内膜厚度≥8 mm且患者一般情况良好,选择1~3枚复苏后的卵裂期或囊胚期胚胎,在腹部B超引导下进行胚胎移植,其中至少包含1枚优质胚胎(优质卵裂期胚胎:受精第3天卵裂球数目>6细胞,双原核受精,碎片指数<20%;优质囊胚指按Gardner评分标准复苏后评分≥3 BB的囊胚)。胚胎移植后继续服用地屈孕酮片,肌肉注射黄体酮至移植后10~12 d,查血HCG升高者继续用药18 d至移植后28~30 d行阴道B超检查。
5.临床结局判断标准:移植后12 d检测血清HCG,HCG>10 U/L为阳性,移植后28~30 d阴道B超示宫内或宫外可见孕囊和原始心管搏动者为临床妊娠;HCG值下降且移植后28~30 d阴道超声未见孕囊则提示生化妊娠;大于等于12周妊娠丢失为早期流产;有胎儿活产(包括早产)为活产。
6.观察分析指标:分析比较3组DOR患者的一般资料、实验室指标及妊娠结局。妊娠结局包括临床妊娠率、生化妊娠率、种植率、早期流产率、异位妊娠率以及多胎妊娠率。其中临床妊娠率=妊娠周期数/移植周期数×100%;种植率=B超观察到的妊娠囊数/移植胚胎数×100%;异位妊娠率=异位妊娠周期数/临床妊娠周期数×100%。
三、统计学分析

结 果
一、各组患者的一般情况
GnRH-a+HRT组、HRT组及NC组DOR患者的年龄、不孕年限、AMH、bFSH及BMI比较均无显著性差异(P>0.05);3组间移植优胚数、移植胚胎数以及移植卵裂期及囊胚期胚胎比例均无显著性差异(P>0.05);GnRH-a+HRT组及NC组移植日子宫内膜厚度显著厚于HRT组(P<0.05)(表1)。
二、各组患者妊娠结局指标比较
统计结果显示,与NC组相比,GnRH-a+HRT组及HRT组的多胎妊娠率及种植率均显著升高(P<0.05),而临床妊娠率、生化妊娠率、早期流产率、异位妊娠率及活产率各组间比较均无显著性差异(P>0.05)(表2)。
将3组患者以女方年龄40岁为界,分为≥40岁及<40岁,分别进行妊娠结局的统计。女方年龄<40岁的患者中,与NC组相比,GnRH-a+HRT组的临床妊娠率、多胎妊娠率、种植率及异位妊娠率均显著增高(P<0.05);HRT组仅种植率显著升高(P<0.05),临床妊娠率、多胎妊娠率及活产率虽有增高的趋势,但是差异无统计学意义(P>0.05);GnRH-a+HRT组与HRT组比较各项指标均无显著性差异(P>0.05)(表3)。

表1 三组患者一般情况比较[(-±s),%]

表2 三组患者妊娠结局比较(%)

表3 女方年龄<40岁患者的妊娠结局比较(%)
女方年龄≥40岁的患者中,HRT组与NC组相比种植率、临床妊娠率、多胎妊娠率及活产率有增高的趋势,GnRH-a+HRT组与NC组相比多胎妊娠率及活产率有增高的趋势,但是差异均没有统计学意义(P>0.05),GnRH-a-+HRT组与HRT组比较各项指标均无显著性差异(P>0.05)(表4)。
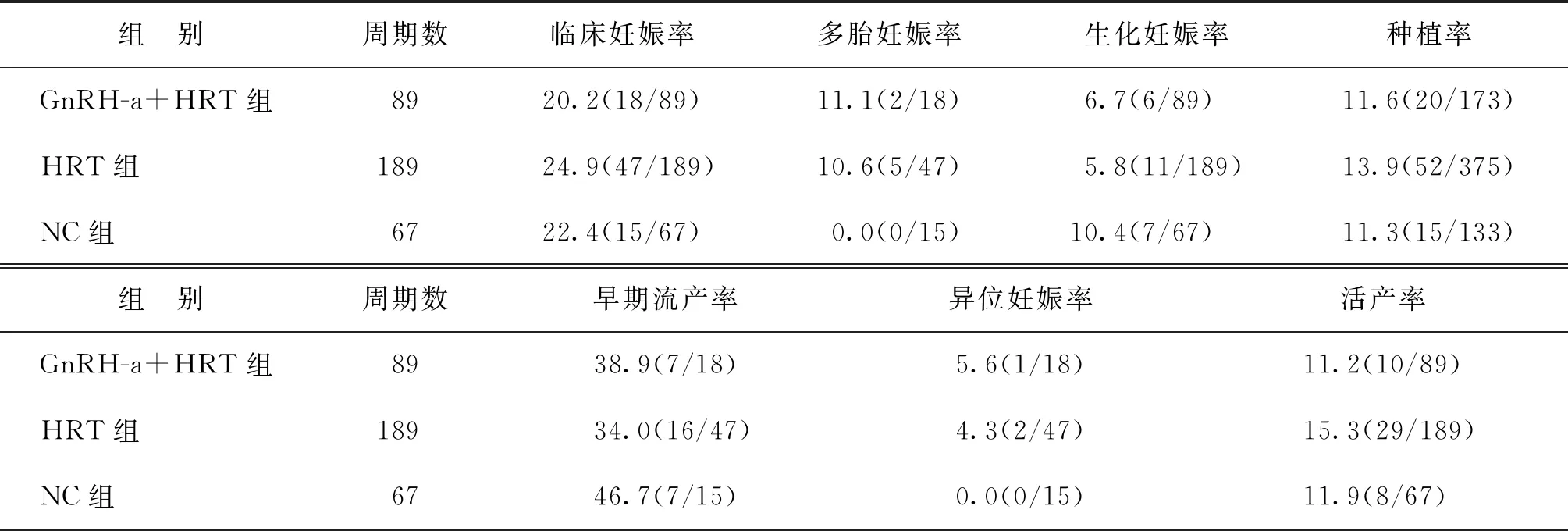
表4 女方年龄≥40岁患者妊娠结局比较(%)
讨 论
随着当前女性生育年龄的推后以及社会生活环境因素的影响,DOR患者占不孕人群的比例逐年增加,而接受FET治疗的DOR患者也在增加,如何选择适宜DOR患者的FET内膜准备方案也是我们需要关注的重点。
目前临床上主要根据患者特点选择FET合适的内膜准备方案[10]。各种方案特点及优势不同,对于月经周期规律的患者通常首选NC方案,因其避免了外源性激素的运用,对内膜容受性的影响最小,子宫内膜的变化也最符合生理状态[11],同时NC方案花费少且后期黄体支持简单,更易为患者接受,但缺点在于需多次来院行激素和超声检查,且存在卵泡不发育取消周期的风险。对于既往月经不规律、监测卵泡有困难或有排卵障碍的患者,通常可采用HRT周期,HRT周期可通过给予不同剂量的外源性雌激素来有效控制子宫内膜的发育速度,用药灵活方便且周期取消率低,但HRT周期增加了患者雌孕激素药物的使用,且存在雌激素未能完全抑制卵泡发育,导致内源性和外源性甾体激素共同作用使种植窗的雌孕激素比例失衡,子宫内膜容受性降低的问题[10]。对于合并子宫内膜异位症或子宫腺肌症的患者来说,GnRH-a+HRT方案是较为有效的选择方案,GnRH-a能有效阻止内源性LH峰出现,改善内膜容受性;同时有研究显示其能降低盆腔微环境炎性因子水平,有助于获得更高的临床妊娠率和活产率[12]。但相对费用多且耗时长,同时有研究认为给予GnRH-a预处理并不能改善卵巢功能正常、月经规律患者 FET周期的临床妊娠率及活产率[13]。
本研究回顾性分析了我中心DOR患者FET内膜准备方案对妊娠结局的影响,结果显示GnRH-a+HRT组及HRT组多胎妊娠率及种植率均显著高于NC组。考虑可能与DOR患者使用NC方案容易出现早发LH峰,导致种植窗雌孕激素比例失衡、子宫内膜容受性降低有关。Ren等[14]的研究显示GnRH-a能与子宫内膜存在的GnRH受体结合,抑制胚胎毒性自身抗体的产生,增加子宫内膜细胞黏附分子的表达,提高子宫内膜容受性,从而提高IVF治疗中的活产率。GnRH-a还能通过降调节降低体内雌激素水平,减少雌激素对子宫内膜受体影响。另有研究认为,GnRH-a能够增加子宫内膜容受性标记物,比如增加内膜中整合素、胞饮突数量以改善子宫内膜容受性,增加胚胎着床的几率[15]。张群芳等[16]的研究认为DOR患者可能存在炎性因素,采用GnRH-a的内膜准备方案可抑制盆腔炎症环境,更有利于胚胎着床和发育。因此对于卵巢储备较差、窦卵泡偏少、可能自发排卵的DOR患者GnRH-a+HRT可能为更合适的方案。
年龄是影响女性生育力的重要独立因素[17-18],随着年龄的增长,卵巢中原始卵泡数目逐渐减少,卵母细胞染色体异常和细胞质功能障碍发生率增加,导致生育力逐渐下降[19]。同时随着年龄的增加,胚胎的非整倍体率、流产率及胎儿异常发生率也显著增加[20]。我们的研究也显示,无论何种内膜准备方案(GnRH-a+HRT、HRT、NC),女方年龄≥40岁的临床妊娠率(分别为20.2%、24.9%、22.4%)、种植率(分别为11.6%、13.9%、11.3%)及活产率(分别为11.2%、15.3%、11.9%)均较低,而早期流产率均较高,NC组甚至高达46.7%,进一步提示了高龄对妊娠结局的负面影响。目前FET在高龄患者中的作用已得到了证实,有研究显示,与新鲜胚胎移植相比,高龄患者行FET助孕的妊娠率、活产率无显著性差异,但妊娠期并发症发生率显著降低[21]。考虑到年龄对IVF妊娠结局的重要影响,本研究以女方年龄40岁为界限分为≥40岁及<40岁分别进行妊娠结局的统计。结果显示女方年龄<40岁的患者中,GnRH-a+HRT组的临床妊娠率、多胎妊娠率、种植率及异位妊娠率均显著高于NC组;HRT组的种植率显著高于NC组;GnRH-a+HRT组与HRT组各指标比较无显著性差异。而女方年龄≥40岁的患者中临床妊娠结局的各项指标比较均无统计学差异。提示GnRH-a+HRT内膜准备案可提高DOR患者FET周期的种植率和多胎妊娠率,尤其适用于年龄<40岁的DOR患者。可能的解释为,DOR患者可能存在潜在的炎性因素,且DOR出现早发LH峰及自发排卵的可能性更高[15],使用GnRH-a能降低盆腔微环境炎性因子水平,有效阻止内源性LH峰出现,改善内膜容受性,减少对卵子和胚胎的不良影响,继而有效改善妊娠结局。同时,本研究结果提示GnRH-a+HRT方案能显著增加多胎妊娠率,由此可能导致妊娠期多种并发症(如早产、妊娠高血压疾病等)的风险增加,尤其值得临床医生注意。因此,对于使用此方案准备内膜的患者,临床工作中可考虑选择性单囊胚移植或者减少胚胎移植数目,以减少多胎妊娠的风险。
本研究中GnRH-a+HRT组与NC组的移植日子宫内膜厚度均显著高于HRT组,但3组患者移植日子宫内膜厚度均在8 mm以上,均为适宜妊娠的内膜厚度,因此可排除内膜厚度因素对不同组间妊娠结局的影响。
综上所述,对于行FET的DOR患者来说,GnRH-a+HRT内膜准备方案可提高DOR患者FET周期的种植率和多胎妊娠率,尤其适用于年龄<40岁的DOR患者,可作为DOR患者有效的FET内膜准备方案。同时临床工作中也需注意对采用GnRH-a+HRT内膜准备方案的患者应采取措施降低多胎妊娠的风险。对于女方年龄≥40岁的患者,HRT及GnRH-a+HRT组中多项临床妊娠指标与NC组相比均有增高的趋势,但是差异无统计学意义。同时本研究为回顾性研究,在样本数据统计中存在偏倚因素的影响,因此未来尚需大样本、前瞻性多中心随机对照研究对我们的结果进行进一步的研究及证实。
