IL-32α 通过调控miR-216b-5p/AKR1B10 轴抑制食管癌KYSE450 细胞的增殖、迁移和侵袭
2021-05-19吴光锋范瑞
吴光锋,范瑞
(南阳市第一人民医院,河南 南阳 473000)
食管癌是消化系统常见的恶性肿瘤,中晚期患者5 年生存率低于10%[1]。依据组织形态学的不同,可将食管癌分为食管腺癌和食管鳞状细胞癌,其中食管鳞状细胞癌约占食管癌的90%[2]。肿瘤周围浸润的免疫细胞和其分泌的大量炎性因子可促进肿瘤的发生和发展,抑制机体对肿瘤细胞的免疫识别[3,4]。研究显示,多种炎症介质参与食管癌的发展进程[5,6]。IL-32 是一种促炎细胞因子,包含IL-32α、IL-32β、IL-32γ 等 6 种亚型, 其中 IL-32α 是最主要的亚型[7]。IL-32 的不同亚型在肿瘤、自身免疫疾病、炎症性肠病等疾病中发挥不同作用,参与细胞增殖、凋亡及炎症反应等过程[8,9]。一定剂量范围的IL-32α 可能通过抑制Jak2/ STAT3 信号通路抑制胰腺癌Panc-1 和AsPC-1 细胞的侵袭和转移[10]。IL-32α 通过促进 TNFR1 的信号传导来抑制结肠癌的发展[11]。但目前,IL-32α 对食管癌细胞生物学行为的影响和机制还未知。
微小 RNA (microRNA,miRNA) 是长度约为18~25 个核苷酸的小分子非编码单链RNA,参与调控细胞生物学行为,在肿瘤的发生和发展中发挥重要作用[12]。研究显示,miR-216b-5p 过表达可抑制胰腺癌细胞增殖,诱导细胞周期阻滞和细胞凋亡,并抑制体内肿瘤发生[13];miR-216b-5p 表达的上调可抑制宫颈癌细胞的增殖,并促进其凋亡[14]。但目前,miR-216b-5p 对食管癌细胞生物学行为的影响还未知。生物信息学软件预测显示,AKR1B10 可能是miR-216b-5p 的靶基因。AKR1B10 是细胞质内烟酰胺腺嘌呤二核苷酸磷酸依赖的可溶性单体氧化还原酶,属醛酮还原酶超家族成员。研究显示,AKR1B10 参与口腔鳞状细胞癌[15]、肺腺癌[16]等肿瘤的发生发展,可作为肿瘤治疗的潜在分子靶点。因此,本研究以食管癌KYSE450 细胞为研究对象,主要探讨了 IL-32α 对 KYSE450 细胞增殖、迁移和侵袭的影响,并以miR-216b-5p/AKR1B10 轴为切入点,探究了 IL-32α 影响 KYSE450 细胞增殖、迁移和侵袭的作用机制。
1 材料与方法
1.1 细胞和试剂 食管癌细胞株KYSE450 细胞,上海吉凯基因化学技术有限公司;胎牛血清,杭州四季青公司;RPMI 1640 培养基,美国Gibco 公司;鼠抗人醛酮还原酶家族1B10(AKR1B10)单克隆抗体,美国 Abcam 公司;鼠抗人 P21、CyclinD1、MMP-2、MMP-9 单克隆抗体,美国 Santa Cruz 公司;LipofectamineTM 2000 试剂盒和 Trizol 试剂,美国Invitrogen 公司; 逆转录试剂盒和PCR 试剂盒,大连宝生物工程公司;miR-216b-5p 模拟物(mimics)及模拟对照序列(miR-NC)、miR-216b-5p 抑制剂(anti-miR-216b-5p)及抑制剂阴性对照序列(antimiR-NC)、AKR1B10 小干扰 RNA(si-AKR1B10)及乱序无意义核苷酸序列(si-NC),上海GenePhama公司;双荧光素酶活性检测试剂盒,北京百奥莱博科技有限公司。
1.2 实验方法
1.2.1 细胞培养和转染 KYSE450 细胞复苏后,培养于含10% FBS 的RPMI 1640 培养基中,置于37℃、5%CO2、97%湿度的培养箱中培养。每 2~3d 更换一次新鲜的培养基。待细胞融合至80%时,0.25%胰蛋白酶消化,按照1:3 的比例传代培养。将对数生长期的KYSE450 细胞以每孔1×105个接种于6 孔板中,待细胞融合至60 %时,更换不含FBS的 RPMI 1640 培养基。参照 LipofectamineTM2000试剂盒说明书,分别将miR-216b-5p mimics、miRNC、si -AKR1B10、si -NC、anti -miR -216b -5p 和anti-miR-NC 转染至 KYSE450 细胞。转染 6h 后,更换含10% FBS 的RPMI 1640 培养基。继续培养24h 后,收集细胞用于后续实验。
1.2.2 细胞分组处理 未转染的KYSE450 细胞分为对照组和IL-32α 组。对照组细胞正常培养24h,不做任何处理;IL-32α 组: 分别含 IL-32α 终浓度为 10μg/ml、25μg/ml、50μg/ml[10]的培养基培养 24h。转染 miR-216b-5p mimics、miR-NC、si-AKR1B10、si-NC 的细胞正常培养24h, 并分别记为miR-216b-5p 组、miR-NC 组、si-AKR1B10 组和 si-NC组。转染 anti-miR-216b-5p、anti-miR-NC 的细胞用 IL-32α 终浓度为 50μg/ml 的培养基培养 24h,分别记为 IL-32α+anti-miR-216b-5p 组和 IL-32α+anti-miR-NC 组。
1.2.3 MTT 检测细胞增殖[17]未转染的KYSE450细胞和转染后的细胞均以每孔0.5×104个细胞接种于96 孔板中。按照1.2.2 分组处理,每组设置3个复孔。培养结束后,每孔加入20μl 浓度为5mg/ml 的 MTT 溶液,继续孵育 4h 后,吸弃上清液,加入150μl DMSO 溶解结晶紫,充分混匀,于490 nm处在酶联免疫分析仪上测定吸光度值。
1.2.4 Transwell 检测细胞迁移和侵袭[17]未转染的KYSE450 细胞和转染后的细胞均用不含FBS 的RPMI 1640 培养基调整浓度为 2.5×105个/ml 的细胞悬液。迁移实验: 取100μl 细胞悬液加入Transwell 上室,下室加入500μl 含10 %胎牛血清的RPMI 1640 培养基。培养结束后,取出Transwell 小室,吸弃培养基,棉签擦去上层未迁移细胞,生理盐水清洗。经多聚甲醛固定、结晶紫染色后,显微镜观察。随机选取5 个视野对细胞计数。侵袭实验: 将Matrigel 基质胶与RPMI 1640 培养基以1:8比例稀释,铺于Transwell 上室。自然晾干后,加100μl 细胞悬液,剩余操作同迁移实验。
1.2.5 qRT-PCR 检测 miR-216b-5p 和 AKR1B10 mRNA 水平[18]Trizol 试剂提取细胞中总RNA,微量核酸仪检测RNA 纯度和浓度。参照逆转录试剂盒操作说明,将 RNA 逆转录为 cDNA。以 cDNA 为模板,进行 PCR 扩增。引物序列:miR-216b-5p 上游5'-GTCGTATCCAGTGCAGGGTCCGAGG-3',下游5'-GGGGAAATCTCTGCAGGCAA-3';U6 上 游 5'-GTCGTATCCAGTGCAGGG-3',下游 5'-GT GCTCG CTTCGGCAGC-3';AKR1B10 上 游 5'-CCCAAAGATGATAAAGGTAATGCCATCGGT-3',下游 5'-C GATCTGGAAGTGGCTGAAATTGGAGA-3' ;GAPD H 上游 5'-ATGACCCCTTCATTGA CC-3',下游 5'-GAAGATGGTGATGGGATTTC-3'。PCR 扩增条件:95℃预变性 5mins,95℃变性 10s,60℃退火 1min,72℃延伸 30s,共计 35 个循环。miR-216b-5p 以 U6为内参,AKR1B10 以 GAPDH 为内参, 采用 2-△△Ct法计算miR-216b-5p 和AKR1B10 mRNA 的相对表达水平。
1.2.6 Western Blot 法 检 测 AKR1B10、CyclinD1、p21、MMP-2 和 MMP-9 蛋白水平[19]RIPA 试剂提取细胞中总蛋白,BCA 法测定蛋白浓度。分别取30μl 蛋白溶液,沸水中煮沸 5min,行 SDS-PAGE电泳。电泳后,转至PVDF 膜,置于5%脱脂奶粉溶液中孵育 1h。TBST 洗膜 3 次,每次 5 min。加入一抗,4℃孵育过夜。TBST 洗膜 3 次,每次 5 min。加入辣根过氧化酶标记的二抗,室温孵育1 h。TBST 洗膜3 次,每次5 min。然后加入化学发光试剂避光显影,应用Quantity One 软件进行图像分析。
1.2.7 双荧光素酶报告基因实验[12]经TargetScan在线软线预测显示,AKR1B10 的 3’UTR 中含有miR-216b-5p 的结合位点。PCR 扩增含有miR-216b-5p 结合位点的 AKR1B10 的 3’UTR,将扩增后的片段插入PGEM-T easy 载体,构建AKR1B10的3’UTR 野生型质粒。利用基因突变技术将结合位点突变后,插入PGEM-T easy 载体,构建 AKR1 B10 的 3’UTR 突变型质粒。分别将 AKR1B10 的3’UTR 野生型、突变型质粒与miR-216b-5p mimics、miR-NC 共转染至对数生长期的 KYSE450 细胞,转染后6h,更换新鲜培养基,继续培养24h 后,收集细胞。参照双荧光素酶活性检测试剂盒,测定细胞荧光素酶活性。
1.3 统计学分析 利用SPSS.22.0 软件分析实验数据。符合正态分布的计量资料以(±s)表示。两组间比较用独立样本t 检验;多组间比较用单因素方差分析,进一步两组间比较采用LSD-t 分析。P<0.05为差异有统计学意义。
2 结果
2.1 IL-32α 对 KYSE450 细胞增殖、迁移和侵袭的影响 与对照组比较,IL-32α 组 KYSE450 细胞抑制率显著升高(P<0.05),迁移和侵袭细胞数显著降低(P<0.05),CyclinD1、MMP-2 和 MMP-9 蛋白水平显著降低(P<0.05),p21 蛋白水平显著升高(P<0.05),且呈剂量依赖性。见图1、图2 和表1。

图1 IL-32α 对 KYSE450 细胞中 CyclinD1、MMP-2 和 MMP-9 蛋白表达的影响
表1 IL-32α 对KYSE450 细胞增殖、迁移和侵袭及相关蛋白表达的影响(±s,n=9)
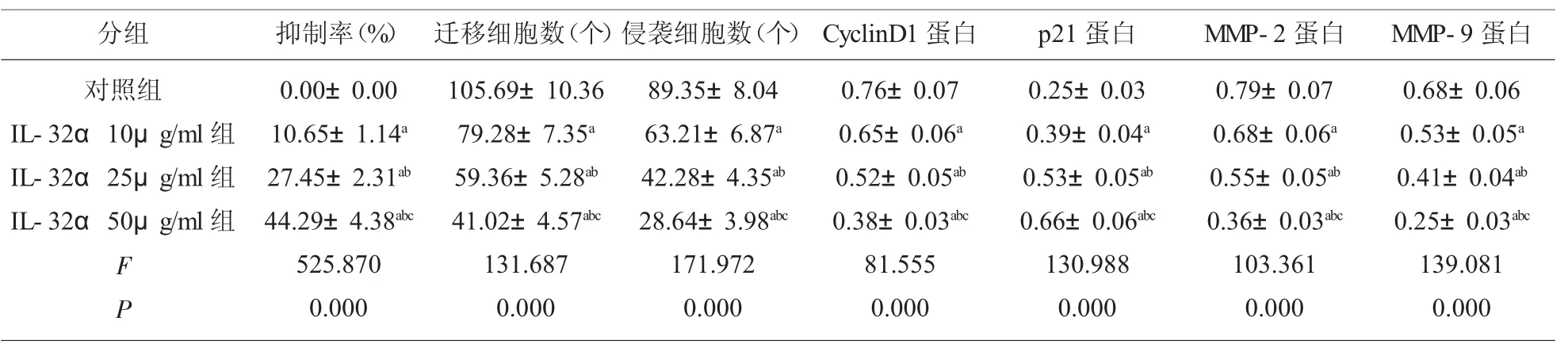
表1 IL-32α 对KYSE450 细胞增殖、迁移和侵袭及相关蛋白表达的影响(±s,n=9)
注:与对照组比较,aP<0.05;与 IL-32α 10μg/ml 组比较,bP<0.05;与依托咪酯 IL-32α 25μg/ml 组比较,cP<0.05
分组对照组IL-32α 10μg/ml 组IL-32α 25μg/ml 组IL-32α 50μg/ml 组F P抑制率(%)0.00±0.00 10.65±1.14a 27.45±2.31ab 44.29±4.38abc 525.870 0.000迁移细胞数(个)侵袭细胞数(个) CyclinD1 蛋白 p21 蛋白 MMP-2 蛋白 MMP-9 蛋白105.69±10.36 79.28±7.35a 59.36±5.28ab 41.02±4.57abc 131.687 0.000 89.35±8.04 63.21±6.87a 42.28±4.35ab 28.64±3.98abc 171.972 0.000 0.76±0.07 0.65±0.06a 0.52±0.05ab 0.38±0.03abc 81.555 0.000 0.25±0.03 0.39±0.04a 0.53±0.05ab 0.66±0.06abc 130.988 0.000 0.79±0.07 0.68±0.06a 0.55±0.05ab 0.36±0.03abc 103.361 0.000 0.68±0.06 0.53±0.05a 0.41±0.04ab 0.25±0.03abc 139.081 0.000
2.2 IL-32α 对 KYSE450 细 胞 miR-216b-5p 和AKR1B10 表达的影响 与对照组比较,IL-32α 组miR-216b-5p 水平显著升高 (P<0.05),AKR1B10 mRNA 和蛋白水平显著降低(P<0.05),且呈剂量依赖性。见图3 和表2。
2.3 miR-216b-5p 靶向调控AKR1B10 的表达 生物信息学软件预测显示,AKR1B10 的3’UTR 中含有与miR-216b-5p 互补的核苷酸序列,见图4A。双荧光素酶报告实验结果显示,miR-216b-5p 组WT-AKR1B10 的荧光素酶活性显著低于miR-NC组 (P<0.05),miR-216b-5p 组 MUT-AKR1B10 的荧光素酶活性与miR-NC 组比差异无统计学意义(P>0.05),见表3。与 miR-NC 组比,miR-216b-5p组 AKR1B10 蛋白水平显著降低(P<0.05);与 antimiR-NC 组比,anti-miR-216b-5p 组 AKR1B10 蛋白水平显著升高(P<0.05),见图4B 和表4。
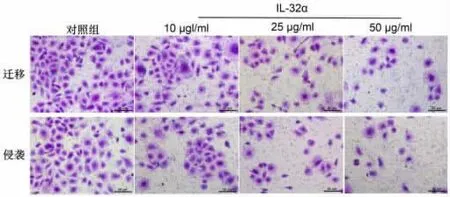
图2 IL-32α 对KYSE450 细胞迁移和侵袭的影响
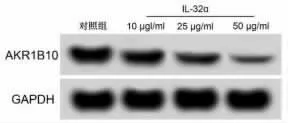
图3 IL-32α 对KYSE450 细胞中AKR1B10 蛋白表达的影响
表2 IL-32α 对KYSE450 细胞miR-216b-5p和 AKR1B10 表达的影响(±s,n=9)

表2 IL-32α 对KYSE450 细胞miR-216b-5p和 AKR1B10 表达的影响(±s,n=9)
注:与对照组比较,aP<0.05;与 IL-32α 10μg/ml 组比较,bP<0.05;与IL-32α 25μg/ml 组比较,cP<0.05
分组 miR-216b-5p AKR1B10 蛋白对照组IL-32α 10μg/ml 组IL-32α 25μg/ml 组IL-32α 50μg/ml 组F P 1.00±0.08 1.75±0.18a 2.04±0.21ab 2.81±0.25abc 138.669 0.000 AKR1B10 mRNA 1.02±0.08 0.79±0.07a 0.65±0.06ab 0.43±0.04abc 133.727 0.000 0.69±0.06 0.50±0.05a 0.39±0.03ab 0.26±0.03abc 150.987 0.000

图4 miR-216b-5p靶向调控AKR1B10 的表达
表3 双荧光素酶报告实验(±s,n=9)
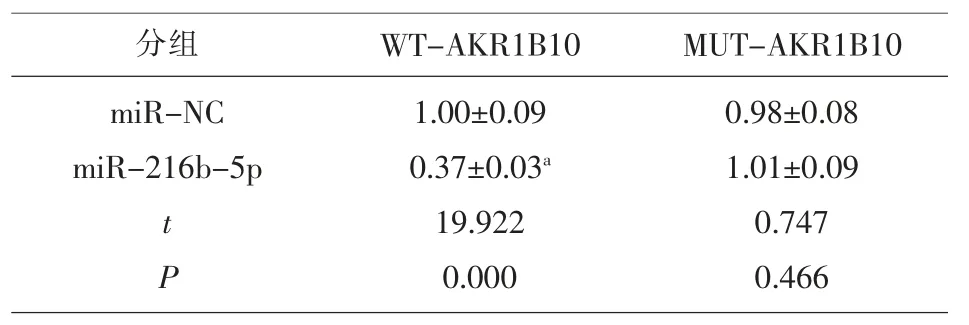
表3 双荧光素酶报告实验(±s,n=9)
注:与 miR-NC 组比较,aP<0.05
分组 WT-AKR1B10 miR-NC miR-216b-5p t P 1.00±0.09 0.37±0.03a 19.922 0.000 MUT-AKR1B10 0.98±0.08 1.01±0.09 0.747 0.466
表4 miR-216b-5p对 AKR1B10 蛋白表达的影响(±s,n=9)
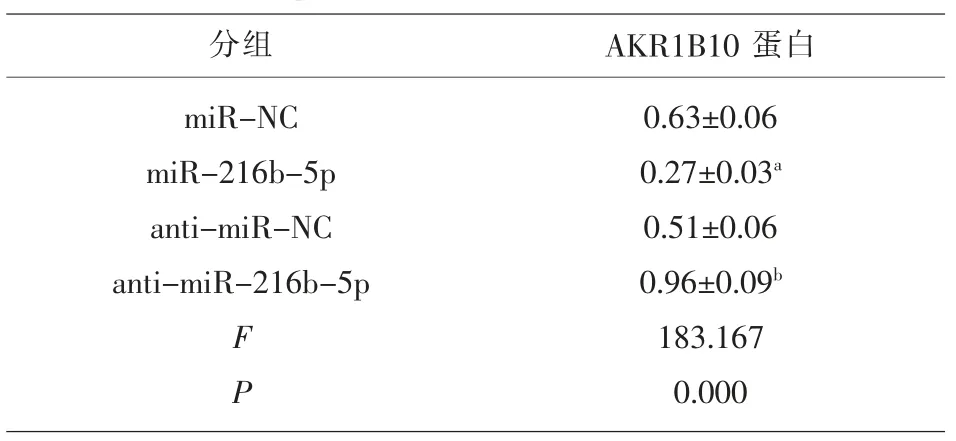
表4 miR-216b-5p对 AKR1B10 蛋白表达的影响(±s,n=9)
注:与 miR-NC 组比较,aP<0.05;与 anti-miR-NC 组比较,bP<0.05
分组 AKR1B10 蛋白miR-NC miR-216b-5p anti-miR-NC anti-miR-216b-5p F P 0.63±0.06 0.27±0.03a 0.51±0.06 0.96±0.09b 183.167 0.000
2.4 miR-216b-5p 过表达对KYSE450 细胞增殖、迁移侵袭的影响 与miR-NC 组比较,miR-216b-5p 组 miR-216b-5p 水平显著升高(P<0.05),表明miR-216b-5p mimics 转染成功,KYSE450 细胞中miR-216b-5p 过表达。与 miR-NC 组比较,miR-216b-5p 组KYSE450 细胞抑制率显著升高 (P<0.05), 迁移和侵袭细胞数显著降低 (P<0.05),CyclinD1、MMP-2 和MMP-9 蛋白水平显著降低 (P<0.05),p21 蛋白水平显著升高(P<0.05)。见图5 和表5。

图5 转染miR-216b-5pmimics后KYSE450细胞中CyclinD1、MMP-2 和MMP-9 蛋白表达
2.5 抑制AKR1B10 表达对KYSE450 细胞增殖、迁移侵袭的影响 与si-NC 组比较,si-AKR1B10 组AKR1B10 蛋白水平显著降低(P<0.05),表明 KYS E450 细胞中 AKR1B10 表达抑制。与 si-NC 组比较,si-AKR1B10 组KYSE450 细胞抑制率显著升高(P<0.05),迁移和侵袭细胞数显著降低(P<0.05),CyclinD1、MMP-2 和 MMP-9 蛋白水平显著降低(P<0.05),p21 蛋白水平显著升高(P<0.05)。见图6和表6。
2.6 抑制 miR-216b-5p 表达逆转了 IL-32α(50μg/ml) 对 KYSE450 细胞增殖、 迁移侵袭的作用 与IL-32α+anti-miR-NC 组比较,IL-32α+anti-miR-216b-5p 组 KYSE450、CyclinD1、MMP-2、MMP-9蛋白水平和迁移、侵袭细胞数显著升高(P<0.05),KYSE450 细胞抑制率和p21 蛋白水平显著降低(P<0.05)。见图7 和表7。
表5 miR-216b-5p过表达对KYSE450 细胞增殖、迁移侵袭的影响(±s,n=9)

表5 miR-216b-5p过表达对KYSE450 细胞增殖、迁移侵袭的影响(±s,n=9)
注:与 miR-NC 组比较,aP<0.05
分组 miR-216b-5p 抑制率(%) 迁移细胞数(个)侵袭细胞数(个)CyclinD1 蛋白miR-NC miR-216b-5p t P 1.00±0.09 2.78±0.28a 18.157 0.000 5.39±0.55 33.58±3.36a 24.839 0.000 101.25±9.28 59.67±5.82a 11.388 0.000 92.45±8.67 39.54±3.71a 16.832 0.000 0.77±0.07 0.35±0.03a 16.545 0.000 p21 蛋白0.23±0.03 0.59±0.05a 18.522 0.000 MMP-2 蛋白0.78±0.07 0.39±0.04a 14.512 0.000 MMP-9 蛋白0.69±0.07 0.31±0.03a 14.969 0.000
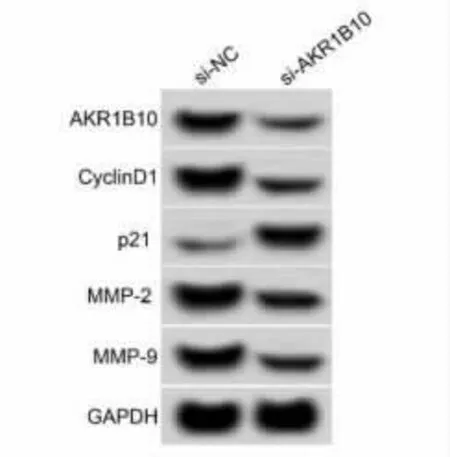
图6 转染 si-AKR1B10 后 KYSE450 细胞中AKR1B10、CyclinD1、MMP-2 和 MMP-9 蛋白表达
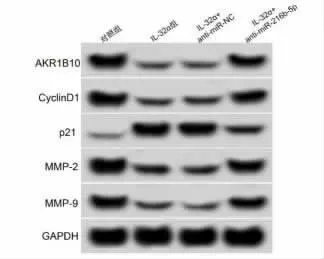
图7 IL-32α 对转染anti-miR-216b-5p的AKR1B10 中AKR1B10、CyclinD1、MMP-2 和 MMP-9 蛋白表达的影响
表6 抑制AKR1B10 对KYSE450 细胞增殖、迁移、侵袭及相关蛋白表达的影响(±s,n=9)
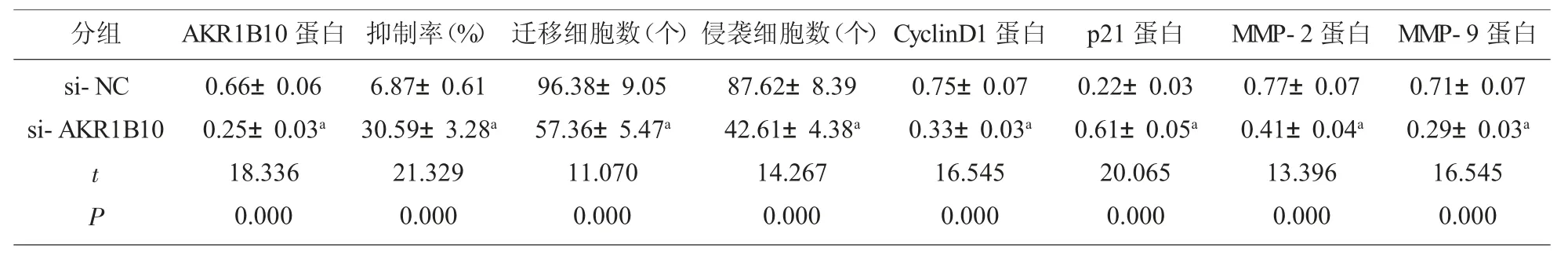
表6 抑制AKR1B10 对KYSE450 细胞增殖、迁移、侵袭及相关蛋白表达的影响(±s,n=9)
注:与 miR-NC 组比较,aP<0.05
分组 AKR1B10 蛋白 抑制率(%) 迁移细胞数(个)侵袭细胞数(个)CyclinD1 蛋白si-NC si-AKR1B10 t P 0.66±0.06 0.25±0.03a 18.336 0.000 6.87±0.61 30.59±3.28a 21.329 0.000 96.38±9.05 57.36±5.47a 11.070 0.000 87.62±8.39 42.61±4.38a 14.267 0.000 0.75±0.07 0.33±0.03a 16.545 0.000 p21 蛋白0.22±0.03 0.61±0.05a 20.065 0.000 MMP-2 蛋白 MMP-9 蛋白0.77±0.07 0.41±0.04a 13.396 0.000 0.71±0.07 0.29±0.03a 16.545 0.000
表7 抑制miR-216b-5p逆转了IL-32α(50μg/ml)对KYSE450 细胞增殖、迁移、侵袭及相关蛋白表达的作用(±s,n=9)
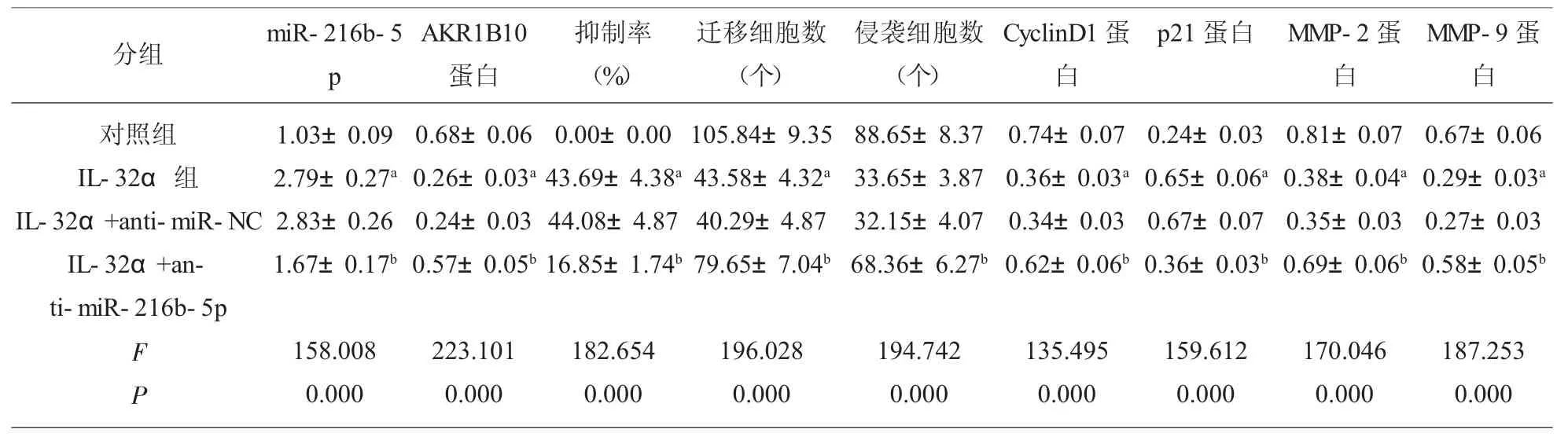
表7 抑制miR-216b-5p逆转了IL-32α(50μg/ml)对KYSE450 细胞增殖、迁移、侵袭及相关蛋白表达的作用(±s,n=9)
注:与对照组比较,aP<0.05;与 IL-32α+anti-miR-NC 组比较,bP<0.05
分组 miR-216b-5 p AKR1B10蛋白抑制率(%)迁移细胞数(个)对照组IL-32α 组IL-32α+anti-miR-NC IL-32α+anti-miR-216b-5p 1.03±0.09 2.79±0.27a 2.83±0.26 1.67±0.17b 0.68±0.06 0.26±0.03a 0.24±0.03 0.57±0.05b 0.00±0.00 43.69±4.38a 44.08±4.87 16.85±1.74b 105.84±9.35 43.58±4.32a 40.29±4.87 79.65±7.04b侵袭细胞数(个)p21 蛋白 MMP-2 蛋白MMP-9 蛋白88.65±8.37 33.65±3.87 32.15±4.07 68.36±6.27b CyclinD1 蛋白0.74±0.07 0.36±0.03a 0.34±0.03 0.62±0.06b 0.24±0.03 0.65±0.06a 0.67±0.07 0.36±0.03b 0.81±0.07 0.38±0.04a 0.35±0.03 0.69±0.06b 0.67±0.06 0.29±0.03a 0.27±0.03 0.58±0.05b F P 158.008 0.000 223.101 0.000 182.654 0.000 196.028 0.000 194.742 0.000 135.495 0.000 159.612 0.000 170.046 0.000 187.253 0.000
3 讨论
食管癌是严重威胁人类健康的恶性肿瘤,其发生和发展与肿瘤微环境关系密切[20]。炎症在组织周围释放的大量炎性因子参与肿瘤的生长[21]。肿瘤微环境中的多种炎性介质已用于肿瘤治疗的药物靶点,在肿瘤治疗的临床试验中取得了一定的治疗效果[22]。IL-32 是一种内源性的炎症调控因子,可诱导IL-6、IL-8 等炎性介质的表达,在炎症中发挥关键作用[23]。IL-32α 是 IL-32 的主要亚型,研究显示,外源性的IL-32α 可抑制人黑素瘤HTB-72 细胞增殖,并诱导其凋亡[24]。本研究结果显示,不同浓度的IL-32α 可抑制KYSE450 细胞增殖,迁移和侵袭,且呈剂量依赖性,为食管癌的靶向治疗提供了一定的新思路,但其作用机制有待深入研究。
miRNA 广泛存在于真核生物体内,与肿瘤的发生和发展密切相关。本研究结果显示,过表达miR-216b-5p 抑制了 KYSE450 细胞增殖、 迁移和侵袭,说明miR-216b-5p 参与食管癌的发生和发展,上调其表达可延缓食管癌发展进程。为了探究IL-32α 抑制食管癌细胞增殖、 迁移和侵袭的作用机制,本研究检测了IL-32α 对食管癌细胞中miR-216b-5p 水表达的影响,结果显示,IL-32α 可促进KYSE450 细胞中miR-216b-5p 的表达,提示 IL-32α 可能通过上调 miR-216b-5p 表达抑制KYSE450 细胞增殖、迁移和侵袭。
miRNA 可与其靶 mRNA 的 3’UTR 结合,抑制靶mRNA 翻译或降解靶mRNA,通过调控靶基因表达发挥生物学作用。在线靶基因预测软件预测显示,AKR1B10 可能是miR-216b-5p 的靶基因。本研究利用双荧光素酶报告基因实验证实了miR-216b-5p 可与 AKR1B10 的 3’UTR 靶向结合。同时,上调miR-216b-5p 表达抑制了AKR1B10 蛋白的表达, 而下调miR-216b-5p 表达促进了AKR1 B10 蛋白的表达,进一步说明了miR-216b-5p 靶向负调控AKR1B10 表达。AKR1B10 参与多种肿瘤的发生和发展, 如沉默AKR1B10 表达可能通过FAK/Src/Rac1 信号通路抑制乳腺癌细胞迁移和侵袭[25],miR-383-5p 通过靶向调控 AKR1B10 表达阻滞肝癌细胞的细胞周期进程,抑制细胞生长[26]。本研究结果显示,抑制AKR1B10 表达抑制了食管癌KYSE450 细胞的增殖、迁移和侵袭能力,与相关研究报道结果一致[27]。研究还显示,IL-32α 可抑制KYSE450 细胞中AKR1B10 的表达,而抑制miR-216b-5p 表达逆转了 IL-32α 对食管癌 KYSE450细胞增殖、迁移和侵袭的影响,提示IL-32α 可能通过上调KYSE450 细胞中miR-216b-5p 表达,进而靶向负调控AKR1B10 表达抑制KYSE450 细胞增殖、迁移和侵袭。
综上所述,IL-32α 是一种可抑制食管癌细胞KYSE450 的增殖、迁移和侵袭的炎性细胞因子,其可能通过调控细胞中miR-216b-5p/AKR1B10 轴发挥作用。
