一株产CoQ10 的类球红细菌分离鉴定及诱变选育
2021-05-18姚丽莉许齐纯刘晓萌李鸿鑫高鑫誉徐梧皓吕常江曹宏伟
姚丽莉, 许齐纯, 刘晓萌, 李鸿鑫,高鑫誉, 徐梧皓, 吕常江*,4, 曹宏伟
(1. 黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆163000;2. 浙江科技学院 生物与化学工程学院,浙江杭州310023;3. 南京市产品质量监督检验院,江苏 南京210029;4. 江南大学 生物工程学院,江苏 无锡214122)
辅酶Q10(Coenzyme Q10,CoQ10)化学名称为2,3-二甲氧基-5-甲基-6-癸异戊烯基苯醌,广泛存在于高等动物线粒体内膜中,是细胞呼吸链中重要的电子受体, 也是合成三磷酸腺苷(adenosine triphosphate,ATP)所必须的重要辅酶之一[1]。作为天然的抗氧化剂和细胞代谢激活剂[2],CoQ10具有抗氧化、抗衰老、清除体内自由基、维持细胞膜通透性及提高机体免疫力等多种生理功能, 广泛应用于医药、食品和化妆品等行业[3-4]。 近年来,CoQ10作为一种辅助药物,在治疗冠心病、急慢性肝炎、阿尔茨海默症、糖尿病、帕金森症及弱精子症等疾病方面使用比例逐年增加[5-7]。因而,实现CoQ10高效合成具有重要经济价值。
CoQ10的制备方法主要有动植物组织提取法、植物细胞培养法、化学合成法及微生物发酵法[8]。 相较于前三者,微生物发酵法具有原材料丰富、成本低、可规模放大、分离过程相对简单、环境污染物较少、产品活性好、不存在手性问题等优点,已成为CoQ10生产的首选途径[9]。 迄今为止,已有多株产CoQ10菌株被发掘,分布于假丝酵母、掷孢酵母、隐球酵母、裂殖酵母、烟曲霉、链霉菌、黑粉菌、假单胞菌、土壤杆菌、日本葡萄糖酸杆菌、脱氮极毛杆菌、脱氮副球菌、红极毛杆菌、荚膜红细菌、浑球红细菌及类球红细菌等多个种属[10-11]。 其中,类球红细菌(Rhodobacter sphaeroides) 是一种紫色非硫光合细菌,可通过循环光合磷酸化获取能量(ATP)用于自身生长繁殖[12]。 R. sphaeroides 细胞内需积累较多的CoQ10以消除光合作用产生的大量自由基; 同时,R. sphaeroides 细胞内膜系统较发达, 在发酵后期,细胞膜发生形变并向内褶皱, 为CoQ10提供附着位点[13],因而成为发酵制备CoQ10的主要菌种之一。 但野生型R. sphaeroides 的CoQ10产量较低,发酵生产过程中存在收率偏低和成本较高等问题,制约了产品进一步市场化。
近年来,随着R. sphaeroides 生理代谢机制研究的深入,其CoQ10合成途径被逐渐解析,见图1。 主要涉及3 个模块:莽草酸途径(SKP)、甲基赤藓糖醇磷酸盐(MEP)途径和泛醌(QMP)途径。 除通过发酵调控策略[14-15]提升CoQ10产率外,利用诱变育种或代谢工程改造获取高产菌株已成为研究的主要方向。如图1 所示,4-羟基苯甲酸(p-hydroxybenzoic acid,pHBA)是CoQ10合成的前体,但其积累对细胞有毒害作用。 基于这一现象,扶教龙[16]和柯崇榕[17]等分别通过亚硝基胍(NTG)或紫外线对R. sphaeroides 进行诱变, 并以pHBA、CoQ10结构类似物维生素K3、叠氮化钠等复合物作为抗性筛选标记,所获得的高产突变株R.sp3-7 与EIM-4 的CoQ10产量分别达到93.63 mg/L 和185.71 mg/L,较出发菌株分别提高了116.8%和29.31%。 UbiG 是QMP 途径中的关键蛋白,Lu[18]等通过代谢工程手段过表达该蛋白质促使CoQ10产量由47.6 mg/L 提升至65.8 mg/L;而在此基础上进一步组合优化MEP 途径中DXS、DXR、IDI和IspD 的表达,使得CoQ10产量提高至93.34 mg/L。类胡萝卜素与CoQ10合成途径竞争前体物质香叶基香 叶 基 焦 磷 酸 (Geranylgeranyl pyrophosphate,GGPP)。Zhu[19]等通过调控光氧调控因子ppsR 表达,适当抑制类胡萝卜素的合成, 促使CoQ10的产量提高了约28%; 而后将GGPP 合成关键酶CrtE 和PpsR 串联, 从而解除了PpsR 对crtE 表达的抑制,进一步提高CoQ10的产量至73.2 mg/L,比野生型提高了47%。
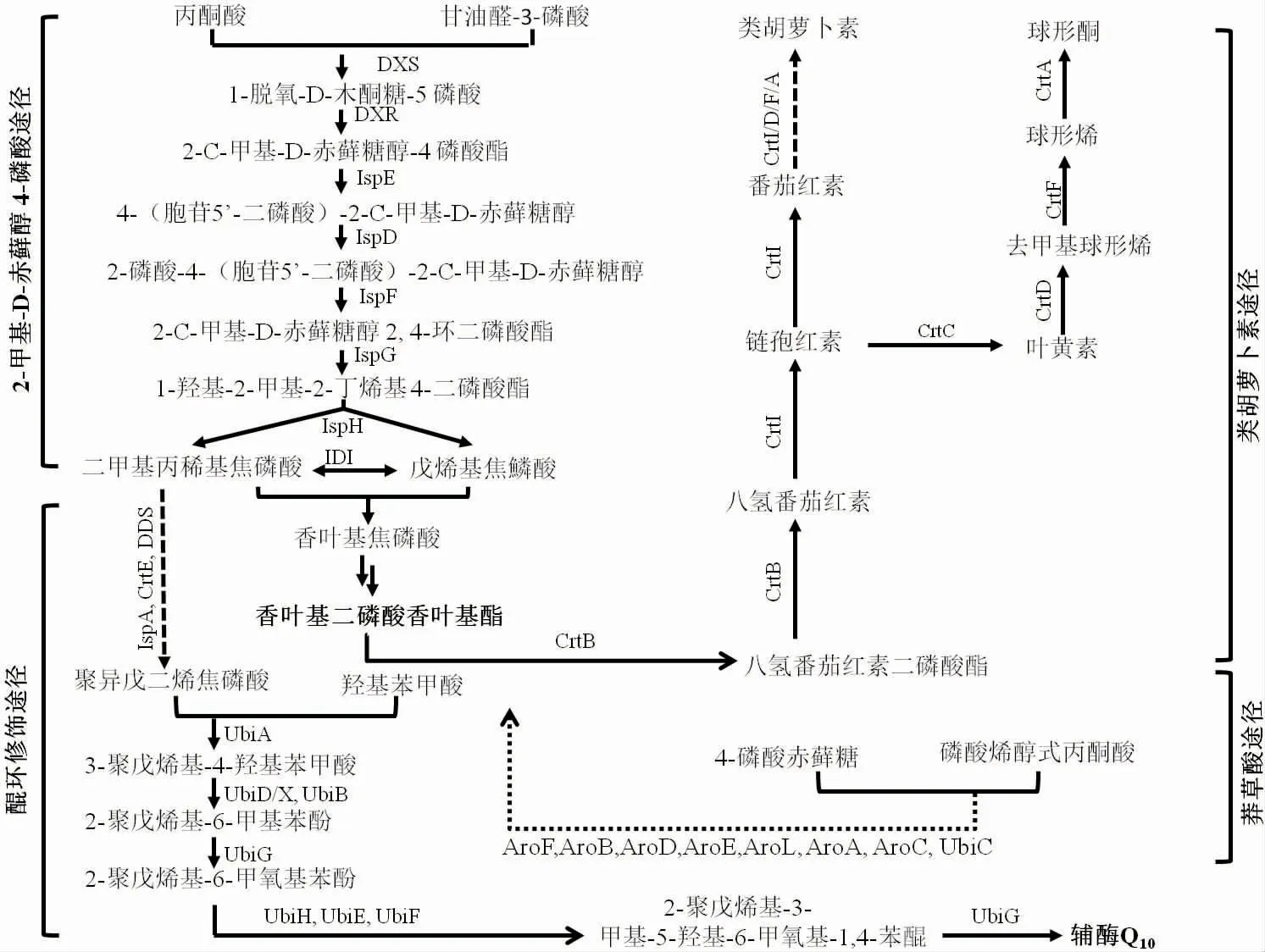
图1 类球红细菌中类胡萝卜素和CoQ10 的合成途径Fig. 1 Synthesis pathways of carotenoids and CoQ10 in R. sphaeroides
为获取CoQ10高产菌株, 作者首先从污水处理厂的淤泥中富集、 分离了15 株产CoQ10光合细菌。随后,对CoQ10产率最高的菌株(YLL-13)进行了生理生化特性及16S rDNA 系统发育分析。 进一步以该菌株为出发菌株, 采用亚硝基胍进行化学诱变,以维生素K3 和PHBA 为筛选标记, 获取了一株具有低类胡萝卜素合成、 高生长速率和高CoQ10积累的突变菌株(YLL-13-T),并初步研究了该突变菌株发酵合成CoQ10的特性。
1 材料与试剂
1.1 实验材料
1.1.1 培养基
1)富集培养基(组分g/L)[20]:NaCl 1.5,NaHCO31.0,K2HPO40.2,CH3COONa 3.0,MgSO4·7H2O 0.2,NH4Cl 1.0;生长素辅助因子贮液1 mL,微量金属元素贮液10 mL,pH 7.0。
生长素辅助因子贮液(组分mg/L):硫胺素5.0,烟酸10.0,4-氨基苯甲酸15.0,生物素15.0。
微量金属元素贮液 (组分mg/L):FeCl3·6H2O 5.0,CuSO4·5H2O 0.05,H3BO31.0,MnCl2·4H2O 0.05,ZnSO4·7H2O 1.0,Co(NO3)2·6H2O 0.5;pH 7.0。
2)种子培养基:葡萄糖3.0 g/L,酵母粉8.0 g/L,玉米浆干粉1.0 g/L,NaCl 2.0 g/L,KH2PO41.3 g/L,MgSO4125 mg/L,FeSO4100 mg/L,MnSO41.0 mg/L,生物素15.0 mg/L,烟酸1.0 mg/L,硫胺素1.0 mg/L,pH 7.2。
3)发酵培养基:葡萄糖40.0 g/L,玉米浆干粉5.5 g/L,谷氨酸钠3.0 g/L,NaCl 2.0 g/L,CaCl20.1 g/L,KH2PO42.5 g/L,MgSO46.3 g/L,(NH4)2SO42.5 g/L,FeSO4100 mg/L,MnSO41.0 mg/L,CoCl220.0 mg/L,生物素15.0 mg/L,烟酸1.0 mg/L,硫胺素1.0 mg/L,pH 7.2。
1.1.2 主要试剂 细菌基因组DNA 抽提试剂盒、PCR 产物纯化试剂盒:购自生工生物工程(上海) 股份有限公司;PrimerSTAR® Max DNA Polymerase、DNA Marker:购自Takara 公司;硫胺素、生物素、烟酸、pHBA、 亚硝基胍、 维生素K3、CoQ10标准品,甲醇、乙醇(色谱纯):购自阿拉丁试剂(上海)有限公司; 谷 氨 酸 钠、NaOH、(NH4)2SO4、CaCO3、FeSO4、MnSO4、CoCl2、无水乙醇、乙酸乙酯:购自国药集团化学试剂有限公司;玉米浆干粉:购自上海缘肽生物有限公司。
1.2 实验方法
1.2.1 CoQ10产生菌的筛选 将1 g 采自黑龙江省大庆市林甸县林甸镇污水处理厂的底泥样品溶在100 mL 无菌水中,32 ℃、150 r/min 摇床振荡孵育30 min。 随后, 取1 mL 悬液接种于富集培养基中,32 ℃下光照厌氧(1 500 Lx)培养2 d。 取100 μL 上述微红培养物转接至第二瓶富集培养基中继续培养,重复3~4 次后于固体培养基上进行多次划线分离,获取单菌落。 挑取形态、大小及颜色差异的菌落,接种至种子培养基中,32 ℃、200 r/min 摇床振荡培养4 d,离心收集菌体细胞并测定CoQ10含量。
1.2.2 生理生化特征实验 选取CoQ10含量较高的菌株,参照《伯杰氏系统细菌学手册》(第9 版)及东秀珠等编著的 《常见细菌系统鉴定手册》(第1 版)中相应属、种鉴定的有关内容选择生理生化试验性状,包含惟一碳源、氮源、电子供体及生长因子生长试验、触酶试验,采用扫描电子显微镜进行细菌形态观察。
1.2.3 菌株16S rDNA 序列分析 取0.5 mL 菌悬液, 离心收获菌体细胞并采用细菌基因组DNA 抽提试剂盒提取基因组DNA, 以细菌鉴定通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′) 进行序列PCR扩增。PCR 扩增条件:98 ℃5 min;98 ℃20 s,55 ℃15 s,72 ℃25 s, 进行30 个循环;72 ℃延伸6 min。PCR 产物经1.0 g/dL 琼脂糖凝胶电泳检测后送至哈尔滨中科赛恩斯生物技术有限公司进行测序。 测序结果递交至GenBank 核酸数据库中, 获取登录号。采用Clustal W 进行序列比对,利用MEGA 5.1 软件的Neighbour Joining 法构建系统发育树, 进行系统发育分析。
1.2.4 色素的提取及TLC 指纹图谱获取 离心收集好氧培养条件下的菌体细胞,经0.2 mol/L 的PBS(pH 7.2)洗涤3 次后,采用超声辅助的丙酮-甲醇提取法[23](甲醇、丙酮-甲醇(体积比7∶2)和丙酮作为提取剂各提取一次)进行色素抽提。 超声波处理条件:功率400 W,超声3 s,间歇6 s,循环200 次。 4 ℃、8 000 r/min 离心15 min,收集上清液并合并。 色素粗提液经减压旋转蒸发干燥后采用乙醚溶解并定容,于硅胶G 板上进行点样,点样量为10~20 μL;然后选择不同极性的展层剂 (石油醚∶正己烷∶异丙醇∶丙酮的体积比为10∶0.95∶0.25∶0.40) 进行避光展层,展层结束后将展层板拍照,获取色素的TLC 指纹图谱。
1.2.5 吸收光谱测定及类胡萝卜素质量分数分析活细胞吸收光谱测定: 菌体细胞经pH 7.5 的10 mmol/L Tris-HCl 缓冲液洗涤2 次, 悬浮于质量分数60%的蔗糖溶液中,选用光程为1 cm 的96 孔石英酶标板于光吸收酶标仪(SPECTRA MAX 190)中进行全波长光谱扫描,加样量为200 μL,扫描波长范围为190~800 nm。色素吸收光谱测定也采用石英酶标板,扫描波长范围相同。根据Jessen 公式:C=DVf×10/2 500, 计算细胞类胡萝卜素含量。 式中,C为胡萝卜素总质量(mg);V 为抽提液总体积(mL);f为稀释倍数;D 为离体类胡萝卜素最大吸收峰(λ=480 nm)的光密度;2 500 为类胡萝卜素的平均消光系数。
1.2.6 菌株诱变方法 取1 mL 原始菌株菌悬液,5 000 r/min 离心5 min 获取菌体, 生理盐水离心洗涤两次, 重悬于质量浓度为0.6 mg/mL 亚硝基胍的生理盐水中,室温静置45 min。 5 000 r/min 离心5 min获取菌体, 生理盐水重悬后涂布于含有12 mg/L 维生素K3 和0.6 g/L pHBA 的固体平板上,32 ℃静置培养4~5 d。挑取平板上菌落较大、颜色较浅、菌落粘性相对较低的突变菌株,于种子培养基中32 ℃、200 r/min 条件下培养120 h,HPLC 法测定细胞中CoQ10产量。
1.2.7 CoQ10发酵条件 采用10 L 发酵罐对出发菌和突变株进行发酵, 并测定发酵液中CoQ10的质量浓度。 发酵控制工艺:装液量为4.5 L,发酵温度为32 ℃,通气比2.0 vvm,初始搅拌速率为500 r/min;48 h 后调节搅拌速率至400 r/min, 通气比0.75 vvm。 发酵时长120 h,氨水调控pH 在7.2 左右。 当发酵体系葡萄糖质量浓度低于10 g/L 时,采用指数流加补料方式维持葡萄糖在10 g/L。离心收获菌体,超声辅助提取CoQ10。
1.2.8 CoQ10的提取 取上述菌悬液于8 000 r/min离心15 min, 所得菌体再用无菌生理盐水洗涤两次。取1 mL 发酵菌悬液,加入200 μL 20 mmol/L 的HCl 并充分混匀,75 ℃条件下水浴15 min,5 000 r/min 离心10 min,弃上清液,加入5 mL 提取液(V乙酸乙酯∶V乙醇=5∶3)并充分混匀,而后置于超声波清洗仪中,超声辅助(功率400 W)提取15 min,避光抽提10 min。 将抽提液于8 000 r/min 条件下离心15 min,获得CoQ10提取液。
1.2.9 CoQ10定性及定量分析 CoQ10定性分析采用液相色谱-质谱法 (HPLC-MS)。 色谱条件:Hypersil ODS(C18)色谱柱(4.6 mm×150 mm,5 μm);流动相为纯甲醇;柱温40 ℃;检测波长275 nm;流量0.5 mL/min;进样量20 μL;离子源为电喷雾离子源(ESI),采用正离子模式检测;扫面范围为100~1 800 m/z;干燥气流为6 L/min;雾化气压20 psi;毛细管电压4 000 V。
CoQ10定量分析采用高效液相色谱 (HPLC)法测。 色谱条件:Hypersil ODS(C18)色谱柱(4.6 mm×150 mm,5 μm);流动相为V甲醇∶V异丙醇=3∶1;柱温40 ℃;检测波长275 nm;流量1 mL/min;进样量10 μL。
2 结果与分析
2.1 产CoQ10 光合细菌的分离与筛选
振荡孵育处理的底泥样品接种于富集培养基中,光照厌氧(1 500 Lx、32 ℃)静置培养2 d 后传代培养3~4 次。 选取深红色的菌悬液,梯度稀释后涂布固体平板并获取单菌落。 随后挑取颜色、形态与大小差异的15 个菌落, 于液体试管中活化后进行划线分离,以获取纯菌株。 将上述菌株接种于种子培养基中,32 ℃、200 r/min 摇床振荡培养4 d 后离心收集菌体细胞, 并采用HPLC-MS 及HPLC 法分别对细胞中CoQ10进行定性及定量分析,见图2(a)。结果显示, 筛选获取的15 株光合细菌细胞中均含有CoQ10, 但其产量差异较大; 其中,13 号 菌株(YLL-13)CoQ10产量最高,为0.23 g/L,见图2(b)。因此,选取该菌株为目的菌株,进行生理生化特性分析。
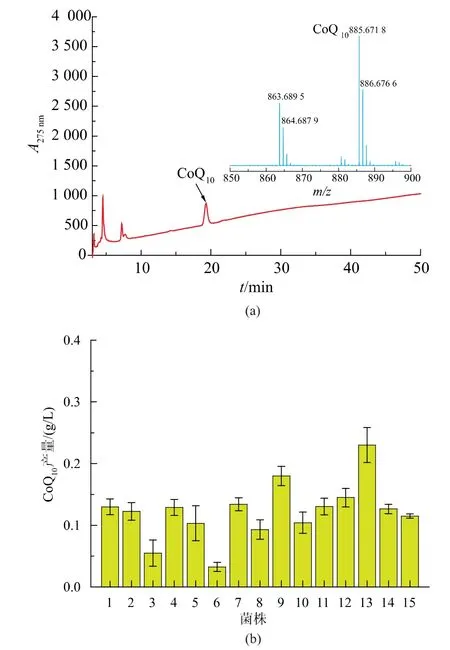
图2 CoQ10 的HPLC-MS/MS 图谱及各菌株CoQ10 产量分析Fig. 2 HPLC-MS/MS chromatogram of CoQ10 and the CoQ10 concentration of selected strains
2.2 产CoQ10 菌株生理生化特性分析
参照《伯杰氏系统细菌学手册》及《常见细菌系统鉴定手册》中相应属、种鉴定的有关内容对菌株YLL-13 进行生理生化试验。 结果显示:该菌株为微好氧菌,菌落圆形凸起、边缘整齐、表面湿润有粘性、呈深红色,能利用苹果酸、葡萄糖、阿拉伯糖、乳糖、D-半乳糖、D-麦芽糖、蔗糖、乙醇、谷氨酸盐、甘油及硫代硫酸钠,不能利用柠檬酸、精氨酸、D-甘露糖、L-鼠李糖、D-木糖、蜜二糖与鸟氨酸。 该菌株能水解淀粉和液化明胶,接触酶、氧化酶、磷酸酶及乙醇脱氢酶均为阳性,尿酶阴性,不能还原硝酸盐,不产H2S,无生长因子,生物素为其生长刺激因子。 菌株YLL-13 的生理生化特征与类球红细菌基本一致。
2.3 菌株16S r DNA 序列分析
提取菌株YLL-13 基因组DNA,以细菌鉴定通用引物对其16S rDNA 进行PCR 扩增。 随后,将特异性条带切胶回收、 纯化并测序, 结果上传至Genbank,获取登录号MN625849.1。 采用Clustal W软件进行同源序列比对, 并利用MEGA 5.1 软件中的Neighbour Joining 法构建系统发育树,见图3。 系统进化分析显示, 菌株YLL-13 与R. sphaeroides 2.4.1 及R. sphaeroides ATCC17029 聚为一族, 相似性达100%。 由此,依据菌株生理生化及系统进化分析,将菌株YLL-13 鉴定为类球红细菌(Rhodobacter sphaeroides),并命名为R. sphaeroides YLL-13。
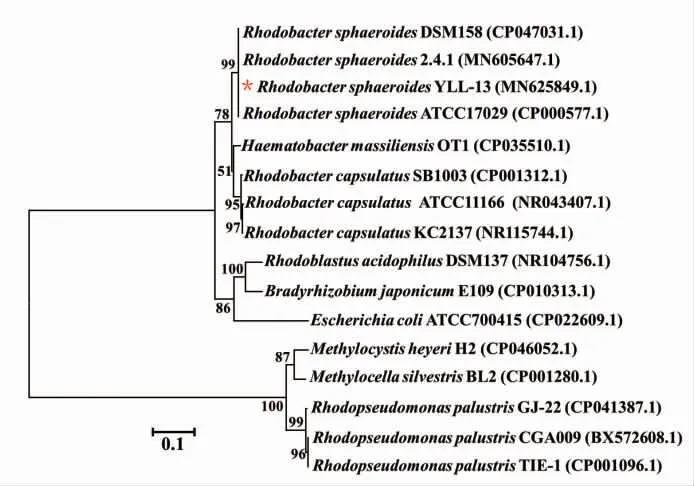
图3 菌株16S r RNA 基因系统进化分析Fig. 3 Phylogenetic relationships of the strains drived from 16S r DNA sequences
2.4 化学诱变选育高产CoQ10 突变株
为进一步提升R. sphaeroides YLL-13 的CoQ10合成效率, 选取NTG 为诱变剂、 以维生素K3 和pHBA 为复合筛选标记, 对菌株YLL-13 进行诱变选育。在含有12 mg/L 维生素K3和0.6 g/L pHBA 的平板上,共获取了约200 余个单菌落;随机挑选10个直径较大的菌落接种至种子培养基中,32 ℃、200 r/min 下振荡培养120 h,测定细胞中CoQ10产量,结果见图4。 除M2 与M6 外,其它菌株合成CoQ10的能力较野生型菌株均有所提升;其中,M9 菌株最为明显,达到0.47 g/L;且传代培养15 代后CoQ10产量仍保持在92%左右,表明该突变株具有良好的遗传稳定性。 此外, 突变株M9 菌落形态与野生菌株相似,细胞形态呈短杆状,未发生明显变化,见图5。
值得关注的是, 尽管突变株M9 活细胞吸收光谱(图6(a))及色素提取液吸收光谱(图6(b))均未发生蓝移或红移,色素的TLC 指纹图谱亦相似(图6(c)),但该突变株液体培养物颜色相对较浅,呈粉红色, 且类胡萝卜素质量分数为1.47 mg/g(DCW),较野生菌株降低了36.3%, 表明突变株类胡萝卜素合成速率发生明显改变。 基于此,将该突变株命名为R. sphaeroides YLL-13-T, 并保藏至中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.1883。
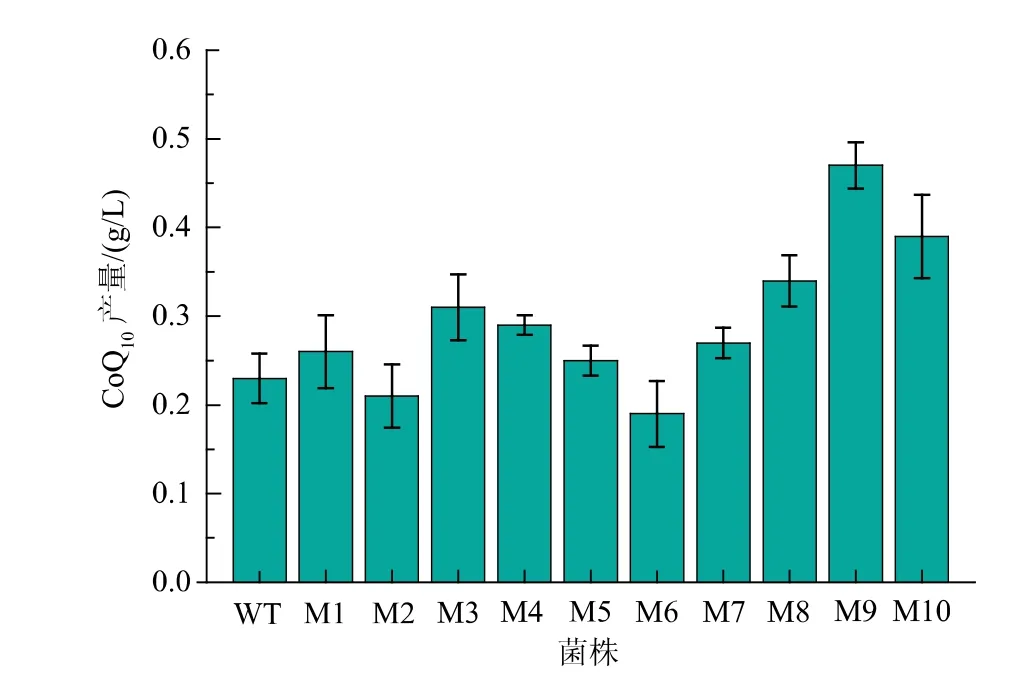
图4 化学诱变筛选结果Fig. 4 Screening results of chemical mutagenesis

图5 R. sphaeroides YLL-13 及其突变株M9的扫描电镜图Fig. 5 Scanning electron microscopy of R. sphaeroides YLL-13 and its mutant M9
2.5 高产突变株批次发酵产CoQ10 性能分析
将R. sphaeroides YLL-13 和R. sphaeroides YLL-13-T 接种于含有50 mL 种子培养基的250 mL 锥形瓶中,于32 ℃、200 r/min 培养24 h,作为一级种子液。 随后,将菌悬液全部转接至含有450 mL种子培养基的1 L 锥形瓶中,32 ℃、200 r/min 下继续培养20~22 h,作为二级种子液。 而后,将上述500 mL 二级种子液进一步转接至10 L 发酵罐中,装液量为4.5 L,发酵温度为32 ℃,通气比2.0 vvm,初始搅拌速率为500 r/min;48 h 后调节搅拌速率至400 r/min,通气比0.75 vvm,氨水调控pH 在7.2 左右;当发酵体系葡萄糖质量浓度低于10 g/L 时,采用指数流加补料方式维持葡萄糖在10 g/L, 发酵时长120 h。
上述条件下,R.sphaeroides YLL-13 与R.sphaeroides YLL-13-T 的细胞生长及CoQ10合成见图7。研究显示,随着发酵的进行,野生菌YLL-13 和突变株YLL-13-T 生物量逐渐增加,至60 h 左右进入平衡期,但突变株呈现出更高的生长速率。 与细胞生长相类似,YLL-13 和突变株YLL-13-T 细胞中CoQ10的积累也呈现相似的趋势。 与之相对,两菌株CoQ10产率在对数期较为接近, 但当细胞生长进入平衡期(60 h),突变株YLL-13-T 的CoQ10产率则逐渐高于野生菌株。 发酵结束时(120 h), 突变株YLL-13-T 的生物量、CoQ10产量和CoQ10产率分别为83.5 g/L、1.04 g/L 和12.46 mg/g(DCW),较出发菌株提高了12.3%、42.5%和23.6%, 呈现出更好的工业化应用前景。 此外,能否通过代谢工程手段对R. sphaeroides YLL-13-T 的CoQ10生物合成途径进行遗传修饰或改造以进一步提高其CoQ10产量,值得进一步探索。
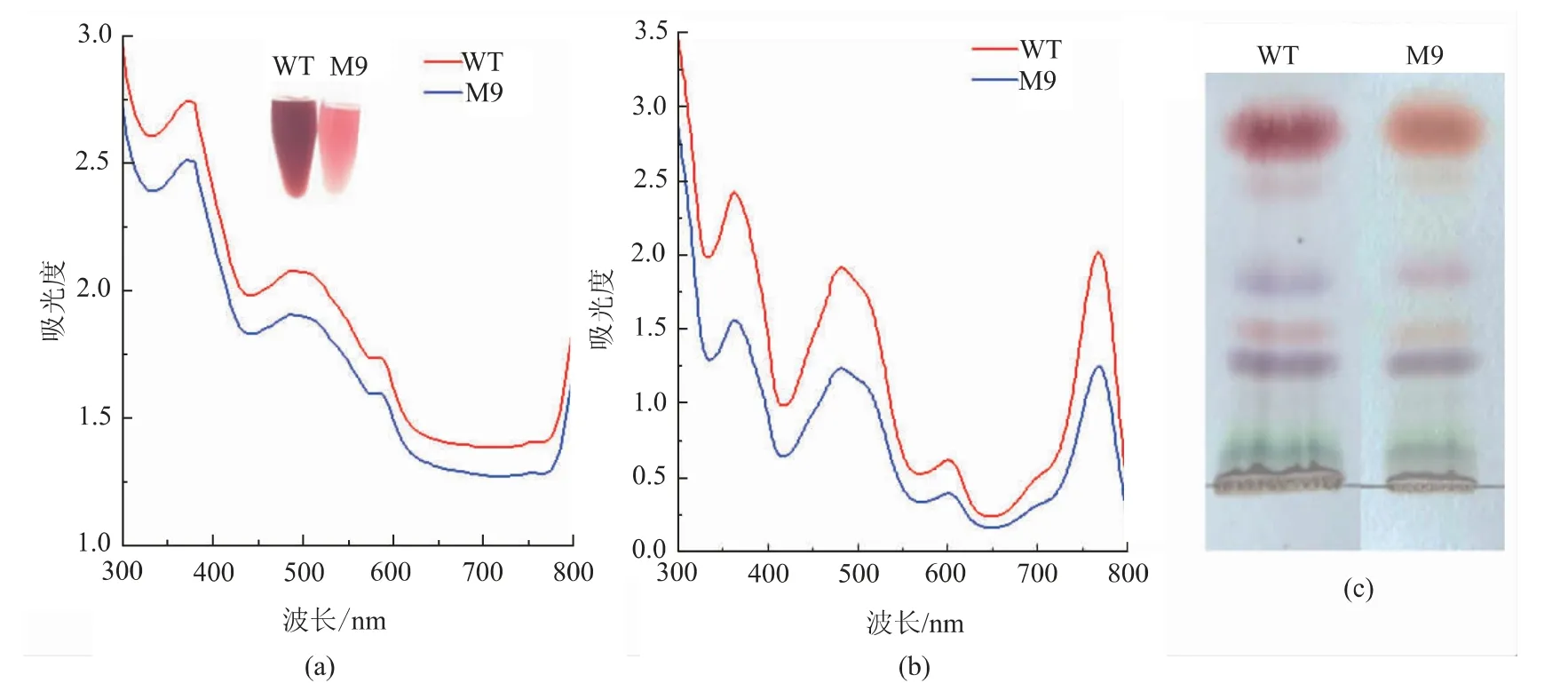
图6 活细胞吸收光谱、色素提取液吸收光谱及色素的TLC 指纹图谱Fig. 6 Absorption spectra of living cells of YLL-13 and its mutant M9,pigment extracts and profile of pigment fingerprints on TLC

图7 菌株YLL-13 及突变菌株YLL-13-T 批次发酵产CoQ10 性能分析Fig. 7 Fed-batch fermentation process of CoQ10 produced by wild-type strain YLL-13 and mutant strain YLL-13-T
3 结 语
从污水处理厂的淤泥中筛选到一株CoQ10高产菌株YLL-13,通过其形态观察、生理生化特性分析及16S rDNA 序列比对,鉴定为类球红细菌,并命名为R. sphaeroides YLL-13。 为进一步提升该菌株COQ10合成效率,选取NTG 为诱变剂,以维生素K3和pHBA 为复合筛选标记,对其进行诱变选育,并筛选获取了一株具有相对低类胡萝卜素合成、 高生长速率和高CoQ10积累特性且遗传稳定的突变菌株(R. sphaeroides YLL-13-T)。 在所考察的发酵体系中,发酵120 h 后突变株YLL-13-T 的CoQ10产量和产率达到1.04 g/L 和12.46 mg/g(DCW),比出发菌株分别提高了42.5%和23.6%, 展现出更好的应用前景。
