2型糖尿病并发非酒精性脂肪肝患者的临床特征及影响因素分析
2021-05-18梁玲霞赵猛姚佳丽张梅李树法李伟
梁玲霞,赵猛 ,姚佳丽,张梅,李树法,李伟
1徐州医科大学附属医院内分泌科,江苏徐州221000;2青岛大学附属医院内分泌与代谢病科,山东青岛266100
非酒精性脂肪性肝病(NAFLD)是一类排除酒精因素,由肝细胞代谢异常导致的肝细胞损伤,是与多种复杂糖脂代谢紊乱有关的代谢性疾病。目前,继发于2型糖尿病(T2DM)的NAFLD患者在临床上尤为多见,发生率已高达49%~62%[1]。研究发现,NAFLD患者的肝细胞糖脂代谢功能明显恶化,影响肝细胞增殖、分化,加速肝细胞向肝纤维化、肝硬化方向进展[2],已引起了临床高度关注。研究表明,NAFLD的发病机制与遗传、胰岛素抵抗等因素相关[3-4]。由于T2DM患者存在不同程度的胰岛素抵抗,较非糖尿病患者更易并发NAFLD。因此,在临床诊疗过程中,如何通过常规临床指标判断T2DM患者是否为NAFLD的高危人群,并进行彩超筛查,将是及早诊断NAFLD的重要任务。本文旨在通过对T2DM并发NAFLD患者的临床指标特征及独立危险因素分析,对临床上诊疗此类患者提供理论参考。
1 资料与方法
1.1 临床资料 收集2018年8月—2019年5月在徐州医科大学附属医院内分泌科住院的T2DM患者167例,男97例、女70例,年龄13~85岁。纳入标准:符合2017年版《2型糖尿病防治指南》[5]的T2DM诊断标准;NAFLD的诊断依据为既往已经存在T2DM,住院期间于我院彩超室行空腹状态消化系彩超提示脂肪肝。排除标准:伴有脏器功能不全者;伴有恶性肿瘤者;伴有传染性疾病或感染性疾病者;合并免疫系统性疾病者;糖尿病急性并发症者;近期存在病毒性肝炎、药物性肝损伤、大量饮酒史、感染等可能对肝脏造成影响者。两组间性别、年龄差异均无统计学意义(P均>0.05)。本研究为回顾性分析,临床资料抽取及阅读均获得患者知情同意。
1.2 资料收集 ①一般资料:收集患者的性别、年龄、糖尿病病程、身高、体质量等基本信息,计算体质量指数(BMI)=体质量/身高2(kg/m2)。②实验室检查指标:空腹8 h以上抽取静脉血,使用日立7600全自动生化分析仪化验空腹血糖(FPG)、TG、TC、LDLC、HDL-C、糖化血红蛋白(HbA1c)、ALT、AST、空腹胰岛素、空腹-C肽(FCP)等生化指标,计算胰岛素抵抗指数(HOMA-IR)。HOMA-IR=1.5+FPG(mmol/L)×FCP(pmol/L)/2 800。
1.3 NAFLD检查及诊断方法 对167例患者于空腹状态下行腹部肝脏多普勒超声检查,根据彩超检查结果有无肝细胞内脂肪蓄积诊断是否存在NAFLD。
1.4 评价指标 比较有、无合并NAFLD的T2DM患者的一般资料、实验室检查指标;比较不同HbA1c、TG、TC、BMI水平分层的T2DM患者NAFLD发生率;分析影响T2DM患者并发NAFLD的独立危险因素。
1.5 统计学方法 采用SPSS19.0统计软件。计量资料经正态性检验,符合正态分布的资料均采用±s表示,两组间比较采用独立样本t检验。非正态数据均采用中位数(四分位数)表示,组间比较采用Mann-Whitney U检验。分类计数资料均采用例(百分比)表示,组间比较采用χ2检验。以T2DM患者是否合并NAFLD为因变量,以临床指标为自变量进行二元lo⁃gistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 NAFLD诊断情况 根据B超结果,将纳入人群分为单纯T2DM患者86例、T2DM并发NAFLD患者81例。
2.2 有、无并发NAFLD的T2DM患者一般资料及实验室检查指标比较 T2DM并发NAFLD患者的HbA1c、TG、TC、BMI、ALT、FCP、HOMA-IR均高于单纯T2DM患者,糖尿病病程小于单纯T2DM患者(P均<0.05)。有、无并发NAFLD的T2DM患者在性别、年龄、FPG、LDL-C、HDL-C、AST、空腹胰岛素间的差异均无统计学意义(P均>0.05)。见表1、2。
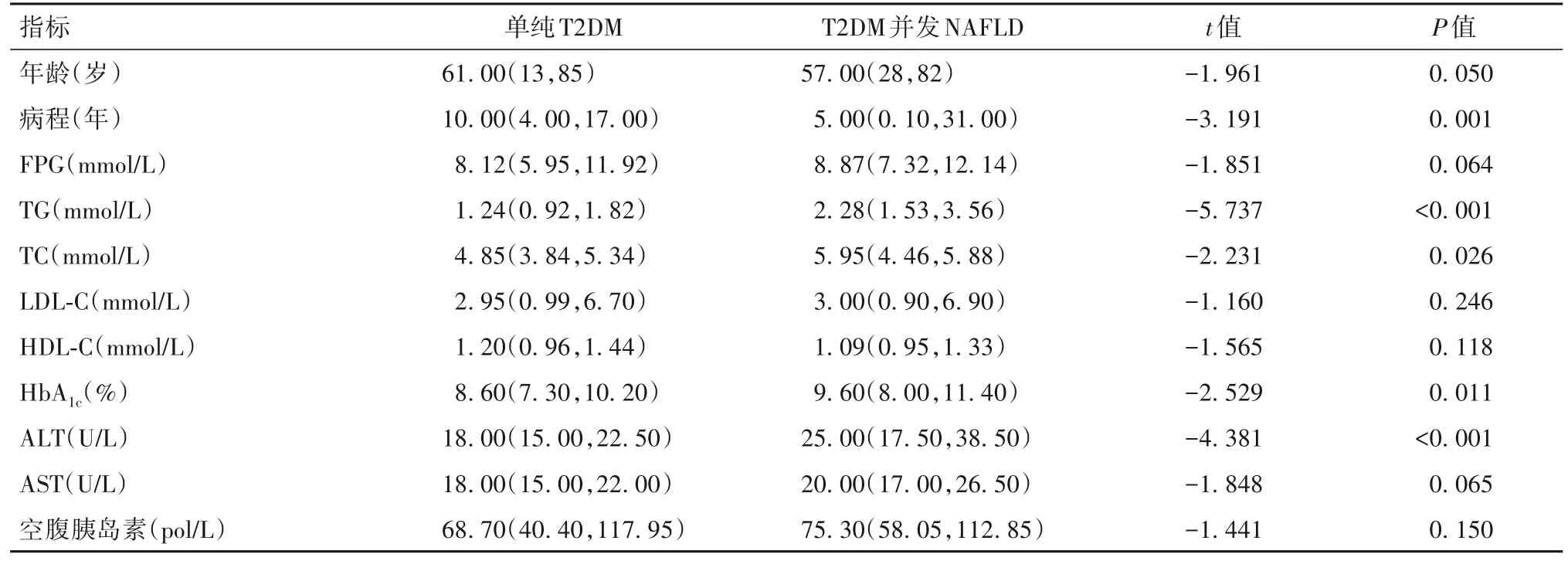
表1 有、无并发NAFLD的T2DM患者一般资料及实验室检查指标比较[中位数(四分位数)]

表2 有、无并发NAFLD的T2DM患者实验室检查指标比较(-x±s)
2.3 不同BMI、TG、TC、HbA1c水平分层的T2DM患者NAFLD发生率比较
2.3.1 按照BMI水平分层 根据全部患者的BMI水平四分位数分层,BMI≤23.43 kg/m2、BMI 23.44~25.63kg/m²、BMI25.64~27.74kg/m²、BMI>27.75 kg/m2的T2DM患者中,NAFLD的发生率分别为 23.8%(10/42)、34.9%(15/43)、53.7%(22/41)、85.4%(35/41),经χ²检验,差异有统计学意义(χ²=36.144,P<0.000 1)。
2.3.2 按照TG水平分层 根据高脂血症的诊断标准分层,在TG≤1.7 mmol/L、TG>1.7 mmol/L的T2DM患者中NAFLD的发生率分别为23.0%(23/84)、58.0%(58/83),经χ²检验,差异有统计学意义(χ²=30.188,P<0.000 1)。
2.3.3 按照TC水平分层 根据高脂血症诊断标准分层,在TC≤5.7 mmol/L、TC>5.7 mmol/L的T2DM患者中NAFLD的发生率分别为45.0%(58/129)、39.5%(15/38),经χ²检验,差异无统计学意义(χ²=0.359,P=0.549)。
2.3.4 按照HbA1c水平分层 根据全部患者的HbA1c水平中位数分层,HbA1c≤8.9% 和 HbA1c>9.0%的T2DM患者中NAFLD的发生率分别为40.0%(34/85)、57.3%(47/82),经χ²检验,差异有统计学意义(χ²=5.011,P<0.05)。
2.4 T2DM患者发生NAFLD的危险因素分析 二元logistic回归分析结果显示,FCP(OR=0.737,P=0.009)、BMI(OR=0.786,P=0.003)、HbA1c(OR=0.996,P<0.001)是导致T2DM患者发生NAFLD的独立危险因素。见表3。

表3 T2DM患者发生NAFLD的危险因素分析
3 讨论
随着快餐食品的泛滥和生活节奏的加快,T2DM的发病率逐年增加,各种并发症的出现可影响T2DM患者的生活质量与生存时间。除最常见的急、慢性并发症外,NAFLD在T2DM患者中的发病率越来越高,据报道,NAFLD在健康人群中的患病率约25%,而在肥胖和T2DM人群中的发病率高达70%~80%[1]。由于早期脂肪肝是可逆性肝损伤,及早发现并积极治疗可预防其持续进展。
T2DM与NAFLD之间存在复杂的病理、生理联系。一方面,T2DM患者体内长期血糖水平升高会引起肝细胞对血糖的代谢增强,影响了体内的脂质代谢,使脂肪非正常蓄积于肝细胞内,影响肝细胞正常代谢、增殖,导致肝功能异常[6-8]。同时,NAFLD患者体内生长激素、糖皮质激素、胰高血糖素等分泌紊乱,也会引起循环内血糖升高,促进了T2DM的形成[9]。本研究结果发现,T2DM并发NAFLD患者的HbA1c、TG、TC均明显高于单纯T2DM患者,这使高血糖与肝细胞损害通过作用于胰岛β细胞形成恶性循环,使两者的发生、发展相互影响。实验表明,高糖状态及时纠正后,可以改善其对胰岛β细胞的抑制作用[10]。因此,在临床治疗上对于此类患者在进行降糖、保肝治疗同时,尽早使用胰岛素短期强化治疗降血糖,减轻持续高糖对胰岛β细胞的损害,打破恶性循环,也尽可能恢复胰岛细胞的残存功能。
本研究发现,T2DM并发NAFLD患者的糖尿病病程小于单纯T2DM患者,此结论与杨晶晶等[11]的T2DM合并NAFLD患者较单纯糖尿病患者病程更短的结论相符。这表明对于T2DM的早期患者更易出现NAFLD,可能是因为肝脏在短时间内无法处理高糖血症引起的脂质代谢紊乱,从而造成脂肪蓄积于肝细胞内,还可能与T2DM患者后期治疗过程中使用降脂、保肝治疗使脂肪肝现象逆转有关。因此,在临床诊疗过程中,对于确诊T2DM的早期患者更应该及早明确有无合并NAFLD,并进行积极干预,预防NAFLD进一步进展,防止造成不可逆损伤。
本研究中,对BMI水平进行分层分析后发现,与 BMI<23.43 kg/m²的 T2DM 患者相比较,BMI>23.43 kg/m²的T2DM患者并发NAFLD的发病率明显升高,考虑与肥胖患者体内脂肪细胞因子分泌游离脂肪酸、瘦素等物质导致抑制因子-1及脂联素调节紊乱,引起脂肪储存、消耗障碍[12]有关。且在logistic回归分析中发现,BMI是并发NAFLD的独立危险因素。并有研究表明,BMI联合腰围可以预测NFALD的发生[13]。因此,在诊疗过程中,要重视BMI对疾病发展带来的影响,并积极通过饮食、运动减低体质量。在对TG水平进行分层分析后发现,高脂血症的T2DM患者更易出现NAFLD。考虑出现这种现象的原因为,体内肝脏可将体内葡萄糖以肝糖原、肌糖原的形式储存,过多的糖会转化为脂肪以及加速磷酸戊糖循环维持体内血糖的稳定。对于T2DM患者而言,本身存在胰岛β细胞功能减弱,分泌的胰岛素不能代偿性降低体内升高的血糖,长期的高糖血症会导致肝细胞对糖的代谢增强,引起体内脂质代谢紊乱,使过量脂肪非正常蓄积于肝细胞内。尤其是存在高脂血症的T2DM患者,加速了脂肪在肝细胞内的蓄积,加快脂肪肝的形成,严重时可以影响肝细胞代谢、增殖,加速肝细胞的损伤。
临床上常用HbA1c表示近2~3个月内的平均血糖水平,HbA1c升高意味着近期血糖控制欠佳。本研究发现,HbA1c>8.9%的T2DM患者更易并发NAFLD,且是NAFLD发病的独立危险因素。除了上述高糖血症影响肝细胞代谢的原因外,还与血糖长期得不到控制、影响胰岛β细胞功能有关。体内持续高浓度血糖会对胰岛β细胞产生的“糖毒性”,降低胰岛β细胞的生产效率,严重时可使之减少70%[6]。继而升高的血糖进一步通过影响脂质代谢造成脂肪肝。因此,在临床诊疗中,应对血脂、BMI异常的T2DM患者加大脂肪肝的筛查力度,注意监测其BMI,必要时建议谨慎选用二甲双胍、西布曲明、奥利司他等药物进行二级干预,通过控制体质量、减少腰围的方式降低其发病风险[14]。
本研究通过二元logistic回归分析后发现,除了BMI、HbA1c对NAFLD的发生存在影响外,FCP也是其独立危险因素。FCP与胰岛素等摩尔量分泌,可用来表示胰岛β细胞的功能。当T2DM患者并发NAFLD时,患者体内代偿性分泌过量胰岛素,来降低肝脏糖代谢异常导致的血糖升高。当体内胰岛素浓度升高时可抑制线粒体-β氧化,增强肝脏合成TG的能力,也会增加体内的脂肪分解,使大量游离脂肪酸储存在肝细胞内[15]。同时,脂蛋白脂肪酶活性降低减弱了对TG的清除率[16],随着糖尿病病程的进展,脂肪将大量储存于肝细胞内导致脂肪肝,严重时表现为肝功能异常,临床中多表现为ALT升高。
综上所述,T2DM与NAFLD的发病机制可以相互影响,两者互为危险因素可导致病情持续进展。由于T2DM合并NAFLD患者出现视网膜病变、慢性肾病的概率高于单纯T2DM者[17],还会增加脑血管病及周围神经病变的发生[18]。因此,我们应该注重对此疾病的防控与治疗,对于T2DM早期的患者严格监测血糖、血脂、BMI水平。对于已经并发NAFLD的T2DM患者要通过改变生活方式和减重治疗NAFLD[19],避免NAFLD带来的其他并发症,改善患者预后,提高患者生存率。
