PGF2α和PGD2对体外绵羊卵巢颗粒黄体化细胞溶解及相关基因差异表达的影响
2021-05-13邵焱焱杨恒牟健朱梦婷南颖任玉军赵宗胜
邵焱焱,杨恒,牟健,朱梦婷,3,南颖,任玉军,赵宗胜*
(1 石河子大学动物科技学院,新疆 石河子 832000;2 西南大学动物医学院,重庆 荣昌 402460;3 省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院,新疆 石河子 832000)
黄体(Corpora lutea,CL)在哺乳动物中属于暂时性内分泌腺,是建立和维持妊娠的必需内分泌器官[1]。正常繁殖周期内,如果卵子受精,CL将分泌孕酮等来参与调节受精卵着床和妊娠的早期维持。如果卵子未受精或妊娠末期(或分娩后),CL将会正常溶解成为启动下一个生殖周期的前提。因此,CL的溶解在哺乳动物的生殖周期中起着重要的“关卡”作用[2],对于重启母畜的生殖周期至关重要。
目前,关于黄体溶解涉及的一个经典学说就是前列腺素F2α(ProstaglandinF2α,PGF2α)诱发黄体退化。有研究表明[3],绵羊黄体正常溶解开始在生殖周期第14、第15天或第17天才完全溶解,而添加PGF2α可以2天内快速使黄体溶解,其类似物广泛用于同期发情技术[4]。与PGF2α相比,前列腺素D2(Prostaglandins D2,PGD2)在繁殖方面具有相关调控作用却未引起人们足够的重视。
近年来,有研究[5]发现PGD2能够增加卵巢颗粒细胞的活力,并通过其关键合成酶HPGDS影响PGD2的合成靶向卵巢组织。同时,SCHRAMM[6](1984)研究显示,将不同的PGs注入子宫腔时,发现PGD2是促进子宫内膜和子宫肌血流量增加最有效的PGs,并且在黄体期后期PGD2呈现上升趋势,这提示在黄体退化过程中,PGD2很可能会通过调节血管舒张、增加子宫流入卵巢黄体组织的血流量,以促使PGs向卵巢-黄体组织的转运,包括PGD2及主效溶黄体素PGF2α[7]。
基于PGs可能在母畜繁殖中的重要作用,本研究以体外培养的绵羊卵泡颗粒黄体化细胞为基础,利用qRT-PCR和ELISA技术分别检测了不同组别中P4浓度及黄体消融关键基因(StAR、3β-HSD、PGFS、FP、HPGDS、DP)mRNA的表达量变化水平,为深入挖掘和探析哺乳动物黄体溶解调控机制奠定了坚实基础。
1 材料与方法
1.1 材料与试剂
哈萨克母羊来自新疆石河子屠宰场;20 ×PBS(生化Sangon Biotench公司);胎牛血清(FBS,gibco公司);DMEM-F12培养液(gibco公司);胰蛋白酶(GIBCO公司);双抗(青霉素和链霉素,北京博奥托大科技有限公司);LH(宁波三生生物科技有限公司);FSH(宁波三生生物科技有限公司);E2(Sigma公司);PGD2(Cayman Chemical公司);PGF2α(MACKLIN公司);绵羊孕酮(P4)酶联免疫分析试剂盒(晶美公司);总RNA提取试剂盒(TIANGEN公司);反转录试剂盒(CWBIO公司);TaKaRa试剂盒(TIANGEN公司)。
1.2 试验方法
1.2.1 绵羊卵巢颗粒细胞原代培养和传代培养
在新疆石河子屠宰场采集无繁殖疾病、健康的哈萨克成年母羊优质卵巢,将卵巢周围组织清理完毕,用含双抗的1%PBS清洗干净,在超净台用1 mL的注射器吸取卵泡液,放在含有完全培养液(85%DMEM-F12+15%FBS+1%双坑)的培养皿中混匀,用100目筛过滤,1 000 r·min-1离心5 min,弃除上清,加入新的完全培养液,吹打混匀,接种到培养皿中,放置在37 ℃,5% CO2培养箱中培养,24 h观察贴壁情况,待颗粒细胞达到80% ~ 90% 进行细胞传代培养。首先将完全培养基倒掉,加入1% PBS进行清洗,加入2 mL胰消化酶进行消化5 min,待细胞变圆后加入2 mL完全培养液终止消化,用移液枪将细胞吹打下来,放在离心管中 1 000 r·min-1离心5 min,弃除上清,加入新的完全培养液,吹打混匀,接种到培养皿中,放置在37 ℃,5% CO2培养箱中培养。
1.2.2 绵羊卵巢颗粒细胞黄体化处理
待颗粒细胞传代培养达到80%~90%,用无血清的DMEM-F12培养液饥饿处理12 h,再分别添加不同浓度的E2、FSH和LH。将试验分成4组;第一组添加1 μg·mL-1E2、3 μg·mL-1FSH、10 μg·mL-1LH(E2(1 μg·mL-1)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组);第二组添加2 μg·mL-1E2、3 μg·mL-1FSH、10 μg·mL-1LH(E2(2 μg·mL-1)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组);第三组添加1 μg·mL-1E2、6 μg·mL-1FSH、15 μg·mL-1LH(E2(1 μg·mL-1)/FSH(6 μg·mL-1)/LH(15 μg·mL-1)组);第四组无任何添加(颗粒细胞组);分别收集4个组12、24、36、48、72 h的细胞液。使用ELISA检测P4浓度,筛选出使颗粒细胞黄体化的最佳激素浓度及时间。
1.2.3 绵羊卵巢颗粒黄体化细胞添加PGD2、PGF2α处理
在颗粒细胞黄体化效果最佳的基础上,将试验分成四组,一组添加2 μg·mL-1PGF2α(PGF2α组),二组添加2 μg·mL-1PGD2(PGD2组),3组添加2 μg·mL-1PGD2和2 μg·mL-1PGF2α(PGD2+PGF2α组),四组为无任何添加的颗粒黄体化细胞(对照组),依据前期课题组实践,添加到颗粒黄体化细胞中选择最适宜的2 μg·mL-1添加剂量。分别收集各组6、12、24、36、48、72 h的细胞液,使用ELISA检测P4浓度。
1.2.4 实时荧光定量(qRT-PCR)验证
分别提取对照组、PGD2组、PGF2α组、PGD2+PGF2α组第24 h(添加PGD2、PGF2α、PGD2+PGF2α为第0 h)的总RNA,使用Nanodrop检测RNA 的纯度及浓度合格后,将总RNA反转录成cDNA,保存于-20 ℃。qRT-PCR检测的6个引物,由北京睿博兴科生物技术有限公司合成(表1)。

表1 扩增引物信息详情
最后进行qRT-PCR检测StAR,3β-HSD,PGFS,FP,HPGDS和DP基因在mRNA水平的表达。qRT-PCR反应为加入10 μL TB Green Premix Ex Taq II(Tli RNaseH Plus)(2×),0.8 μL的下上引物,0.4 μL ROX Reference Dye(50×),2 μL cDNA模板,6 μL ddH2O。将PCR条件设置为标准的两步扩增程序,即在95 ℃下预变性30 s,然后进行PCR反应,然后在95 ℃下进行40个循环5 s,在60 ℃下进行30~34 s。
1.2.5 统计分析
采用直线回归方程和2-ΔΔct法进行数据分析,数据差异显著性用SPSS 19.0 进行统计学分析,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2 结果
2.1 绵羊卵巢颗粒细胞黄体化结果及添加PGF2α和PGD2的结果
经E2、FSH、LH处理后的颗粒细胞发生变化,结果显示:在细胞形态上,绵羊的卵巢颗粒细胞大多数呈梭形,而颗粒黄体化细胞大多呈不规则三角形。在P4浓度水平上,相比颗粒细胞组,E2(1 μg·mL-1)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组和E2(2 μg/mL)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组在12、24、36、48、72 h 5个时间段变化不显著(P>0.05);E2(1 μg·mL-1)/FSH(6 μg·mL-1)/LH(15 μg·mL-1)组在12、36、48、72 h 变化不显著(P>0.05),但是在第24 h,E2(1 μg·mL-1)/FSH(6 μg·mL-1)/LH(15 μg·mL-1)组达到峰值,极显著高于颗粒细胞组、E2(1 μg·mL-1)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组和E2(2 μg·mL-1)/FSH(3 μg·mL-1)/LH(10 μg·mL-1)组(P<0.01)(图1)。结果表明:添加1 μg·mL-1E2、6 μg·mL-1FSH、15 μg·mL-1LH到颗粒细胞中,达到最佳黄体化效果,同时在其处理24 h时颗粒黄体化细胞合成分泌P4能力达到峰值,为后续试验的顺利进行提供保障。
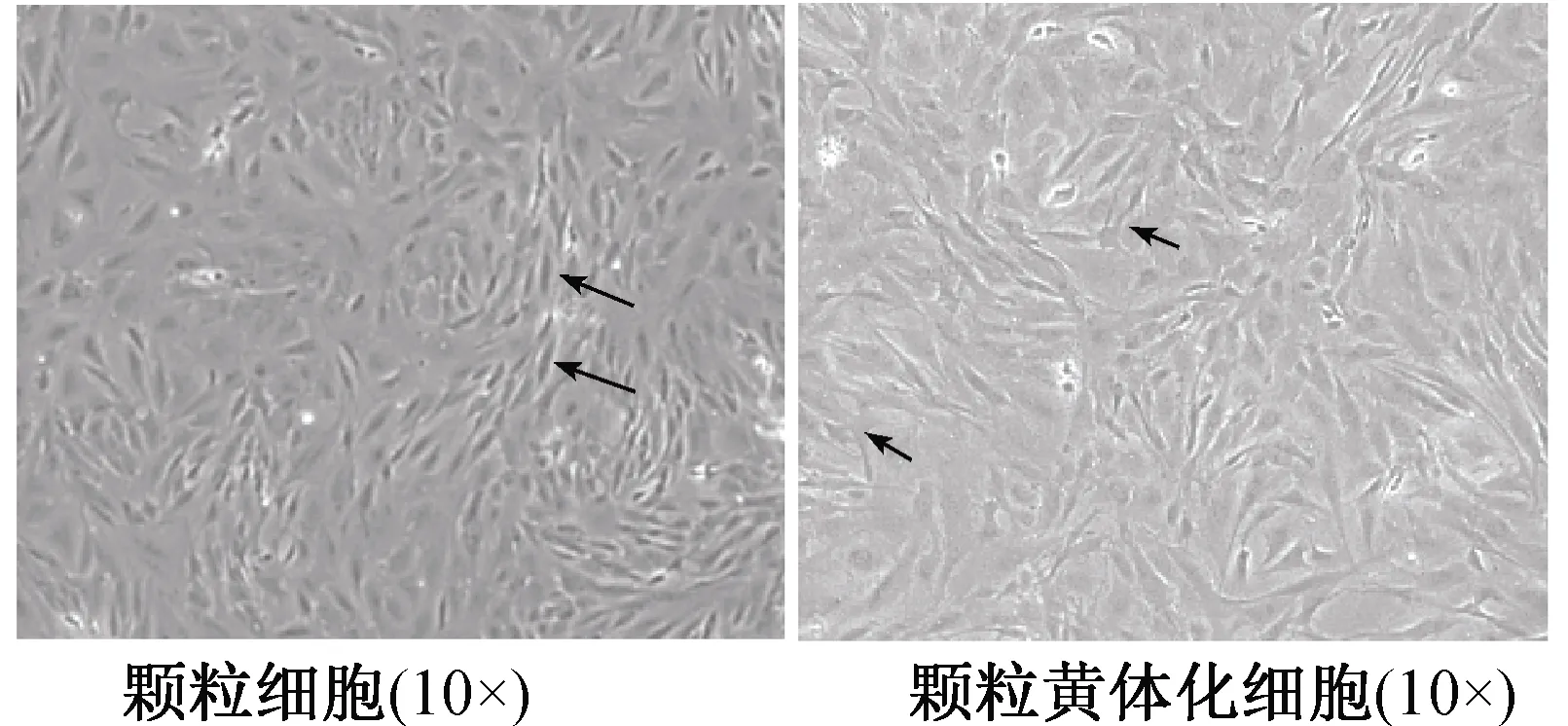
图1 E2/FSH/LH对颗粒细胞的影响
在颗粒细胞最佳黄体化效果的基础上,无任何添加的颗粒黄体化细胞为对照组,添加PGF2α、PGD2、PGD2+PGF2α为试验组,每组3个重复。结果显示:在细胞形态上,颗粒黄体化细胞呈梭形或不规则状;PGD2作用24 h的颗粒黄体化细胞形态发生改变,部分细胞出现轮廓模糊,萎缩凋亡;PGF2α作用24 h的颗粒黄体化细胞形态结构发生改变,轮廓模糊,呈现圆形或块状结构,呈现凋亡细胞的现象;PGD2+PGF2α作用24 h的颗粒黄体化细胞已观察不到完整的结构,轮廓模糊不清,呈现明显凋亡和死亡现象。
在P4浓度水平上,在6、12、24、36、48、72 h 6个时间段,对照组、PGF2α组、PGD2组、PGD2+PGF2α组呈先上升后下降的趋势;6 h、12 h、36 h、48 h、72 h时间段,对照组均高于PGF2α组、PGD2组、PGD2+PGF2α组,PGD2组均高于PGF2α组、PGD2+PGF2α组,PGF2α组高于PGD2+PGF2α组,但差异均不显著(P>0.05),在24 h,对照组显著高于PGF2α组、PGD2组、PGD2+PGF2α组(P<0.01)(图2)。结果说明PGD2、PGF2α、PGD2+PGF2α均溶解颗粒黄体化细胞,24 h的时候最佳,PGF2α溶解颗粒黄体化细胞效果高于PGD2,PGD2与PGF2α的共同作用效果更佳。
2.2 qRT-PCR检测
StAR和3β-HSD是哺乳动物黄体形成、维持和退化的重要标志性基因,可区别于颗粒细胞是否黄体化以及黄体溶解情况,结果显示:相比于对照组,颗粒细胞组的StAR、3β-HSD表达量极显著降低(P<0.01);PGD2组和PGF2α组的StAR、3β-HSD表达量显著降低(P<0.05),PGD2+PGF2α组的StAR、3β-HSD表达量极显著降低(P<0.01)(图3)。结果证实颗粒细胞基本黄体化,PGF2α和PGD2均能够促进体外卵巢颗粒黄体化细胞溶解,PGF2α和PGD2共同作用时,则在促溶黄体效应中呈现出显著地协同效应。
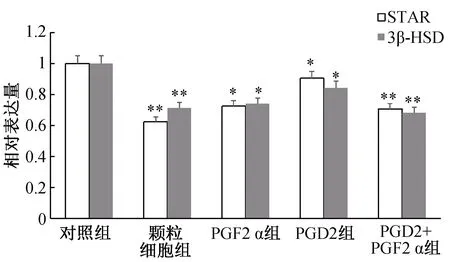
图3 StAR、3β-HSD在不同组别表达量
PGFS和FP分别是PGF2α合成的关键合成酶及其发挥生物学效应的结合受体。结果显示:相比于对照组,PGF2α组中的PGFS无明显变化,PGD2组、PGD2+PGF2α组中的PGFS呈现极显著上升变化(P<0.01);PGD2组中的FP呈现显著上升变化(P<0.05),PGF2α组、PGD2+PGF2α组中的FP呈现极显著上升变化(P<0.01)(图4)。结果表明,添加PGF2α,可能抑制合成酶PGFS的生成,增加受体FP的生成,PGD2可能促进PGF2α合成酶PGFS的生成。
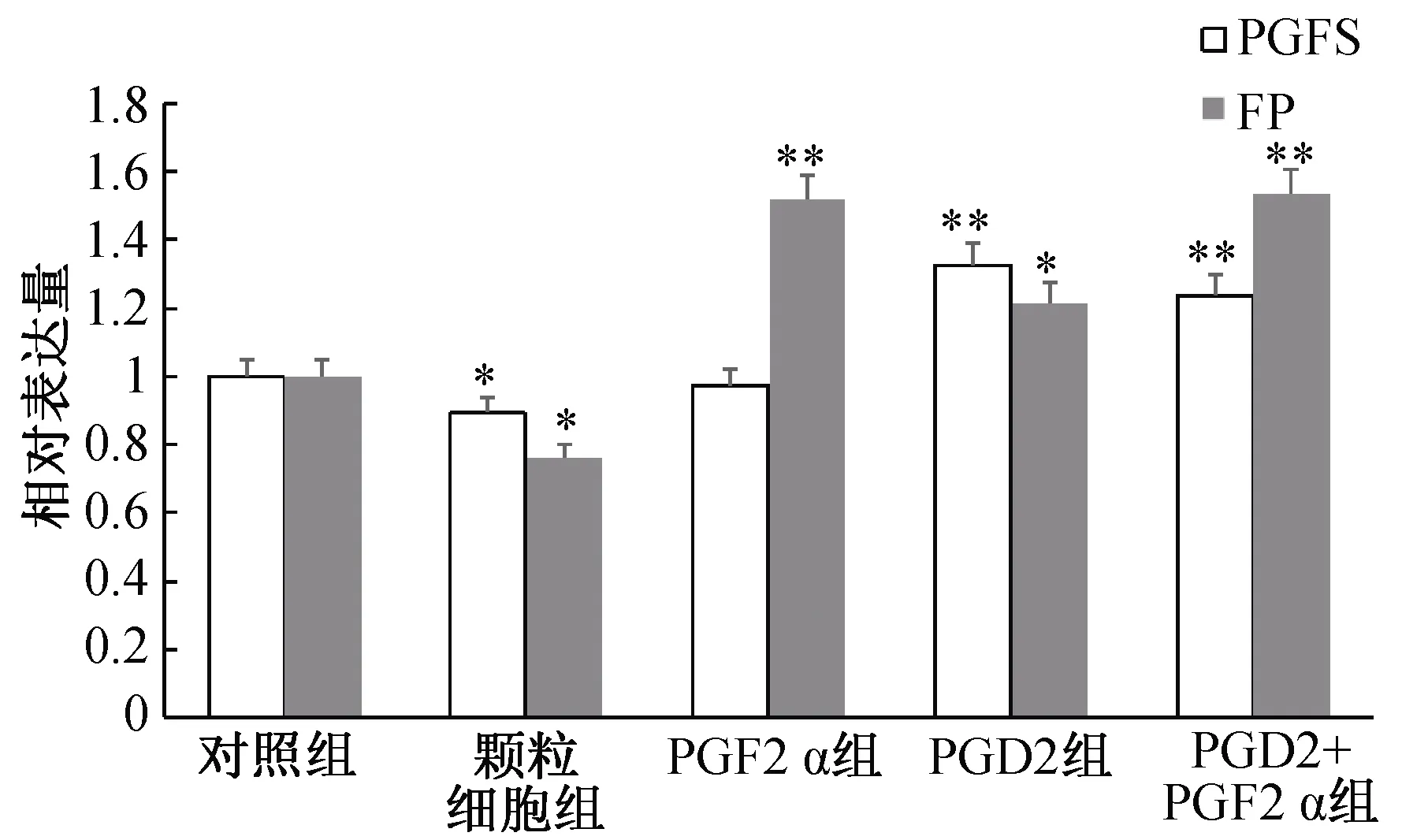
图4 PGFS、FP在不同组别表达量
HPGDS与DP分别是PGD2合成的关键合成酶及其发挥生物学效应的结合受体。结果显示:相比于对照组,PGD2+PGF2α组中的HPGDS呈现显著上升变化(P<0.05),PGF2α组、PGD2组中的HPGDS呈现极显著上升变化(P<0.01);PGF2α组、PGD2组、PGD2+PGF2α组中的DP呈现极显著上升变化(P<0.01)(图5)。结果表明,添加PGD2,可能抑制合成酶HPGDS的生成,增加受体DP的生成,PGF2α可能促进PGD2合成酶生成。
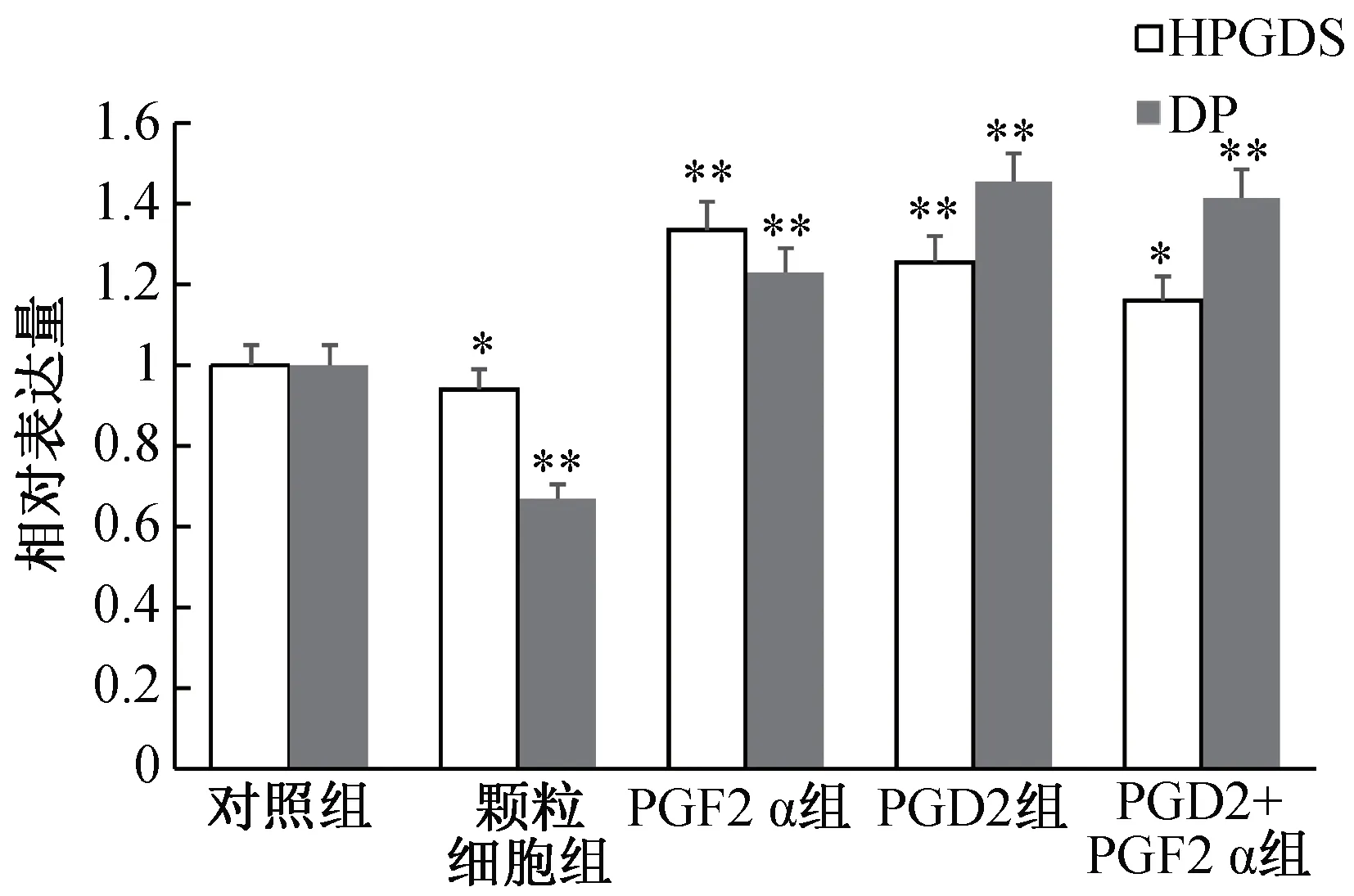
图5 HPGDS、DP在不同组别表达量
3 讨论
3.1 绵羊卵巢颗粒细胞黄体化结果
黄体是雌性动物体内重要的临时器官,不仅调控发情周期长短,也对妊娠维持有着重要作用,是解决雌性动物繁殖问题的关键。然而,家畜体内进行黄体研究存在时间以及技术方面的局限性和难度,且仅仅在黄体细胞进行研究很难真实模拟体内颗粒细胞向黄体细胞发育所形成的一种内分泌调控机制。颗粒细胞黄体化则在形态还是在功能上都类似于卵巢黄体细胞,还可以兼顾发情周期中卵泡向黄体发育的一个过程,对黄体溶解的研究有积极的作用。本试验通过体外建立这种颗粒黄体化细胞体系,真实的模拟了颗粒细胞向黄体细胞转化的过程。菅瑞珍研究证实,绵羊卵巢颗粒细胞添加1 μg·mL-1E2、2.5IU·mL-1FSH、2.5IU·mL-1LH在第24小时有显著促进孕酮分泌的作用,使颗粒细胞成功黄体化[8],这也与本试验通过梯度筛选出绵羊卵巢颗粒细胞黄体化最佳浓度为1 μg·mL-1E2、6 μg·mL-1FSH、15 μg·mL-1LH,并在处理后第24小时P4浓度达到峰值相符,说明拟黄体化成功。因此,颗粒细胞体外培养黄体化的成功不仅对黄体生成的分子机制的研究具有重要意义,也为后期在颗粒细胞拟黄体化基础上进行的试验的成功提供了保障。
3.2 PGF2α、PGD2对卵巢颗粒黄体化细胞溶解及相关基因差异表达的影响
PGF2α是启动黄体溶解的关键因素[9]。本试验在PGF2α在黄体溶解已有的研究基础上,探讨前列腺素家族的另一位成员PGD2可能对黄体的作用以及和PGF2α在黄体溶解中的互作[10]。黄体主要的功能是分泌P4,当P4分泌到一定量,对下丘脑、垂体产生负反馈作用,抑制FSH的生成和卵泡发育,动物不再发情[11]。因此,P4是颗粒细胞黄体化的重要标志,通过检测P4的含量,可以大体推测出颗粒细胞黄体化程度以及溶解程度。本试验结果显示,在黄体化的基础上,添加PGF2α、PGD2、PGD2+PGF2α的组在第24 h P4浓度极显著降低,说明PGF2α、PGD2、PGD2+PGF2α均溶解黄体,溶解效果PGD2+PGF2α明显高于PGF2α,PGF2α明显高于PGD2,从细胞外部形态也可以证实这一点。目前,由颗粒细胞向黄体化转变的中间阶段相关研究鲜有报道,因此本试验检测显示在24 h PGF2α、PGD2、PGD2+PGF2α溶解效果达到最佳其结果有待进一步考证。图1和图2 P4浓度出现了差异,这可能由两方面造成的,一方面是由于本试验在摸索出颗粒细胞黄体化的最佳的条件的基础上,再次培养新的颗粒细胞在添加1 μg·mL-1E2、6 μg·mL-1FSH、15 μg·mL-1LH 24 h黄体化时添加不同前列腺素开始算时间,因此可能造成图1和图2 P4浓度差异;另一方面可能是由于检测激素浓度时使用的试剂盒是不同批次或两次操作过程中造成P4浓度差异。大量研究证实,StAR的出现与P4的合成在时空上有一致性,StAR和3β-HSD是黄体的功能指标之一[12]。同时,另有研究发现,使用PGF2α处理大鼠4小时后,血清P4浓度显著下降,3β-HSD蛋白及其mRNA水平下降50%~60%;8 h后,3β-HSD蛋白及其mRNA回到正常水平[13]。而在本试验中,PGD2组和PGF2α组的StAR、3β-HSD表达量显著降低(P<0.05),PGD2+PGF2α组的StAR、3β-HSD表达量极显著降低(P<0.01),表明PGF2α、PGD2和PGD2+PGF2α均能够使体外卵巢颗粒黄体化细胞溶解,PGF2α和PGD2协同效果更佳。PGFS和HPGDS分别是PGF2a和PGD2合成的关键性酶,而前列腺素只有通过与各自的受体结合才能发挥作用[14]。有研究报道,PGF2α可以激活分布在黄体中的FP导致黄体细胞凋亡、最终实现黄体溶解[15]。PGD2通过与DP相互作用引发其生物学作用[16]。本研究发现添加PGF2α不仅能够抑制合成酶PGFS的生成,还能增加受体FP的生成,PGD2则可以促进PGF2α合成酶生成;发现添加PGD2,不仅能够抑制合成酶HPGDS的生成,增加自身受体DP的生成,也能协助PGF2α更佳有效的溶解颗粒黄体化细胞。
总之,本试验验证了母畜的卵巢颗粒细胞黄体化过程不仅受主效溶黄体PGF2α的影响,同时PGs家族成员中PGD2也会单独参与或协同PGF2α共同影响卵巢颗粒细胞向黄体细胞转化的进程。
本试验在体外培养的绵羊卵巢颗粒细胞通过添加1 μg·mL-1E2、6 μg·mL-1FSH、15 μg·mL-1LH在24 h达到黄体化。在哺乳动物中,PGD2和PGF2α均参与了卵巢颗粒细胞向黄体细胞转化的调控过程;同时,PGD2和PGF2α之间可能存在协同效应,共同影响其颗粒细胞黄体化进程。这为深入探究和全面认识哺乳动物卵巢排卵向黄体的形成转化机制奠定了坚实基础。
