低碳氮比条件下外加铁源对生物脱氮性能与机理的研究
2021-05-12张浩鲍立宁黄显怀周赛赛
张浩, 鲍立宁,c, 黄显怀,c, 周赛赛
(安徽建筑大学a.环境与能源工程学院; b.水污染控制与废水资源化安徽省重点实验室; c.环境污染控制与废弃物资源化利用安徽省重点实验室, 合肥 230601)
目前, 我国传统污水处理厂为了应对低碳氮比 生活污水的处理问题, 需额外添加碳源才能使出水达到排放标准, 这使得运行成本增加, 产泥率增高, 且排放温室气体等造成环境二次污染[1-2]。 铁是微生物所需的重要微量元素之一[3], 适量的铁源能够促进微生物的电子传递(ETS)、 提高酶的活性、 改善污泥颗粒沉降性能, 进而有利于促进微生物脱氮, 外加铁源在低碳源情况下高效脱氮效果受到广泛关注。
目前, 外加铁源在Anammox、 硝化与反硝化、同步硝化反硝化等类型的反应中都有应用[4-6], 但运行条件大都苛刻, 难以在实际生产中发挥作用,有研究表明, 长期投加磁性(10 ~60 mg/L)Fe3O4纳米粒子可有效改善SBR 反应器活性污泥的反硝化作用, 同时高质量浓度(60 mg/L)磁性Fe3O4纳米粒子对微生物活性产生抑制作用[7], 铁促催化活性污泥系统比普通活性污泥系统的氨氮去除率提高5%[8]。 目前, 在城镇污水、 工业废水等研究中,均发现投加铁源的活性污泥系统对氨氮、 COD 等指标去除率均有不同程度的提高[9-10]。
为研究低碳氮比(以下称C/N)条件下外加铁源活性污泥系统对脱氮性能的影响, 通过调控进水氨氮浓度和C/N, 考察投加Fe2+对活性污泥脱氮性能以及酶活性的影响, 并对脱氮功能基因进行荧光实时定量聚合酶链式反应(qPCR)定量分析,研究各组分基因随着进水C/N 以及外加Fe2+的变化情况, 为低碳源水质条件下脱氮性能的提高提供理论支持。

表1 不同阶段下进水水质情况Tab. 1 Influent water quality of different stages
1 材料与方法
1.1 试验装置与运行工艺
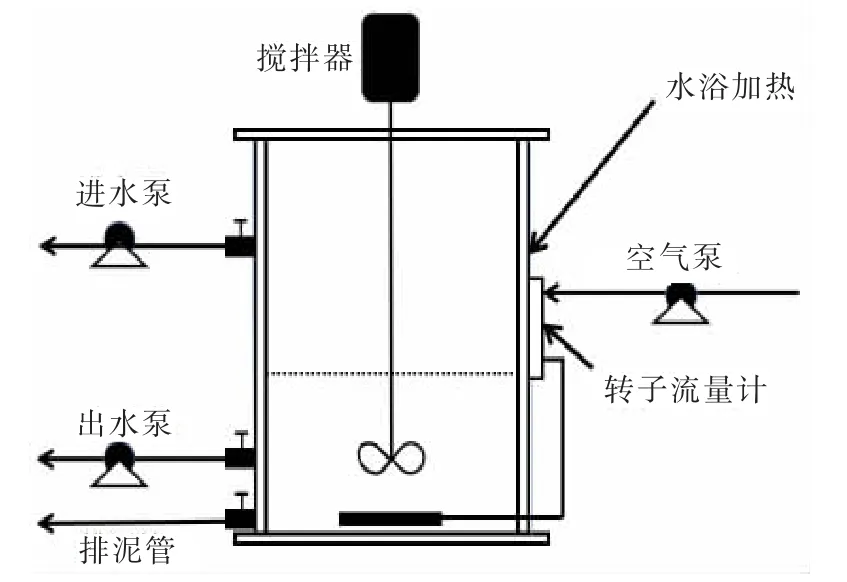
图1 试验装置示意Fig. 1 Experimental device
反应器为SBR 反应器, 装置示意如图1 所示。SBR 反应器由有机玻璃制成, 高40 cm, 内径为18 cm, 有效容积为4 L, 进水量为2 L, 排水比为50%,HRT 为9 h, 曝气量为45 L/h。 SBR 反应器采用A/O工艺, 每天运行4 个周期, 每个周期6 h, 运行方式为进水10 min, 厌氧搅拌90 min, 好氧曝气180 min, 沉淀40 min, 出水10 min, 静置40 min, 进水的同时进行厌氧搅拌, SRT 约为15 d。 试验设置2个平行运行的SBR 反应器, 其中A 反应器进水时投加2 mg/L Fe2+, B 反应器为不投加铁源的对照组。
1.2 接种污泥与试验用水
接种污泥取自合肥市经开区污水处理厂二沉池的回流污泥, 经闷曝后加入反应器。 接种后反应器MLSS 的质量浓度约为4 783 mg/L, SV 约为54%,SVI 为112.90 mL/g。
试验用水采用人工配水, 碳源为无水乙酸钠,氮源为氯化铵, 磷源由磷酸氢二钾、 磷酸二氢钾提供, 铁源为硫酸亚铁, 采用碳酸氢钠调节pH 值为7.0 ~8.5。 试验分为3 个阶段, 不同运行阶段反应器进水水质情况如表1 所示。
1.3 试验方法
试验废水由蠕动泵泵入反应器, 经过厌氧搅拌-好氧曝气-沉淀后出水, 每天对反应器出水进行水质检测, 考察外加铁源对各污染物去除效果的影响; 同时在曝气阶段定时取少量污泥混合液测定微生物的电子传递体系活性。 在3 个不同阶段取5 mg 活性污泥冷冻保存, 进行基因测定。
1.4 分析方法
(1) 常规分析方法。 COD、 氨氮、 NO3--N、NO2--N、 MLSS 测定方法参考《水和废水监测分析方法》[11]。 表征微生物活性的电子传递体系活性(TTCETS、 INT-ETS 活性)分别采用TTC 法与INT 法[12]。
(2) 荧光实时定量PCR 分析。 选取硝酸盐还原酶narG、 亚硝酸盐还原酶nirS(细胞色素还原酶)和nirK(可溶性含铜酶)、 一氧化二氮还原酶nosZ 基因进行定量分析, 各目的基因的引物序列见表2。 narG、 nirS、 nirK、 nosZ 基因的PCR 反应条件为: 95 ℃预变性5 min, 之后进行40 个循环, 每个循环包括95 ℃变性20 s, 55 ℃退火20 s, 72 ℃延伸40 s。 每个样品检测3 个复孔[13]。

表2 qPCR 引物序列Tab. 2 Primer sequences for qPCR
2 结果与讨论
2.1 外加铁源对COD 去除效果影响
反应器进出水COD 浓度如图2 所示。 阶段Ⅰ与阶段Ⅱ中A、 B 反应器出水COD 浓度基本相同,去除率均在90% 左右, 出水较为稳定; 阶段Ⅲ中A 反应器COD 去除率为92.10%, B 反应器COD 去除率为87.76%, 较投加Fe2+的A 反应器降低了4.34%; 进水氨氮负荷的变化对系统整体COD 去除性能的影响不大。
2.2 外加铁源对氨氮去除效果影响
反应器进出水氨氮浓度如图3 所示。 阶段Ⅰ中A、 B 反应器氨氮去除率均为100%, 反应器系统内硝化能力稳定在较高水平; 阶段Ⅱ中, 随着进水氨氮浓度的升高, C/N 降低, A、 B 反应器出水氨氮质量浓度分别提升至13.63、 12.94 mg/L, 去除率均稳定在80%左右, 去除率总体有所下降, 分析其原因主要是氨氮浓度的进一步增大, 导致硝化所需的碳源不足, 无法提供足够的电子供体[14]。 相比之下, 两者的氨氮去除效果基本没有较大变化。
阶段Ⅲ中A、 B 反应器氨氮去除率分别为47.24%、 46.32%, 两者氨氮去除能力均出现急剧下降, 主要原因是碳源已严重不足, 同时硝化细菌对环境十分敏感, 进水中高浓度氨氮将产生大量的游离氨, 严重抑制反应器中氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)活性[15], 使得反应器出水氨氮浓度升高, 硝化效果进一步减弱。 A 反应器中Fe2+的投加量较小, 对硝化菌促进作用微弱[16], 其原因有待进一步研究。
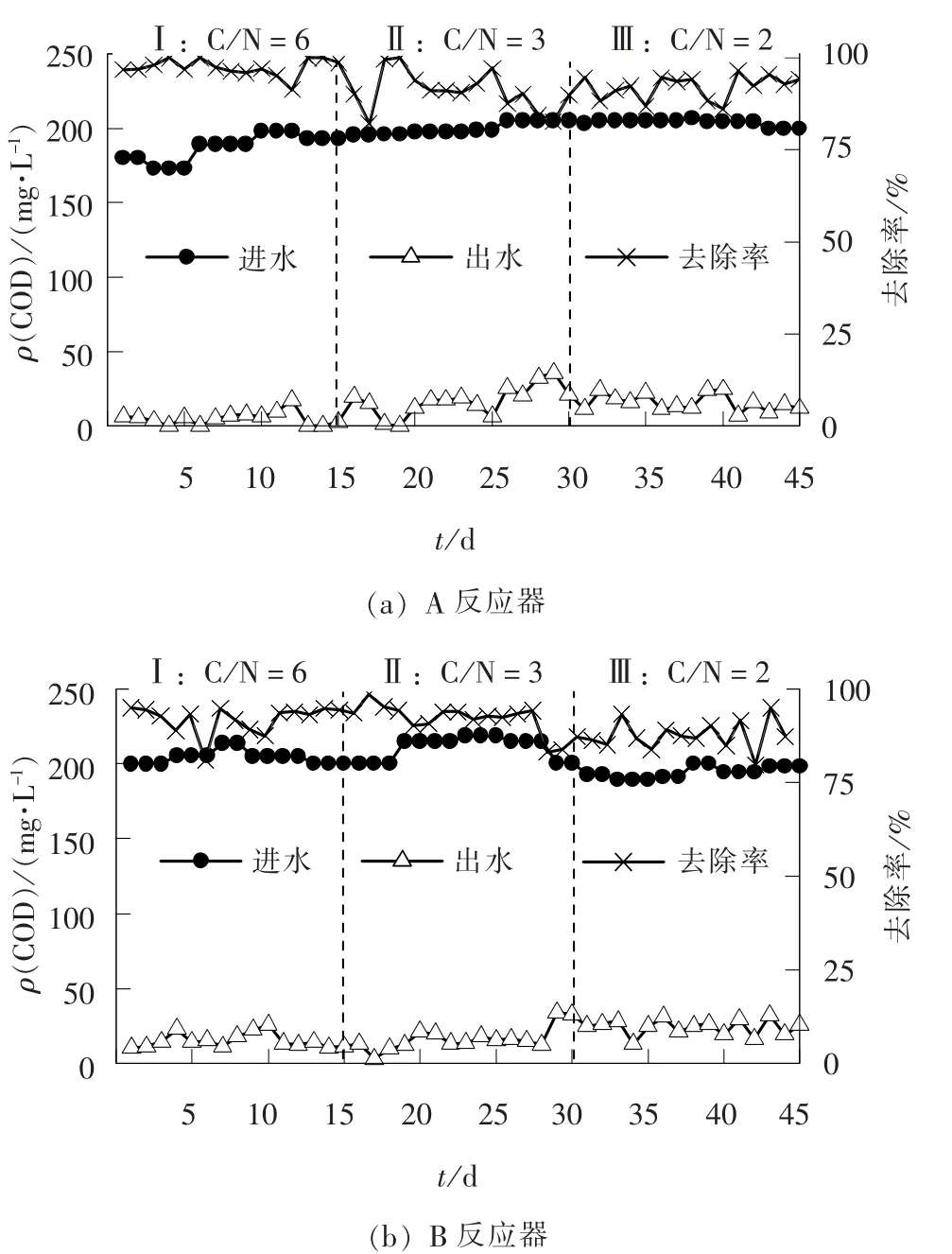
图2 不同C/N 条件下反应器进出水COD 浓度Fig. 2 COD concentrations of two reactors under different C/N conditions
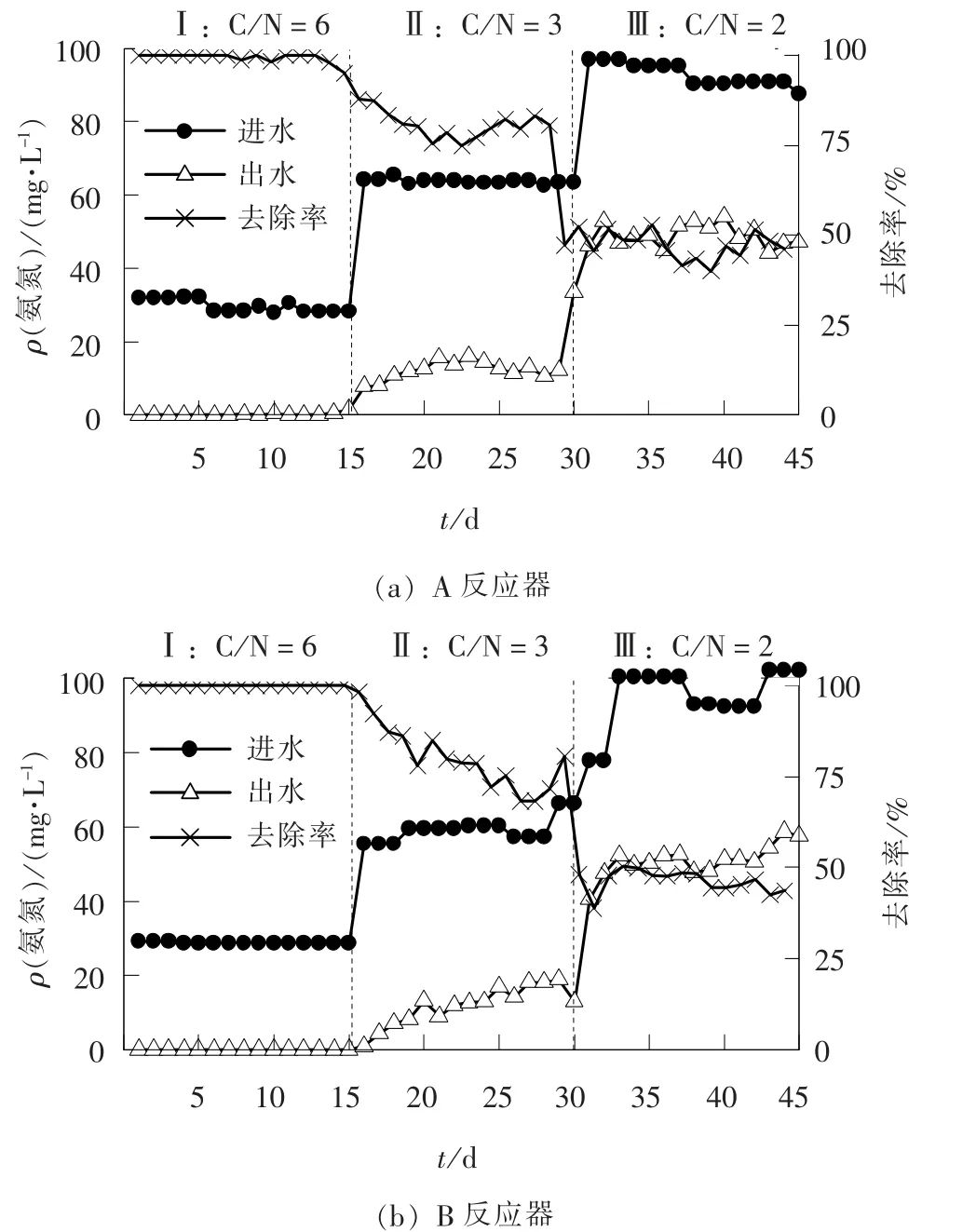
图3 不同C/N 条件下反应器进出水氨氮浓度Fig. 3 Ammonia nitrogen concentrations of two reactors under different C/N conditions
2.3 外加铁源对TN 去除效果影响
反应器进出水TN 浓度如图4 所示。 在阶段Ⅰ中A、 B 反应器TN 去除率分别为89.57%、 86.84%,同时两者出水TN 质量浓度均低于5 mg/L; 因此说明系统内微生物菌群已具有良好的脱氮性能; 阶段Ⅱ中, 随着进水氨氮浓度的升高, 系统反硝化能力受到影响, TN 去除率有明显下降, A、 B 反应器TN 去除率分别为58%、 47.69%, A 反应器的TN去除率较高; Fe2+既作为能量代谢与细胞合成的重要载体, 同时也作为潜在的电子供体[17], A 反应器中Fe2+的投加促进反硝化反应, 使得TN 的去除效果进一步提升。
阶段Ⅲ中随着C/N 的进一步降低, 以及进水氨氮浓度的升高, 系统反硝化能力达到饱和, A 反应器TN 去除率降至36.27%, B 反应器TN 去除率降至29.46%。 A 反应器TN 去除率依旧高于B 反应器, 但效果不太明显, 推测高浓度氨氮对微生物的抑制效果远远高于Fe2+促进效果; 此外, A 反应器出水NO3--N 浓度始终低于B 反应器, 同时A、B 反应器出水NO2--N 浓度在低C/N 时始终为0,并没有亚硝酸盐积累。

图4 不同C/N 条件下反应器对TN 的去除效果Fig. 4 TN removal of two reactors under different C/N conditions
2.4 外加铁源对ETS 活性的影响
活性污泥的电子传递体系(ETS)是微生物呼吸链上电子的传递速率, 其实质是通过测定微生物的呼吸活性, 进而定量分析活性污泥的活性, 其中TTC-ETS、 INT-ETS 能有效揭示出有机物氧化与自养型硝化菌活性[12]。 铁离子介入微生物生化反应与能量代谢, 用作脱氢酶的电子传递链和辅基中的电子受体[18], 因此, 铁离子对活性污泥活性有着重要作用。
反应器ETS 活性效果如图5 所示, 阶段Ⅰ中A 反应器0 ~9 d 期间TTC-ETS 较低, 维持在9.61 mg[TF]/(g[TSS]·h), 第10 ~15 天 开 始 稳 定 在19.87 mg[TF]/(g[TSS]·h); 而B 反应器TTC-ETS一直在14.50 mg[TF]/(g[TSS]·h)左右, B 反应器平均TTC-ETS 活性略低于A 反应器, 这说明A 反应器前期ETS 活性较低, 持续投加Fe2+对ETS 活性起促进作用。 阶段Ⅱ中, A、 B 反应器TTC-ETS活性分别为19.37、 12.80 mg[TF]/(g[TSS]·h), B反应器的TTC-ETS 活性始终低于A 反应器。

图5 不同C/N 条件下反应器ETS 活性变化Fig. 5 Changes of ETS activity in two reactors under different C/N conditions
阶段Ⅲ中, A、 B 反应器的TTC-ETS 基本处于稳定状态, 分别为20.56、 14.10 mg[TF]/(g[TSS]·h), A 反应器的TTC-ETS 活性依旧比B 反应器高。
由图5 还可以看出, A 反应器内INT-ETS 持续升高, 最终维持在80.39 mg[INTF]/(g[TSS]·h),B 反应器内基本维持在57.89 mg[INTF]/(g[TSS]·h)。 阶段Ⅲ中A 反应器内INT-ETS 活性整体高于B 反应器30% 以上。 B 反应器微生物随着进水水质的变化, 产生局部波动与变化, 而A 反应器系统受到冲击后, 起伏较小, 然后稳定上升。 从总体上来看, 外加Fe2+的活性污泥微生物电子传递体系强于未加Fe2+的活性污泥电子传递体系。
2.5 外加铁源对脱氮功能基因的分析
根据荧光实时定量PCR 测定各阶段底泥中的基因拷贝数, 结果如图6 所示。
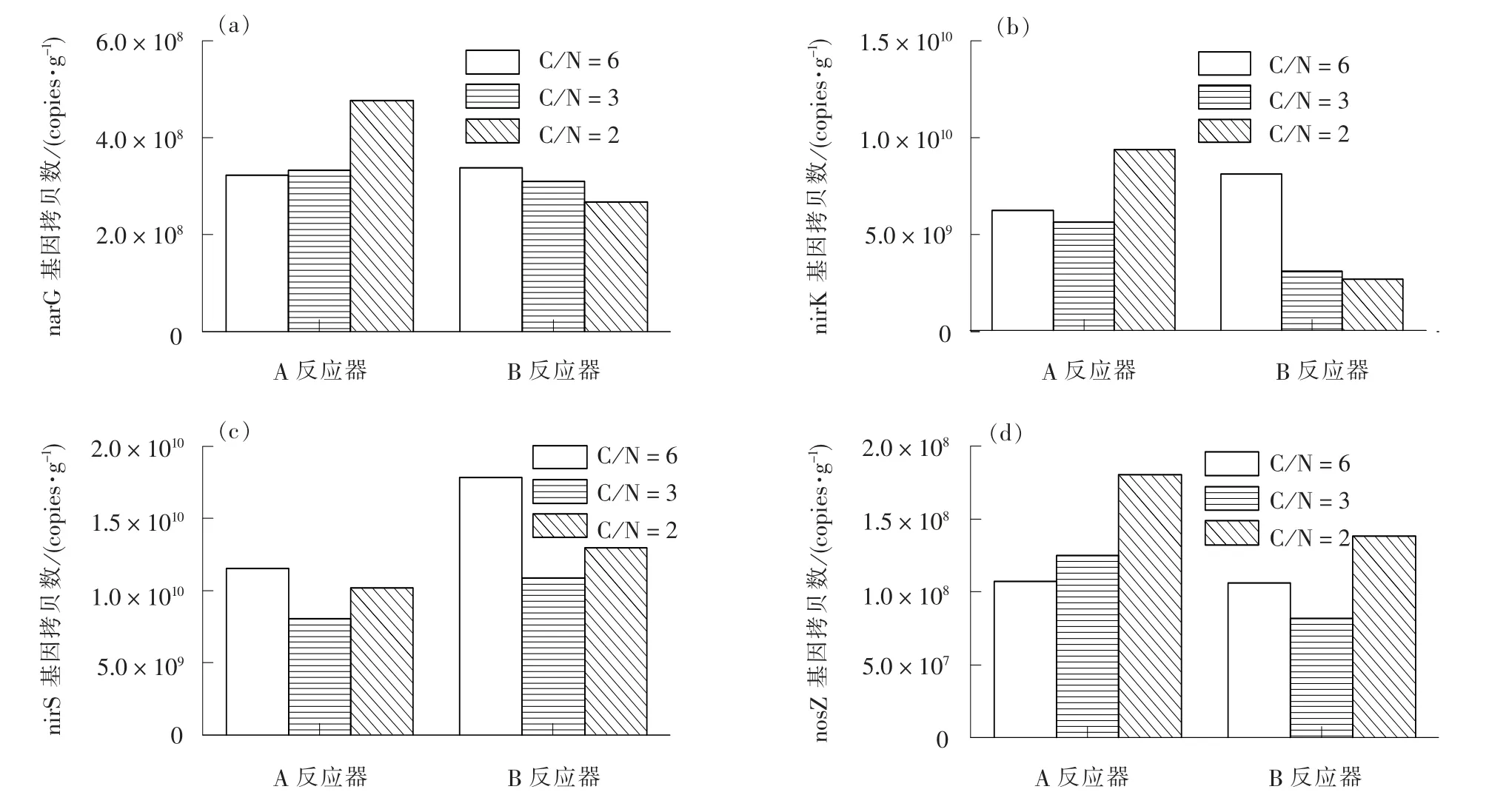
图6 3 个阶段底泥中各基因拷贝数Fig. 6 Copy numbers of genes in substrate sludge of three stages
随着C/N 的减小, A 反应器中的narG、 nirK、nosZ 基因拷贝数随着氨氮浓度的增大而增加, 外加铁源促进反硝化菌活性, 基因拷贝数也将随之增加; 相反, B 反应器中的基因拷贝数呈梯度下降,碳源不足无法提供充足的营养和电子供体, 导致反硝化菌生长缓慢; 此外当C/N 为3 时, A 反应器活性污泥中narG、 nirK、 nosZ 基因拷贝数分别为3.32×108、 5.71×109、 1.25×108copies/g, 除nirS基因外, 均高于B 反应器。
A、 B 反应器的nirS 基因拷贝数整体均比nirK基因拷贝数高, 即nirS 基因比nirK 基因更加丰富。此外NO2--N 的转化率很大程度与亚硝酸盐还原酶基因(nirS、 nirK)有关[19]; 而narG 基因与NO2--N的产生也有关, 因此可以利用narG/(nirK+nirS)表征亚硝酸盐的变化。 在C/N 分别为6、 3、 2 时,A 反应器中硝酸盐还原酶基因(narG)拷贝数分别为3.21×108、 3.32×108、 4.76×108copies/g, 亚硝酸盐还原酶基因(nirK+nirS)拷贝数分别为1.79×1010、1.38 × 1010、 1.97 × 1010copies/g, narG 比(nirK +nirS)基因拷贝数少, 是未造成亚硝酸盐积累的主要原因[20], B 反应器也是如此。
综上所述, 在低碳源条件下Fe2+的投加加强了微生物的代谢以及活性, 使得脱氮功能基因丰度增加, 促进了反硝化效果, 在碳源不足的情况下微生物更易适应, 从而提高TN 的去除率。
3 结论
(1) 在C/N 分别为6、 3、 2 时, A、 B 反应器COD的去除率基本保持在90% 左右; B 反应器在低C/N 条件下(C/N =2)出水COD 浓度有所波动,铁源的投加更有利于促进异养菌的呼吸与代谢活动, 使得COD 去除率更加稳定。
(2) 在C/N =3 的条件下, A、 B 反应器出水TN 质量浓度分别为26.51、 31.00 mg/L, 去除率分别为58%、 47.69%; A 反应器TN 去除率比B 反应器高10.4%; 投加Fe2+有利于TN 的去除, 比未投加铁源具有更好的反硝化效果。
(3) 随着进水氨氮浓度的不断升高, A 反应器的TTC-ETS 活性整体高于B 反应器2 个数量级;A 反应器中INT-ETS 活性随着C/N 的降低而逐渐升高, 最终达到80.39 mg[INTF]/(g[TSS]·h); 而B反应器内基本维持在57.89 mg[INTF]/(g[TSS]·h)。A 反应器中投加Fe2+对电子传递体系有明显的促进作用。
(4) 在C/N =3 的条件下, A 反应器的活性污泥中narG、 nirK、 nosZ 基因拷贝数均高于B 反应器(未投加铁源), Fe2+的投加提高了反硝化菌的活性, 这与TN 去除效果的变化相一致。 在C/N 分别为6、 3、 2 时, narG 小于(nirK+nirS)基因拷贝数,A、 B 反应器中均未出现亚硝酸盐的积累。
