白藜芦醇通过上调annexin A1表达促进氧糖剥夺/复氧大鼠小胶质细胞系向M2型极化
2021-05-12张红梅
林 敏,张红梅
(重庆大学附属三峡医院 药学部, 重庆 404000)
小胶质细胞作为中枢神经系统(central nervous system,CNS)的固有免疫细胞,是缺血性卒中发生后神经炎性反应的启动细胞和最主要的反应细胞。小胶质细胞独特的经典激活M1型和替代激活M2型两种极化形式,诱导小胶质细胞由促炎M1型向抗炎M2型极化有利于减轻缺血性脑损伤。白藜芦醇作为天然的抗炎物质,可调控小胶质细胞向M2型转化从而减轻急性缺血卒中后神经炎性反应,但具体机制尚不清楚。
研究证实,annexin A(ANXA1)是一种钙离子依赖的磷脂结合蛋白,富集于中性粒细胞、巨噬细胞和小胶质细胞等免疫细胞,在外周和中枢免疫系统中均发挥着重要的抗炎作用。ANXA1可促进氧糖剥夺的小胶质细胞向M2型转化,从而减轻神经元损伤[1]。目前,白藜芦醇对ANXA1的作用尚无报道,本研究通过体外构建氧糖剥夺/复氧(oxygen glucose deprivation/reoxygenation,OGD/R)模型,首次探讨白藜芦醇对OGD/R小胶质细胞ANXA1表达的影响,及ANXA1在白藜芦醇调控OGD/R小胶质细胞向M2型极化的可能作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂:兔抗ANXA1抗体(Abcam公司)、兔抗β-actin抗体(CST公司),HRP-conjugated Affinipure羊抗兔IgG和594-conjugated羊抗兔IgG(H+L)(Proteintech公司),5%牛血清白蛋白、Prime ScriptTMRT with gDNA Eraser试剂盒(TaKaRa公司)和DME/F12培养基(Gibco公司国)、白藜芦醇(Sigma-Aldrich公司),ANXA1相关慢病毒(上海吉凯生物技术公司)。
1.1.2 细胞:大鼠来源的小胶质细胞系N9(上海康朗生物科技有限公司)。
1.2 方法
1.2.1 细胞分组及处理:将N9细胞随机分组,未经OGD/R处理组细胞:OGD/R(-)组,构建OGD/R模型细胞:OGD/R(+)组,经Res处理的OGD/R(+)细胞:OGD/R(+)+Res组,经Res及空载慢病毒LV-Scramble处理的OGD/R(+)细胞:OGD/R(+)+Res+LV-Scramble组,经Res及沉默慢病毒LV-Scramble处理的OGD/R(+)细胞:OGD/R(+)+Res+LV-Scramble组。
构建N9细胞OGD/R模型:将正常培养的N9小胶质细胞完全培养基更换为D-Hanks液,并将细胞置于厌氧孵育箱中培养3 h,取出细胞,将D-Hanks液更换为完全培养基,将细胞置于含5% CO2的培养箱中继续培养24 h(见参考文献[2])。
慢病毒干预:慢病毒LV-shAnxA1(1×109transduction unit,TU/mL)和LV-Scramble(1×109transduction unit,TU/mL)按MOI=10(TU/细胞)感染慢病毒,培养3天后采用RT-qPCR和Western blot验证慢病毒感染效率,感染成功方可进行后续实验。
1.2.2 RT-qPCR检测ANXA1、TNF-α、IL-1β、IL-10、Arg-1和IL-1β mRNA表达:选取20 μmol/L浓度的白藜芦醇处理OGD/R模型N9细胞(见参考文献[3]),24 h后收集各组细胞,根据Trizol试剂盒说明书提取各组细胞的总RNA,然后按照反转录试剂盒说明书合成cDNA。以1.0 μL cDNA为模板,按10 μL反应体系进行PCR扩增反应,引物序列见表1。

表1 引物序列Table 1 Sequences of primer
1.2.3 Western blot检测ANXA1和CD11b蛋白含量:白藜芦醇处理24 h后,用0.25%胰蛋白酶消化细胞,RIPA裂解液与PMSF蛋白酶抑制剂(100∶1)提取细胞全蛋白,BCA`法测定各样品的蛋白质浓度。按照30 μg进行上样,10% SDS-PAGE分离蛋白,加入含细胞裂解液和PMSF(100∶1)的混合液提取各组细胞总蛋白,BCA法检测蛋白浓度,蛋白上样量为30 μg。采用10% SDS-PAGE分离蛋白,后采用250 mA恒流对0.45 μm PVDF膜进行电转,转膜结束后将PVDF膜先后进行封闭、分别孵育ANXA1和CD11b相应的一抗(4抗过夜),次日取出PVDF膜,TBST漂洗后孵育相应二抗。采用Fusion凝胶成像系统进行显影、分析数据。
1.2.4 免疫荧光检测ANXA1蛋白表达:白藜芦醇处理24 h后,采用4%多聚甲醛固定细胞30 min,PBS反复漂洗细胞,先后采用0.1% Triton X-100破膜、5% BSA封闭细胞、孵育相应ANXA1一抗(4 ℃过夜),次日取出细胞爬片,孵育相应二抗,PBS漂洗后孵育DAPI,最后用抗荧光淬灭剂封片,荧光显微镜观察、摄片。
1.3 统计学分析
2 结果
2.1 白藜芦醇上调OGD/R模型N9细胞内ANXA1表达
与OGD/R(-)组相比,OGD/R(+)组细胞内ANXA1 mRNA和蛋白含量显著增多(P<0.01),OGD/R(+)+Res组ANXA1 mRNA和蛋白较OGD/R(+)组进一步增多(图1A,B)。OGD/R(+)组ANXA1蛋白核转位较OGD/R(-)组明显增多,OGD/R(+)+Res组ANXA1蛋白主要分布在细胞浆(图1C)。
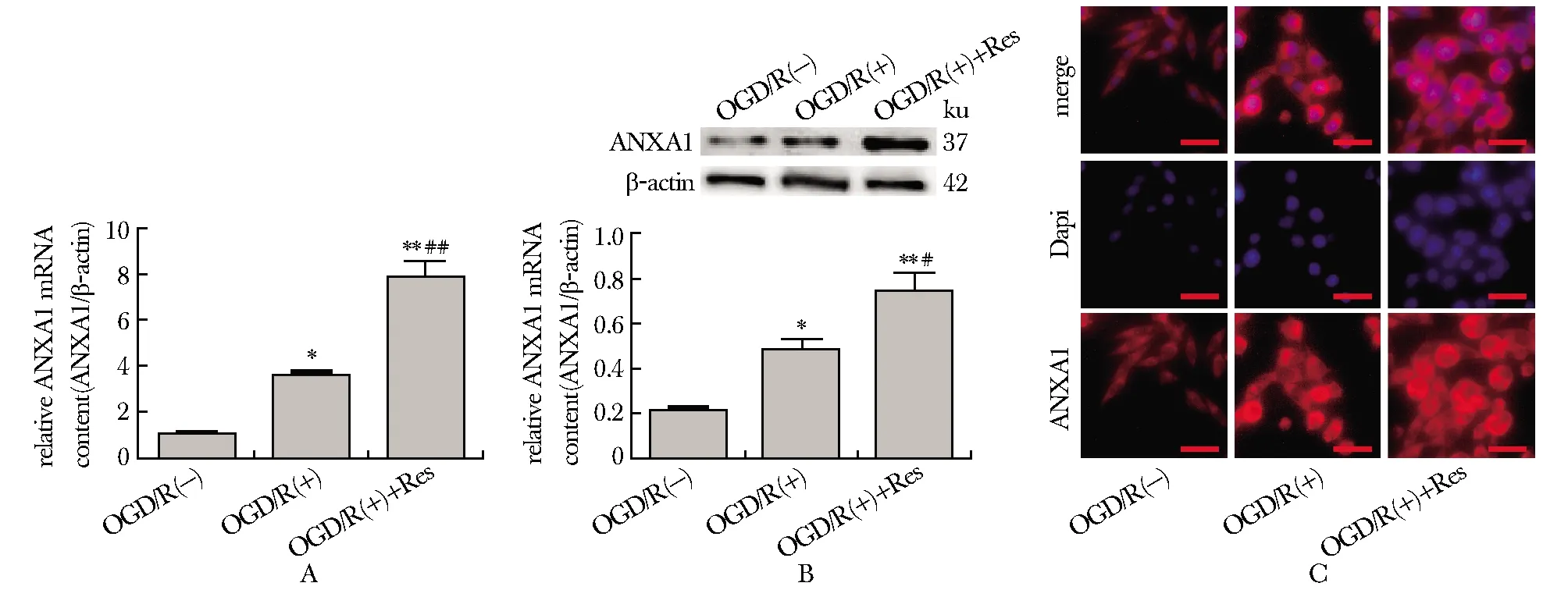
A.expression of ANXA1 mRNA in each group was detected by RT-qPCR; B.expression of ANXA1 protein in each group was detected by Western blot; C.expression of ANXA1 protein microglia was detected by immunofluorescence; *P<0.01, **P<0.001 compared with OGD/R (-) group; #P<0.01, ##P<0.001 compared with OGD/R (+) group; scale bar=100 μm图1 白藜芦醇有效上调OGD/R小胶质细胞内ANXA1 mRNA和蛋白表达Fig 1 Resveratrol effectively up-regulated the expression of ANXA1 mRNA and protein in OGD/R
2.2 慢病毒LV-shAnxA1有效抑制小胶质细胞内ANXA1表达
OGD/R(+)+Res+LV-shAnxA1组细胞内ANXA1 mRNA和蛋白含量较OGD/R(+)+Res+LV-Scramble组和OGD/R(+)+Res组明显下降(P<0.01)(图2A,B)。与OGD/R(+)+Res组相比, OGD/R(+)+Res+LV-shAnxA1组ANXA1蛋白含量很低(P<0.01),ANXA1主要位于细胞核(图2C)。

A.expression of ANXA1 mRNA in each group was detected by RT-qPCR; B.expression of ANXA1 protein in each group was detected by Western blot; C.expression of ANXA1 protein in microglia was detected by immunofluorescence; *P<0.01 compared with OGD/R(+)+Res group; #P<0.01 compared with OGD/R(+)+Res+LV-Scramble group; scale bar=100 μm图2 慢病毒LV-shAnxA1有效抑制ANXA1表达Fig 2 Lentivirus LV-shAnxA1 effectively inhibited ANXA1
2.3 沉默ANXA1对白藜芦醇抑制小胶质细胞活化的影响
OGD/R(+)+Res+LV-shAnxA1组细胞内CD11b蛋白含量较OGD/R(+)+Res组明显增高(P<0.01)。
与OGD/R(+)+Res组相比,OGD/R(+)+Res+LV-shAnxA1组TNF-α和IL-1β mRNA含量均明显增高(P<0.001),Arg-1和IL-10 mRNA含量均显著降低(P<0.01,P<0.001)(图3)。
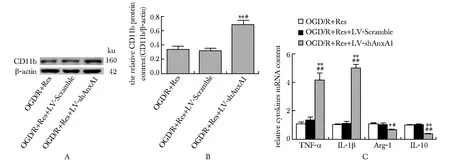
A.expression of CD116 protein in group was detected by Western blot; B.histogram represents quantative analysis of CD116 protein content in each group; C.expression of TNF-α, IL-1β, Arg-cand, IL-10 mRNA in each group was detected by RT-qRCR;*P<0.001, **P<0.01 compared with OGD/R(+)+Res group; #P<0.001, ##P<0.01 compared with OGD/R(+)+Res+LV-Scramble group图3 白藜芦醇通过上调ANXA1抑制小胶质细胞激活Fig 3 Resveratrol inhibited microglial activation by up-regulating
3 讨论
小胶质细胞介导的神经炎性反应是急性缺血性卒中后诸多复杂病理机制的核心环节。调控小胶质细胞由促炎M1型向抗炎M2型转换是调控小胶质细胞激活的关键策略。明确白藜芦醇调控小胶质细胞向M2型极化的具体机制是探索白藜芦醇减轻急性缺血性卒中后神经炎性反应的重要环节[4-5]。ANXA1是膜联蛋白家族中第一个以钙依赖的方式与细胞膜结合,受糖皮质激素调节的磷脂结合蛋白,参与细胞凋亡、炎性反应、细胞增殖及分化等[6]。卒中实验鼠和患者外周ANXA1的水平明显降低与血栓炎性反应相关,而外源性给予ANXA1可减少血小板活化和血栓形成,该效应与体内整合素合成被抑制有关[7]。
本研究发现OGD/R在诱导的小胶质细胞内ANXA1合成增多,这与报道[8-9]一致。研究证实,富集于CNS小胶质细胞内的ANXA1可通过调控小胶质细胞向M2型极化,从而减轻急性缺血性卒中后神经炎性反应。本研究进一步发现白藜芦醇可促进OGD/R小胶质细胞内ANXA1表达增多。为证实上述变化是一种伴随现象抑或具有生理学意义,采用慢病毒LV-shAnxA1沉默AnxA1表达后,白藜芦醇未能有效上调ANXA1表达,且ANXA1蛋白核转位明显减少,推测这与ANXA1表达减少相关。
生理状态下ANXA1蛋白主要分布于细胞质,OGD/R可诱导ANXA1从胞质转移至胞核,参与神经元细胞凋亡,这与ANXA1与BH3相互作用域死亡激动剂(BH3-interacting-domain death agonist,Bid)启动子直接作用,后肌球蛋白IIA以TRPM7激酶依赖性方式协助ANXA1发生细胞核易位从而诱导神经元凋亡[10]。亦有研究发现ANXA1可能通过神经元核转位信号通路与 importin β相互作用,随后通过增强p53转录活性诱导促凋亡基因bid等介导细胞凋亡[11]。ANXA1在小胶质细胞内的核转位机制尚不清楚,ANXA1与转运蛋白-18KDa(translocator protein-18 KDa,TSPO)相互作用介导NF-κB信号通路,从而调控小胶质细胞介导的神经炎性反应[12]。基于小胶质细胞分泌促炎及抗炎介质的特性,本研究选取经典的M1型炎性介质TNF-α、IL-1β和M2型炎性介质Arg-1、IL-10作为小胶质细胞极化的标志。沉默AnxA1后,白藜芦醇未能降低小胶质细胞标志物M1型标志物表达,而M2型标志物表达明显减少,因此白藜芦醇抑制小胶质细胞活化及向M2型极化的作用明显与白藜芦醇上调ANXA1相关。但白藜芦醇抑制ANXA1蛋白核转位的具体机制及作用暂不清楚,需后续深入研究。
综上所述,白藜芦醇可上调ANXA1表达抑制OGD/R模型小胶质细胞向M2型极化,为白藜芦醇抑制缺血性卒中后的神经炎性反应提供了一定的理论基础。
