miR-183靶向Bnip3l对缺氧/复氧的小鼠海马神经元细胞线粒体自噬的影响
2021-05-12马家玲高艳平
马家玲,高艳平
(张家港市第一人民医院 苏州大学附属张家港医院 麻醉科, 江苏 张家港 215600)
大脑海马对缺血缺氧非常敏感,是大脑缺血/再灌注(ischemia/reperfusion,I/R)损伤的好发部位之一,而大脑海马神经元受损会引起认知功能障碍,是脑损伤的主要表现之一[1],故抑制海马神经元受损,是缓解I/R脑损伤的重要手段之一。目前研究发现,线粒体自噬与脑I/R损伤关系密切,其自噬不足或过度激活均可导致神经元细胞变性和死亡而加重脑损伤[2]。研究证实miR-183可抑制自噬并刺激细胞凋亡[3],且miR-183也可在大脑皮质中特异性表达,并参与神经细胞分化和调控[4]。但miR-183抑制线粒体抑制自噬对I/R脑损伤过程海马神经元的影响,报道较少。腺病毒基因Bcl-2同源蛋白[B-cell leukemia/lymphoma 2(Bcl-2)/adenovirus E1B interacting protein 3-like,BNIP3L]是介导脑内线粒体自噬,减轻脑缺血损伤的必须成分[5]。但Bnip3l与miR-183的靶向作用还尚不清楚,本研究建立双荧光素酶报告试验对两者的靶向作用,进行验证,并复制海马神经元细胞(HT-22)缺氧/复氧(hypoxia/reoxygenation,H/R)模型来模拟I/R损伤模型,探讨miR-183靶向调控Bnip3l表达对海马神经元细胞线粒体自噬的影响及作用机制,以期阐明I/R脑损伤的分子生物学机制,为临床研究提供可靠资料。
1 材料及方法
1.1 材料
1.1.1 细胞系:小鼠源海马神经元细胞系HT-22(ATCC:American Type Culture Collection)。
1.1.2 主要试剂:miR-183激动剂(miR-183 mimics,Signosis公司)及阴性对照(miR-183NC)(System Biosciences公司);四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)(Sigma-Aldrich公司);Trizol试剂盒(北京麦瑞博公司);反转录RT试剂盒(武汉纯度生物科技有限公司);DMEM 高糖培养基(Hyclone 公司);BCA 蛋白定量试剂盒、胰蛋白酶(Pierce 公司);泛素和LC3结合蛋白p62(ubiquitin-and LC3-binding protein p62,p62)抗体(北京博奥森生物技术有限公司);BNIP3L抗体(武汉菲恩生物科技有限公司);自噬相关蛋白beclin-1抗体(北京博奥森生物技术有限公司);微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3,LC3-Ⅱ)、LC3-I抗体(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 HT-22的分组及处理:收集对数期细胞,以每孔2×105个细胞接种于6孔板上,适应性培养24 h后,将其分为对照组、缺氧/复氧(hypoxia/reoxygenation,H/R)模型(HR)组、miR-183过表达组(miR-183 mimics)、阴性对照(miR-183 NC)组。对照组细胞不任何处理,使其自然增值;除对照组外,其余各组细胞均按文献[6-7]方法于3气培养箱中缺氧3 h,复氧12 h建立缺氧复氧模型,miR-183 mimics组和miR-183 NC组分别在缺氧3 h后转染miR-183 mimics和miR-183 NC试剂,转染后进行复氧12 h培养,转染方法严格按照LipofectamineTM2000转染试剂盒说明书进行。各组细胞按上述方法处理后,收集细胞,以备后续试验。将新购的HT-22细胞复苏后,接种于含10%胎牛血清(fetal bovine serum,FBS)的高糖DMEM培养基中,置于条件为 37 ℃、5% CO2的恒温培养箱中培养48 h,当细胞汇合度>80%后,进行常规传代、计数。
1.2.2 MTT法测定HT-22细胞存活率:取对数期细胞,每组设置6个复孔,向每个孔中加入20 μL MTT溶液(5 g/L),随后在37 ℃下再孵育1 h,小心丢弃含有MTT溶液的培养基,并加入200 μL二甲基亚砜(DMSO)以溶解沉淀物。使用自动多孔分光光度计测量490 nm的吸光度(A)值,存活率(%)=实验组A值/对照组A值×100%。
1.2.3 透射电镜观察线粒体结构:细胞按文献[7]方法加入5 mL 2.5%戊二醛固定、磷酸盐缓冲液(PBS)洗涤后,用l%四氧化锇在4 ℃下固定30 min、PBS洗涤后,用2%醋酸铀水溶液染色30 min、乙醇梯度脱水,3 mL纯丙酮-EPON812包埋后,于37、45、60 ℃烘箱内烘烤固化后,切成1 μm切片,2%醋酸铀染色并切成50 nm超薄切片,用醋酸-柠檬酸染色后于JEM-1200EX透射电镜下观察线粒体超微结构。
1.2.4 RT-qPCR检测各组细胞miR-183、Bnip3l mRNA相对表达水平:利用Trizol试剂盒抽提细胞总RNA,应用反转录试剂盒将1 μg RNA反转录为cDNA,反转录体系为10 μL(2 μL 5× reaction mix,1 μL random primer,0.5 μL反转录酶,5 μL RNA样品),反应条件(置于42 ℃ 60 min,85 ℃ 5 min灭活反转录酶活性)。将cDNA稀释10倍进行RT-qPCR反应,反应体系为cDNA 4 μL,正向引物、反向引物各0.4 μL,SYBR Green/Flourescein qPCR Maxter Mix 10 μL,去离子水5.2 μL。反应条件为95 ℃预热3 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 15 s,上述3步骤35次循环,72 ℃ 5 min终止反应。miR-183以U6为内参基因,Bnip3l mRNA以β-actin为内参基因,引物由生工生物工程(上海)股份有限公司合成设计(表1)。用2-ΔΔCt算法计算miR-183、Bnip3l mRNA相对表达量。
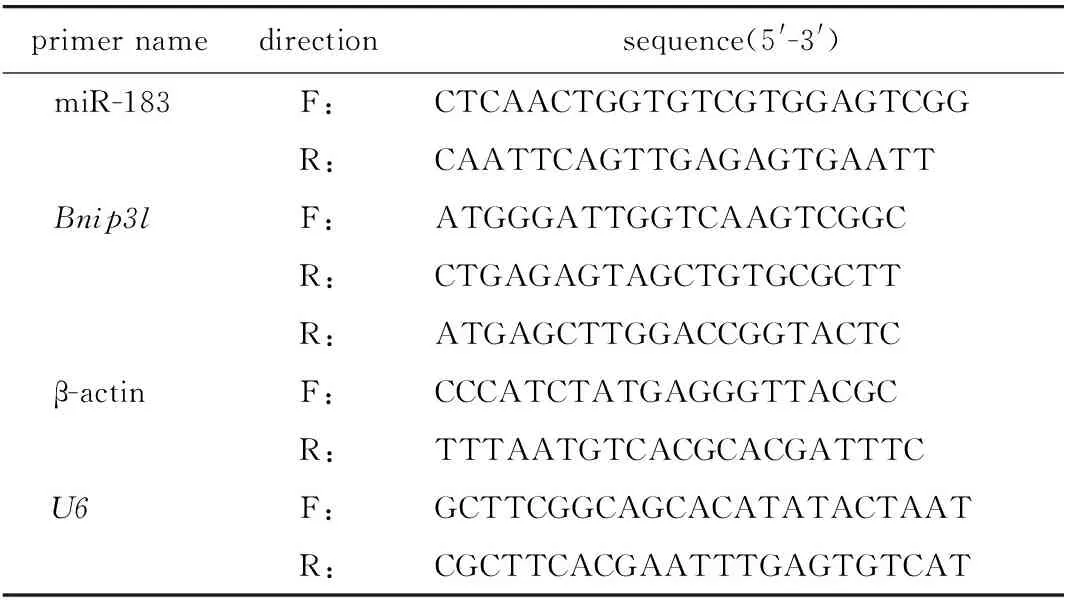
表1 RT-qPCR引物序列Table 1 RT-qPCR primer sequences
1.2.5 Western blot检测BNIP3L、beclin-1、p62、LC3-Ⅱ/ LC3Ⅰ蛋白表达:取各组细胞,加细胞裂解液裂解细胞,离心分离后,取上清液提取蛋白,按BCA试剂盒说明书测定蛋白浓度,并灌制SDS-PAGE凝胶后,取200 μg蛋白进行SDS-PAGE,接着将全部蛋白转移至硝酸纤维素膜上,并置于5%的脱脂奶粉溶液中,于摇床上37 ℃封闭2 h,将目的蛋白条带,置于孵育盒中,加入抗体(BNIP3L、 beclin-1、p62、LC3-Ⅱ、 LC3-Ⅰ,β-actin(内参),1∶1 000、1∶500、1∶1 000、1∶1 000,1∶2 000)于4 ℃冰箱中孵育过夜,经TBST漂洗3次,加入1∶1 000的羊抗兔二抗溶液,于摇床上室温孵育2 h,经TBST再次漂洗3次,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。
1.2.6 双荧光素酶报告基因试验:合成Bnip3l的3′非翻译区(3′UTR)的miR-183识别序列,克隆至pmiRGlo载体,得到pmiRGlo-Bnip3l-3′UTR-WT。另外对miR-183识别区Bnip3l碱基进行突变连接至pmiRGlo载体,得到得到pmiRGlo-Bnip3l-3′UTR-MUT,分别将pmiRGlo-Bnip3l-3′UTR-WT、pmiRGlo-Bnip3l-3′UTR-MUT质粒与miR-183 NC、miR-183 mimics共转染,分为miR-183NC+Bnip3l-3′UTR-WT组、miR-183 mimics+Bnip3l-3′UTR-WT组、miR-183NC+Bnip3l-3′UTR-MUT组、miR-183 mimics+Bnip3l-3′UTR-MUT组,24 h后按照双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海参荧光素酶试剂上机检测。每孔的数值以萤火虫荧光活性/海参荧光活性显示,试验重复3次。
1.3 统计学分析

2 结果
2.1 各组HT-22细胞存活率比较
与对照组相比,HR组和miR-183 NC组细胞存活率均下降(P<0.05),与HR组和miR-183 NC组相比,miR-183 mimics组细胞存活率降低(P<0.05)(表2)。

表2 各组HT-22细胞存活率比较Table 2 Comparison of survival rate of HT-22 cells
2.2 各组HT-22细胞线粒体结构观察
对照组细胞核仁明显,线粒体结构清晰,核糖体丰富;HR组和miR-183 NC组核仁消失,膜状结构自噬体增多,可见线粒体自噬及自噬后残留的黑色素;miR-183 mimics组细胞核固缩,膜状结构自噬体较少,线粒体结构紊乱,甚至模糊(图1)。
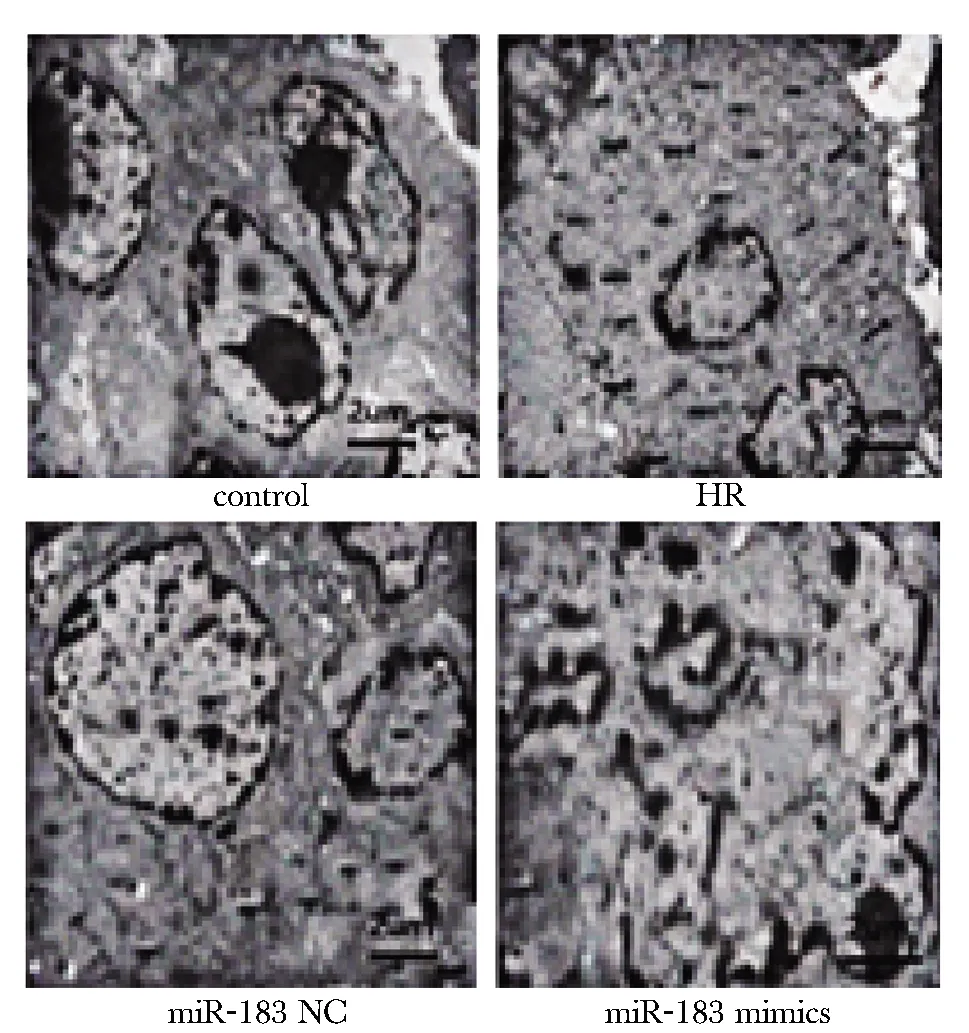
图1 透射电镜观察线粒体超微结构Fig 1 Ultrastructure of mitochondria observed by transmission electron microscope (×2 500)
2.3 各组HT-22细胞miR-183、Bnip3l mRNA表达水平
与对照组相比,HR组和miR-183 NC组细胞miR-183表达下降(P<0.05),Bnip3l mRNA表达升高(P<0.05);与HR组和miR-183 NC组相比,miR-183 mimics组细胞miR-183 表达升高(P<0.05),Bnip3l mRNA表达降低(P<0.05)(表3)。
表3 各组HT-22细胞miR-183、Bnip3l mRNA相对表达水平Table 3 Relative expression levels of mir-183 and Bnip3l mRNA in HT-22 cells of each n=6)
2.4 各组HT-22细胞自噬相关蛋白BNIP3L、beclin-1、p62、LC3-Ⅱ/LC3Ⅰ相对表达水平
与对照组相比,HR组和miR-183 NC组细胞BNIP3L、beclin-1、LC3-Ⅱ/ LC3Ⅰ表达升高(P<0.05),p62表达下降(P<0.05);与HR组和miR-183 NC组相比,miR-183 mimics组细胞BNIP3L、beclin-1、LC3-Ⅱ/ LC3Ⅰ表达下降(P<0.05),p62表达升高(P<0.05)(图2,表4)。
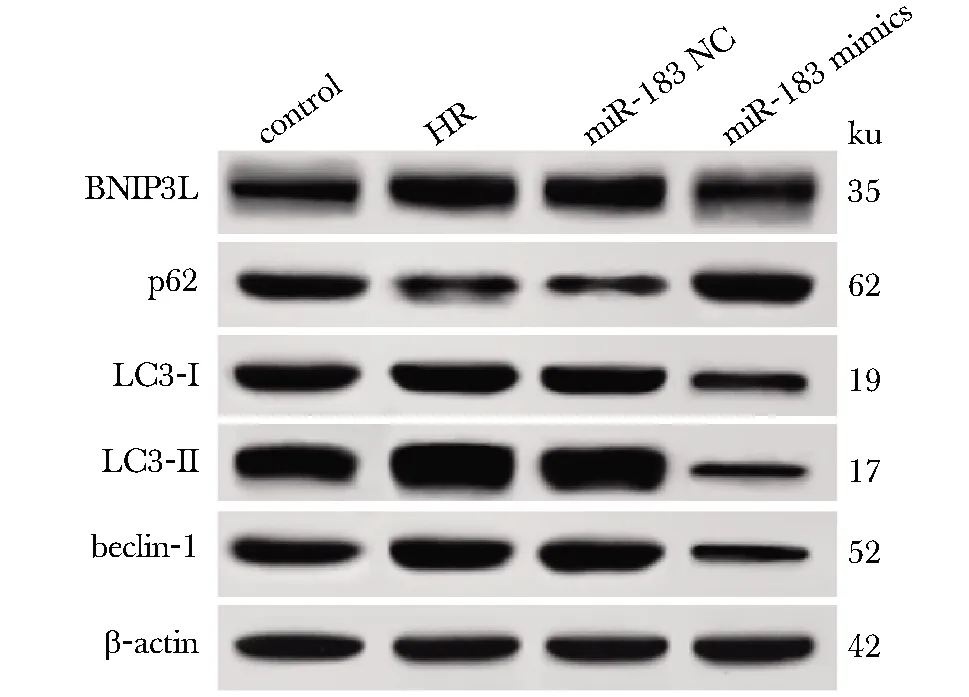
图2 Western blot检测各组HT-22细胞BNIP3L、beclin-1、p62、LC3-Ⅱ/ LC3Ⅰ蛋白表达Fig 2 Western blot of BNIP3L, beclin-1, p62,LC3-Ⅱ/LC3Ⅰ protein expression in HT-22 cells of each group
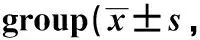
表4 各组细胞BNIP3L、beclin-1、p62、LC3-Ⅱ/ LC3Ⅰ蛋白表达水平Table 4 Protein expression levels of BNIP3L, beclin-1, p62, LC3-Ⅱ/ LC3Ⅰ in each n=6)
2.5 双荧光素酶法检测miR-183与Bnip3l关系
miRtarbase预测显示,miR-183与Bnip3lmRNA 3′UTR区域有结合位点。双荧光素酶报告基因检测显示,与miR-183+Bnip3l-3′UTR-WT组比较,miR-183 mimics+Bnip3l-3′UTR-WT组荧光素酶活性降低(P<0.05)(图3)。
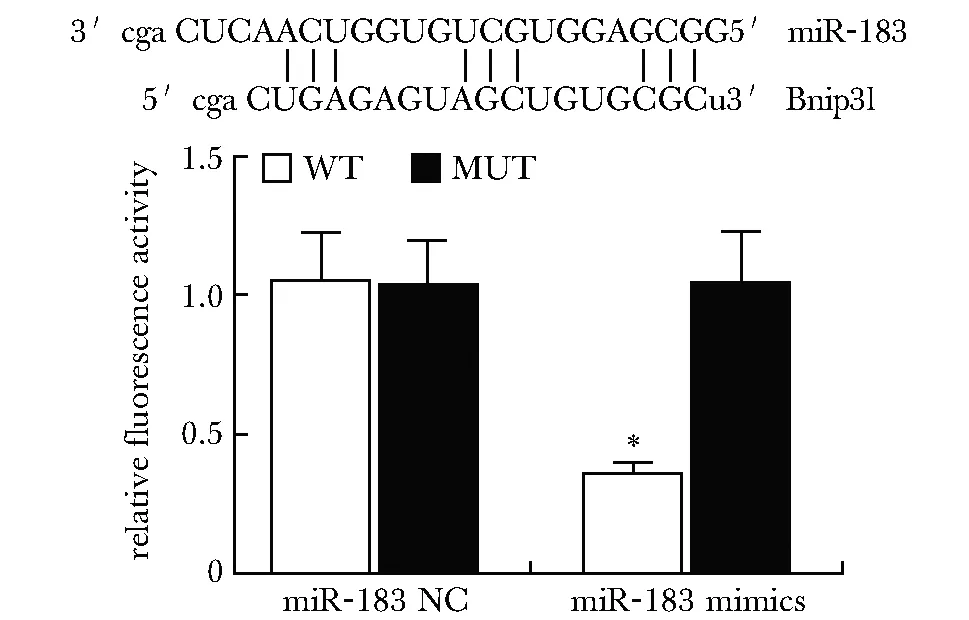
*P<0.05 compared with miR-183NC+Bnip3l-3′UTR-WT图3 miRtarbase预测miR-183与Bnip3l的靶向关系及双荧光素酶报告基因分析结果Fig 3 Prediction of targeting relationship between miR-183 and Bnip3l by miRtarbase and analysis of dual-luciferase reporter gene
3 讨论
I/R损伤引起的脑损伤,是导致成年人致死和致残的主要原因之一,其病理和生理过程复杂,涉及神经元细胞的凋亡、自噬、炎性反应、修复等过程。体外培养经过永生化处理的海马神经元HT-22细胞并建立缺氧/复氧(H/R)模型,可直接观察细胞形态并监测其生理、生化、代谢等功能的改变,是研究I/R损伤体外细胞水平的最佳手段[8]。
在短暂全脑缺血/再灌注后海马锥体神经元上可观察到自噬空泡等自噬现象[9],研究证实,在脑损伤初期,自噬激活对低氧引起的脑缺血神经细胞有保护作用[10],氧糖剥夺2 h后,用自噬抑制剂抑制自噬可加重脑损伤,反之用雷帕霉素诱导自噬可减少神经元凋亡缓解脑损伤[11],另外在氧糖剥夺6 h后用自噬抑制剂处理可缓解脑损伤,而用自噬激活剂处理,神经元及脑损伤反而加重,表明在脑损伤初期抑制自噬可加重神经元和脑损伤,而在脑损伤后期抑制自噬可减缓脑损伤。本研究用氧糖剥夺3 h后复氧6 h处理HT-22神经元细胞,发现HR组HT-22细胞存活率低于对照组,电镜下观察可见线粒体自噬及自噬后残留的黑色素、膜状结构自噬体等均增多,提示缺氧3 h/复氧12 h神经元细胞中线粒体自噬被激活。miR-183能够抑制自噬,且在人大脑皮质中有特异性表达,并参与神经细胞分化和调控[12],本研究在HR组缺氧/复氧HT-22细胞中也检测到miR-183的表达,且miR-183的表达低于对照组,提示缺氧3 h复氧12 h后,自噬激活,miR-183表达降低,表明miR-183低表达参与神经元细胞自噬激活过程。又有研究证实miR-183过表达可抑制细胞的自噬,促进凋亡[4]。本研究过表达miR-183后,发现miR-183 mimics组miR-183增高后,HT-22存活率低于HR组,电镜下观察可见,膜状结构自噬体减少,线粒体出现结构紊乱、甚至模糊等损伤现象,表明过表达miR-183可抑制缺氧3 h复氧12 h神经细胞线粒体自噬和细胞生存。
BNIP3L位于线粒体外膜,低氧刺激下BNIP3L表达升高,可促进Beclin-1蛋白的游离释放,并调控下游多种自噬相关Atg蛋白在自噬前体结构中的定位,从而激活线粒体自噬的发生[13],另外,BNIP3L也可与自噬相关基因Atg8相似同源物LC3和p62结合并介导自噬体靶向清除损伤的线粒体[14]。如发现BNIP3L也是介导缺血脑内线粒体自噬发生所必须的成分,其缺失会导致线粒体自噬障碍,而逆转其缺失可发挥抗脑缺血损伤,表明Bnip3l也可参与线粒体自噬过程,且与脑I/R再损伤关系密切[15]。本研究发现HR组HT-22细胞Bnip3l mRNA及蛋白、自噬相关蛋白Beclin-1表达和LC3-Ⅱ/LC3-Ⅰ比值均高于对照组,p62表达低于对照组,提示缺氧3 h复氧12 h神经细胞,Bnip3l高表达可能与自噬激活有关。而过表达miR-183抑制自噬激活后,miR-183 mimics组Bnip3l mRNA及通路相关蛋白、细胞存活率均明显低于HR组,提示miR-183高表达后,细胞生存率降低,BNIP3L及缺线粒体自噬均处于抑制状态,表明过表达miR-183后,可能抑制了BNIP3L介导的线粒体自噬激活,而使缺氧3 h复氧12 h神经细胞损伤加重,miR-183与Bnip3l之间可能存在靶向关系。为了进一步验证这一推测,本研究采用双荧光素酶报告试验进行验证,发现通过转染miR-183 mimics与WT-Bnip3l后,双荧光素酶活性明显抑制,表明miR-183与Bnip3l存在靶向调控关系。
综上所述,miR-183过表达可靶向抑制Bnip3lmRNA表达,抑制HT-22细胞线粒体自噬,加重缺氧/复氧所致HT-22细胞损伤。该结果为临床诊断和治疗缺血脑损伤提供一定的参考。但本研究也存在一定的不足,细胞体外实验与体内实验具有一定的差异性,线粒体自噬是个复杂的过程,在缺氧/复氧后期miR-183调控BNIP3L介导线粒体自噬与脑损伤的关系还未验证,这有待后续进一步研究。
