受甲基化调控的lncRNA在乳腺癌中的表达谱及意义
2021-05-11胡倩蓝晓珊林颖欣陈秀云丁林潇潇庞丹梅
胡倩,蓝晓珊,林颖欣,陈秀云,丁林潇潇,庞丹梅
1.佛山市第一人民医院 肿瘤中心,广东 佛山 528000;2.中山大学孙逸仙纪念医院 乳腺医学部,广东 广州 510120
据报道乳腺癌是全世界女性最常见的恶性肿 瘤[1-2]。表观遗传修饰在乳腺癌的发生发展过程中发挥重要作用[3-4]。外界环境因素如药物、饮食、生活习惯能直接影响表观遗传学修饰,如DNA甲基化、组蛋白乙酰化等[3-5]。肿瘤的发生发展和原癌基因的异常低度甲基化与抑癌基因的异常高度甲基化有关[6]。长链非编码RNA(long non-coding RNA,lncRNA)也是表观遗传学修饰一种方式[7-8]。本研究采用高通量lncRNA芯片技术和实时荧光定量PCR(Real-time quantitative polymerase chain reaction,qRT-PCR)筛选受甲基化水平影响的 lncRNA分子,分析其可能对乳腺癌的发生发展所发挥的调控作用。
1 材料和方法
1.1 细胞株 采用三株人乳腺癌细胞株BT549、MB231 和BT474 以及人正常永生化乳腺上皮细胞MCF10A。BT549、MB231细胞株的表型为三阴型,而BT474细胞株表型为上皮型。BT549、BT474及MB231细胞培养于10%胎牛血清的DMEM低糖培养基,人正常永生化乳腺上皮细胞株MCF10A培养于含5%马血清、10 μg/mL胰岛素、20 μg/mL表皮生长因子、100 μg/mL霍乱毒素、0.5 μg/mL氢化可的松的DMEM/F12培养基,置于37 ℃、5% CO2恒温细胞培养箱,待细胞培养至80%~90%融合时移去旧培养基,使用1 mL 0.25%胰酶消化传代。根据文献报道及预实验结果,本研究利用上皮型BT474乳腺癌以去甲基化药物5-氮杂胞苷(5’aza-deoxycytidine,sigma)5 μmol/L的处理72 h,每24 h换液,获得乳腺癌细胞去甲基化处理株[9]。细胞株均购置于ATCC细胞保藏中心。
1.2 乳腺癌组织标本 选取2019年6月佛山市第一人民医院符合病理诊断的20例乳腺癌患者。20例患者均为女性,年龄38~70岁,中位年龄50岁。入选标准:①病理确诊的乳腺浸润性导管癌;②体力评分(performance status,PS)0~2分;③无严重的骨髓功能或肝肾功能异常。本研究经本院伦理委员会批准,所有患者均签署知情同意书。采集20例乳腺癌患者新鲜癌组织及癌旁组织样本,提取DNA和RNA用于下一步检测。
1.3 LncRNA芯片检测 LncRNA芯片检测由上海康成公司完成。采用Arraystar公司开发的包含人类lncRNA和mRNA的lncRNA芯片,目前该芯片覆盖UCSC Known gene、NCBI Refseq、RNAdb和NRED等多个数据库的lncRNA,共检测3对BT474亲本株和去甲基化株共6个样本。将获得的细胞株加入TRIzol裂解液转移到1.5 mL EP管中。提取RNA,反转录,37 ℃ 15 min,85 ℃ 5 s,合成双链互补DNA,以Agilent Quick Amp Labeling Kit标签6个样品,在小室杂 交。洗脱后,以Agilent DNA Microarray Scanner 进行扫描检测,并且以Agilent Feature Extraction 软件进行数据提取得到原始数据,并进行数据的标准化。去甲基化组和对照组之间差异表达lncRNA以散点图来表示。
1.4 qRT-PCR 将需要复核的样本加入TRIzol裂解液转移至1.5 mL EP管中,提取RNA。反转录,37 ℃ 15 min,85 ℃ 5 s。合成双链互补DNA,使用Light Cycler 480 Real-time PCR仪上进行实时定量PCR,反应条件为:95 ℃预热3 min,95 ℃预变性10 s,运行40 个循环,每个循环分为:95 ℃变性5 s, 60 ℃退火及延伸30 s,计算lncRNA的相对定量。利用网站及工具选取10个存在CPG岛并在芯片检测结果中差异表达的候选lncRNA分子用于后续qRTPCR检测(见表1)。PCR法检测选定的10个lncRNA在乳腺癌细胞和乳腺癌组织中的相对表达量。
1.5 基因启动子甲基化状态检测 采用美国加州大学UCSC网站工具(http://genome.ucsc.edu/ cgi-bin/hgGateway)和methprimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)网站在去甲基化后差异表达的芯片表达谱列表中寻找存在上游-2 000 bp的CpG岛和甲基化位点共10个候选lncRNA分子用于后续qRT-PCR检测(见表1)。通过BSP方法验证软件预测筛选出来的lncRNA uc003lxs和uc002btf的基因启动子上游CpG岛在乳腺上皮细胞株和乳腺癌细胞株MCF10A、BT474、MB231和BT549及乳腺癌组织和癌旁组织中的甲基化状态。培养细胞后提取DNA,进行亚硫酸氢盐的转化。两轮PCR扩增后,1%琼脂糖凝胶电泳检测及胶回收,pBLUE-T载体连接试剂盒操作,将纯化的目的DNA片段克隆到pBLUE-T载体上,并转化到大肠杆菌中,挑取阳性克隆,将扩增的菌液进行测序。
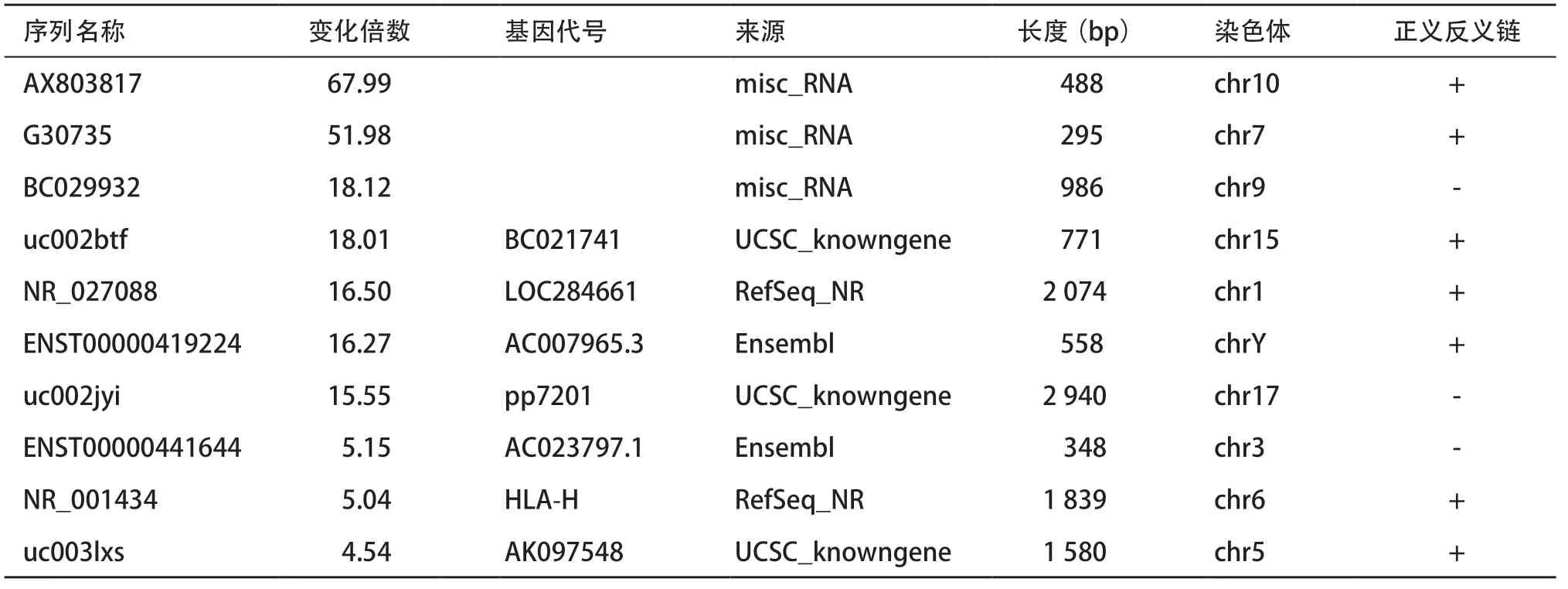
表1 BT474细胞株去甲基化处理后表达显著升高并存在基因CPG岛的lncRNA
1.6 统计学处理方法 采用SPSS17.0软件进行统计学分析。K-S正态检验用于计量资料的正态性检验,符合正态分布,数据以表示,两组间比较采用t检验;如不符合正态分布,数据以M(P25,P75)表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA表达芯片结果 本研究结果显示去甲基化细胞株和亲本株lncRNA存在显著的差异(见图1)。在芯片检测到的总共33 045个人类lncRNA中,去甲基化处理细胞株中较亲本株显著升高2倍以上的lncRNA为287个,显著升高10倍以上的lncRNA为54个;而下调2倍以上的lncRNA为556个,显著下调10倍以上的lncRNA为35个。根据lncRNA在基因组中的不同位置分为双向lncRNA、外显子重叠lncRNA、 基因间lncRNA、内含子重叠lncRNA、内含子反义lncRNA和天然反义lncRNA,差异表达的lncRNA的不同分类的数量分布情况见图2A。不同编号染色体差异表达的lncRNA数量的分布情况见图2B。
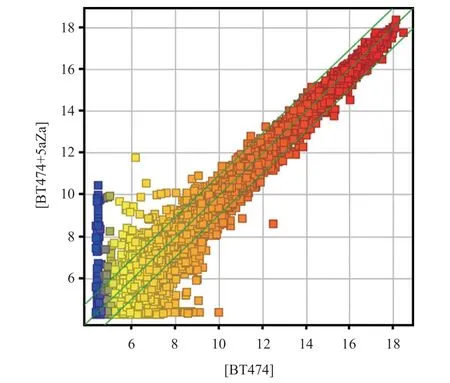
图1 乳腺癌细胞株BT474去甲基化处理株和亲本株的lncRNA芯片表达谱散点图
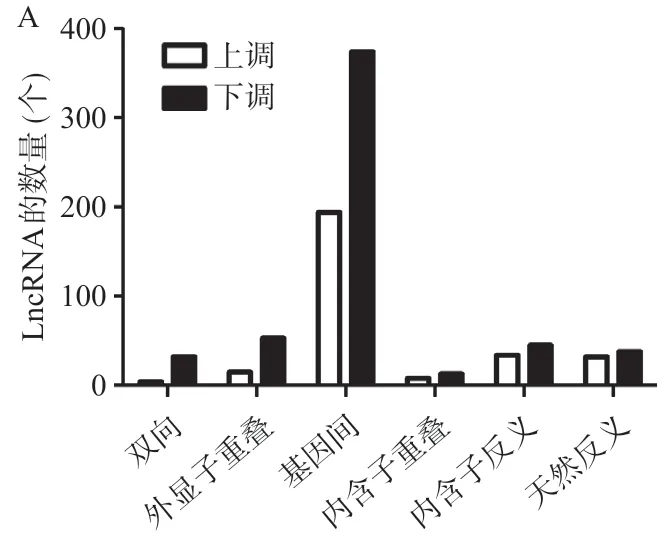
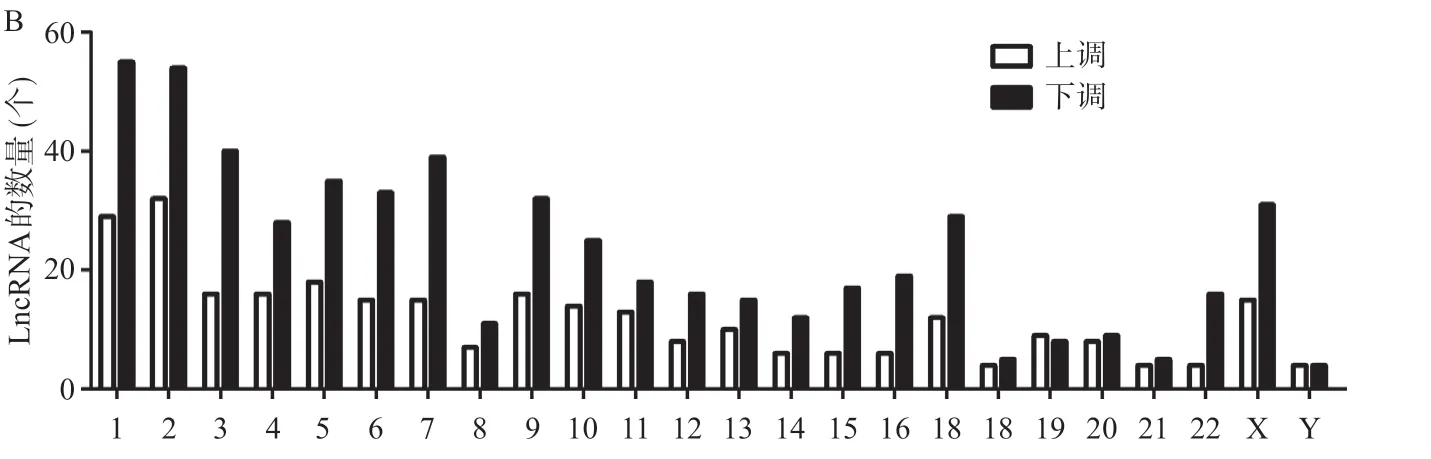
图2 去甲基化乳腺癌细胞株中差异表达的lncRNA的数量分布
2.2 qRT-PCR结果验证芯片结果及乳腺癌样本检测 为了验证芯片检测的结果,本研究采用qRTPCR方法针对在芯片检测结果中变化最显著的并且能找到DNA启动子上游CPG岛的10个lncRNA进行定量检测。本研究针对AX803817 等10 个分子合成引物,在细胞株中重新行去甲基化处理后提取RNA行qRT-PCR检测。检测结果显示AX803817、G30735、BC029932、uc002btf、NR_027088、ENST00000419224、uc002jyi.1、ENST00000441644、uc003lxs、NR_001434等RNA在去甲基化细胞组中较对照组显著上调(见图3A),送芯片样本复核RT-PCR和细胞株RT-PCR结果基本一致,差异无统计学意义(P>0.05)。
此后继续采用qRT-PCR检测以上分子在正常乳腺上皮细胞株MCF10A、上皮型乳腺癌细胞株BT474、基底型的乳腺癌MB231及BT549中的表达情况。结果显示,与MCF10A细胞比,uc003lxs和uc002btf在BT474、MB231及BT549细胞中均显著上调(P<0.01),见图3B。与乳腺癌癌旁组织比,uc003lxs在乳腺癌组织中表达显著上调,差异有统计学意义(P<0.01),与乳腺癌癌旁组织比,uc003lxs在乳腺癌组织中表达显著上调,差异有统计学意义(P<0.01),见图3C。
2.3 LncRNA的基因启动子甲基化状态BSP检测 结果发现lncRNA uc003lxs DNA启动子区域28个位点中,乳腺癌MB231及BT549细胞株均未发生甲基化,而MCF10A细胞株和BT474细胞株中超过50.00%位点的甲基化(见图4);而lncRNA uc003btf DNA启动子区域9个位点中,乳腺癌MB231及BT549细胞株中33.33%位点发生甲基化,而MCF10A细胞株和BT474细胞株中9个位点中超过66.67%的位点均发生甲基化(见图5)。LncRNA uc003lxs及uc002btf在MB231及BT549 细胞株中基因启动子呈现低度甲基化状态(P<0.01),而uc003lxs及uc002btf的表达升高 (P<0.01)。
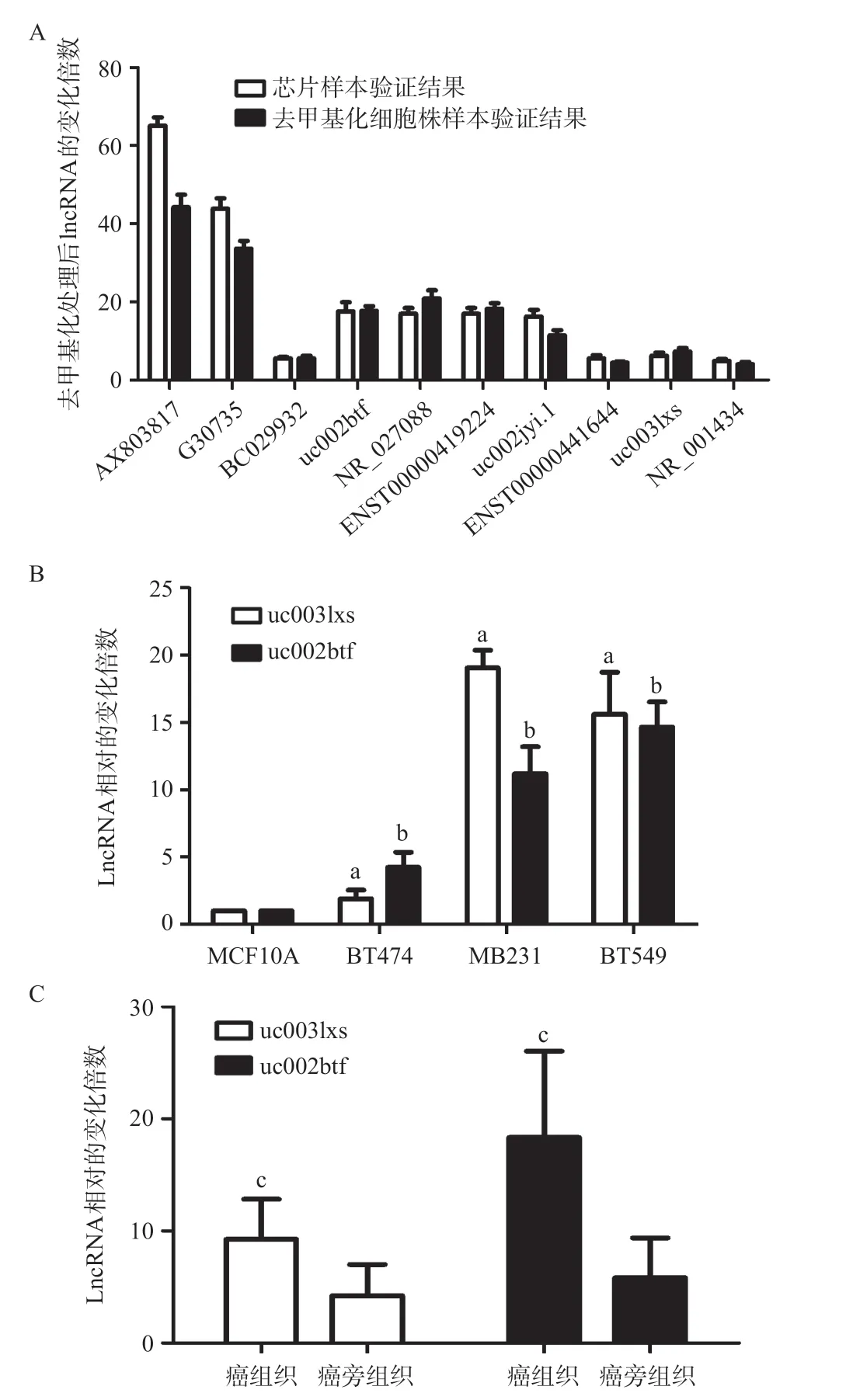
图3 qRT-PCR法检测不同乳腺癌细胞株、癌组织和癌旁组织的lncRNA水平
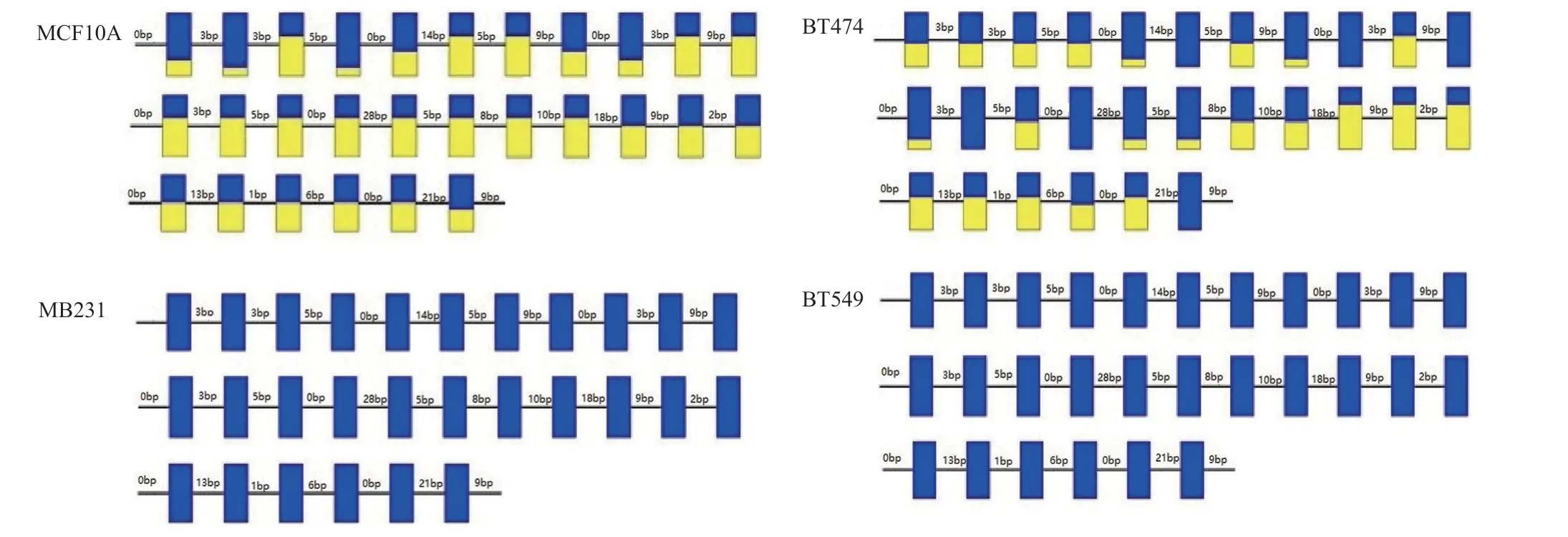
图4 亚硫酸氢盐处理后测序法检测不同乳腺癌细胞株lncRNA uc003lxs的基因启动子上游CPG岛的甲基化水平
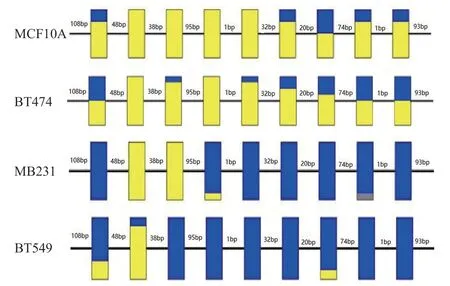
图5 亚硫酸氢盐处理后测序法检测不同乳腺癌细胞株lncRNA uc002btf的基因启动子上游CPG岛的甲基化水平
20 例患者乳腺癌组织及癌旁组织中lncRNA uc003lxs基因CPG岛中检测到甲基化位点百分数明显高于癌旁组织,差异有统计学意义(P<0.01)。20例患者乳腺癌组织及癌旁组织中lncRNA uc002btf 基因CPG岛中检测到甲基化位点百分数明显高于癌旁组织,差异有统计学意义(P<0.01)。见图6。
3 讨论
恶性肿瘤的发生和发展可能和一个或多个肿瘤抑制基因CpG岛甲基化或是原癌基因的低度甲基化有关[6]。临床前研究提示紫杉醇耐药的乳腺癌细胞对甲基化调节的药物仍然敏感,调节甲基化状态的药物可以作为化疗耐药患者的二线治疗方案[10]。散发型乳腺癌中10%~15%患者出现BRCA1基因启动子区高甲基化[11]。
LncRNA是指长度超过200个核苷酸的RNA,它们的表达调控肿瘤的发生和进展[7]。目前的研究证实DNA甲基化修饰、组蛋白乙酰化或甲基化修饰和染色体重构等能够在转录水平前或是转录水平调节lncRNA的表达[12]。WU等[13]报道,Barrett食管及食管腺癌组织处于低甲基化状态,其中lncRNA AFAP1-AS1的甲基化水平明显降低,通过抑制AFAP1-AS1的表达,使食管癌细胞的增殖、侵袭及克隆形成能力降低。甲基化调控lncRNA表达高低从而影响食管癌细胞的生物学行为。近年来对于lncRNA在基因表达调控网络中功能的探索,逐步揭示出lncRNA在肿瘤发生发展中所发挥的重要作用,筛选肿瘤相关的lncRNAs,lncRNAs在肿瘤诊断和治疗中拥有广阔的应用前景。本研究探讨了受甲基化调控lncRNA是否也能影响乳腺癌的发生发展。
本研究发现去甲基化乳腺癌细胞株和亲本株细胞,lncRNA和mRNA表达谱发生了显著的变化。 LncRNA qRT-PCR结果与芯片检验结果基本一致。本研究发现lncRNA基因启动子上游存在CPG岛并且变化差异性明显的lncRNA uc003lxs及uc002btf在侵袭程度高的细胞株BT549及MB231中高表达并且及基因启动子呈现低度甲基化水平,并且在乳腺癌患者组织内lncRNA uc003lxs及uc002btf高表达,基因启动子甲基化水平降低。这表明乳腺癌细胞和组织lncRNA uc003lxs及uc002btf差异表达并且和基因甲基化水平相关。根据以上的研究推测乳腺癌细胞中uc003lxs及uc002btf受甲基化调控们受甲基化调控并且可能在乳腺癌进展中发挥重要作用。但是本研究仍需要通过严谨的细胞生物学实验证实 lncRNA uc003lxs及uc002btf在乳腺癌细胞的演进中发挥促进肿瘤发生和发展的生物学作用,如增殖、凋亡、转移等特性。
本研究筛选了lncRNA uc003lxs及uc002btf分子在乳腺癌细胞和组织中的差异表达,探索lncRNA uc003lxs及uc002btf分子受启动子甲基化水平影响,发现uc003lxs及uc002btf可能是治疗乳腺癌的新靶点,应用lncRNA的甲基化状态靶向uc003lxs及uc002btf治疗乳腺癌可能是未来的一种新方法。本研究还揭示lncRNA上游崭新的调控形式,DNA区域启动子CpG岛的甲基化调控,明确lncRNA的启动子研究价值,丰富了lncRNA与表观遗传学、DNA甲基化的复杂的作用网络与分子机制。

图6 乳腺癌组织及癌旁组织的lncRNA uc003lxs和uc002btf的基因启动子上游CPG岛发生甲基化的百分数
