银杏叶聚戊烯醇金属配合物的合成及其光控活性
2021-05-11张昌伟齐志文薛兴颖王成章
张昌伟, 陶 冉, 齐志文, 沈 红, 薛兴颖, 王成章*
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局 林产化学工程重点实验室;江苏省生物质能源和材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
银杏是我国宝贵且特有的林源植物,银杏叶具有多方面重要的药理作用和经济价值,其主要的生物活性成分为黄酮、萜内酯、聚戊烯醇(PPs)和多糖等[1]。我国银杏叶产品的开发应用仍处于初始阶段,主要利用其中的黄酮和萜内酯成分,最有价值的PPs尚未开发利用。银杏叶聚戊烯醇(GBP)是由14~24个异戊烯基单元构成的桦木萜醇类PPs,由于其类似参与人体糖蛋白合成多萜醇的结构而成为了近年来的研究热点[2-4]。目前,关于GBP生物活性的研究主要集中在抗肿瘤、抑菌和抗氧化方面。王成章等[5]以GBP为原料进行抗肿瘤实验,结果发现其对A549、Hips、S180、EC和Heps等多种肿瘤细胞均具有显著的抑制活性。Zhang等[6-7]对GBP的抑菌和抗氧化活性进行研究,发现其对大肠杆菌、金黄色葡萄球菌、白色念珠菌和肺炎链球菌均具有强烈的抑制效果,并且对ABTS、DPPH、羟基自由基和超氧阴离子均具有较好的清除作用。GBP较好的生物活性使其在药品、保健品和化妆品等功能性产品领域极具开发潜力。但是,由于GBP本身相对分子质量大和疏水性强导致的低生物利用度,以及缺乏可控释放性造成的正常组织毒副性,限制了其相关功能性产品的开发和应用。研究者们主要是通过物理或者化学手段来改善GBP的亲水亲脂性,从而提高其生物利用度[8-10],但仍然无法解决其可控释放性问题。钌(Ru)多吡啶配合物因具有丰富可调的亲水亲脂性、协同增效以及时间和空间上的可控释放性等优势,在解决GBP功能性产品开发应用问题方面极具发展前景[11-13]。传统的钌多吡啶配合物主要由主配体和无生物活性的功能配体组成。近年来,通过引入生物活性分子作为可解离功能配体,在光照射后同时释放具有交联生物分子功能的钌双水合物和生物活性分子,以达到协同增效的目的,是钌多吡啶配合物发展的一大趋势。Sgambellone等[14]在钌多吡啶配合物上引入蛋白酶抑制剂或小分子化疗药物作为可解离的功能配体,在光照下实现了协同增效的目的。GBP本身较好的生物活性使其具有成为钌多吡啶配合物功能配体的潜力。但是,目前关于GBP-钌多吡啶配合物合成方面的研究在国内外鲜见报道。因此,本研究以GBP为原料合成GBP-钌多吡啶配合物,并综合考察其脂水分配系数、光致配体解离能力和光控抗肿瘤活性,以期为GBP功能性产品的高值化开发和应用提供新思路。
1 材料与方法
1.1 试剂与仪器
聚戊烯醇标准品(99.8%),购自瑞典Larodan Fine Chemicals Co., Ltd.;人体肺癌细胞A549,购自中国普通微生物菌种保藏管理中心;改良伊格尔(DMEM)培养基、发光法细胞活力检测试剂盒、基因组全提取试剂盒、硅胶(45~75 μm),均购自阿拉丁试剂(上海)有限公司;三乙胺(TEA)、四氢呋喃(THF)、甲基磺酰氯(MsCl)、顺-二(2,2′-联吡啶)二氯化钌、2,2′-联吡啶、氯化锂、N,N-二甲基甲酰胺、无水丙酮、乙醇、石油醚、乙酸乙酯、三氯甲烷、甲醇、六氟磷酸铵、乙腈、氰化钠(NaCN)、无水硫酸钠等,均为市售分析纯。
HAD-FD-CNMR-I核磁共振仪,北京恒奥德仪器仪表有限公司;UV-1800紫外可见分光光度计,上海精密仪器仪表有限公司;TECAN M1000酶标仪,北京龙跃生物科技发展有限公司。
1.2 氰基聚戊烯醇的合成
称取1.00 g聚戊烯醇和0.55 g的TEA放入20 mL的THF中,然后在0 ℃条件下逐滴加入0.62 g的MsCl,得到的混合物在0 ℃条件下搅拌1 h。经层析剂石油醚/乙酸乙酯(体积比10 ∶1)、产物比移值为0.55的薄层色谱(TLC)显示聚戊烯醇被完全消耗,并且形成许多新斑点。将混合物进行水洗、浓缩,得到的1.35 g中间产物(如图1所示结构)溶解在THF中。
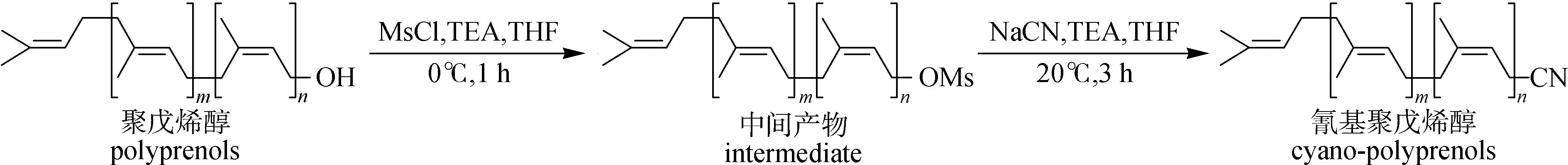
图1 氰基聚戊烯醇合成路线
将含有1.35 g中间产物的THF溶液和0.68 g的TEA加入20 mL的THF中,然后在0 ℃条件下逐滴加入0.41 g的NaCN,得到的混合物在20 ℃下搅拌3 h。经层析剂石油醚/乙酸乙酯(体积比10 ∶1)、产物的比移值为0.65的薄层色谱(TLC)显示反应物完全反应。向反应后的混合物中依次倒入20 mL水和30 mL乙酸乙酯;合并的有机层用20 mL饱和氯化钠溶液洗涤,经无水硫酸钠干燥、过滤并减压浓缩,得到黄色油状液体;黄色油状液体通过硅胶柱色谱(洗脱剂为石油醚/乙酸乙酯,体积比10 ∶1)进行纯化,得到的0.50 g化合物为黄色油状液体,即为氰基聚戊烯醇。
1.3 聚戊烯醇-钌多吡啶配合物的合成
称取42 mg氰基聚戊烯醇和12.6 mg氢氧化钾置于12 mL 水/乙醇(体积比1 ∶3)的混合溶液中,采用集热式恒温加热磁力搅拌器搅拌30 min后,加入100 mg顺-二(2,2′-联吡啶)二氯化钌(cis-Ru(bpy)2Cl2),回流2 h,旋蒸除去溶剂,得到浓缩物0.05 g。称取1.5 g硅胶(45~75 μm)装入硅胶柱(1 cm×30 cm),将浓缩物用少量乙醇溶解后加入硅胶柱中,用50 mL三氯甲烷/乙醇(体积比100 ∶4)进行洗脱(流速2.5 mL/min)分离。收集的化合物溶于乙醇,加入NH4PF6后产生固体沉淀,用滤纸过滤,收集红色沉淀,再用水洗涤,干燥,即得聚戊烯醇-钌多吡啶配合物(如图2所示)。
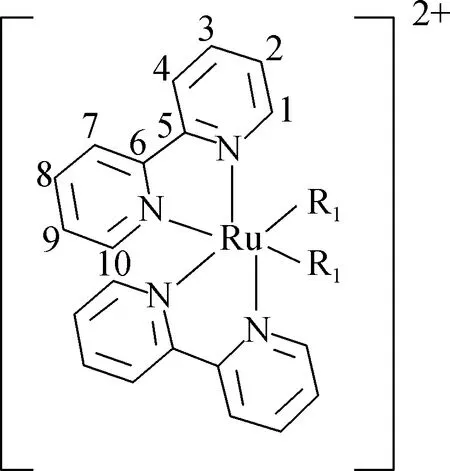
R1=聚戊烯醇polyprenols图2 聚戊烯醇-钌多吡啶配合物Fig.2 Polyprenols-ruthenium polypyridine complex
1.4 样品表征及性能分析
1.4.1NMR分析 将氰基聚戊烯醇用CDCl3溶解,然后进行1H NMR和13C NMR分析。将聚戊烯醇-钌多吡啶配合物用CD4O溶解,然后进行1H NMR和13C NMR分析。
1.4.2脂水分配系数测定 脂水分配系数是指化合物在水相和脂相的溶解分配率,通过测定该系数可以反映化合物穿透细胞膜的能力。分别取聚戊烯醇(10.6 mg/L)和聚戊烯醇-钌多吡啶配合物(24.8 mg/L)的1 mL水溶液,加入1 mL正辛醇,超声波(功率100 W)处理30 min使其在两相间平衡。离心后,用紫外吸收光谱测定配合物在两相中的浓度。根据公式(1)计算脂水分配系数,最终结果取3次测定平均值。
P=C0/Cw
(1)
式中:C0—配合物在正辛醇相中的质量浓度,g/L;Cw—配合物在水相中的质量浓度,g/L。
1.4.3光致配体解离实验 首先将配合物溶液放置在黑暗条件下24 h,测定配合物溶液放置前后的紫外吸收光谱变化。然后将配合物放置在波长大于450 nm的可见光下照射90 min,每隔6 min测定配合物的紫外吸收光谱,根据其紫外吸收光谱随光照时间的变化情况分析其是否具有光致配体解离能力。光致配体解离实验所用光源为太阳能模拟器,用470 nm滤光片截掉短波光。
1.4.4细胞毒性实验 人体肺癌细胞A549在含有10%胎牛血清、1%青霉素和1%链霉素的DMEM培养基中培养。培养箱温度为37 ℃,CO2体积分数为5%。A549细胞按每孔2×105个种在96孔板中,生长24 h。加入含有不同聚戊烯醇-钌多吡啶配合物浓度(0.78、 1.56、 3.13、 6.25、 12.5、 25、 50、 100、 200 μmol/L)培养基,培养12 h后,用15 W LED灯(470 nm)光照30 min,以未进行光照的聚戊烯醇作为对照组。再将细胞培养48 h后,加入发光法细胞活力检测试剂盒测定细胞存活率。用多功能酶标仪检测最终发光,配合物的细胞抑制率计算公式如下:
(2)
式中:y—细胞抑制率,%;A1—实验组吸光度;A2—对照组吸光度;A0—空白组吸光度。
2 结果与分析
2.1 氰基聚戊烯醇表征结果

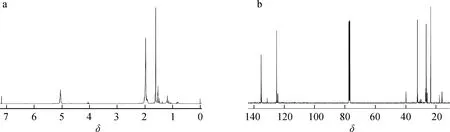
图3 氰基聚戊烯醇的氢谱(a)和碳谱(b)图
2.2 聚戊烯醇-钌多吡啶配合物的表征结果
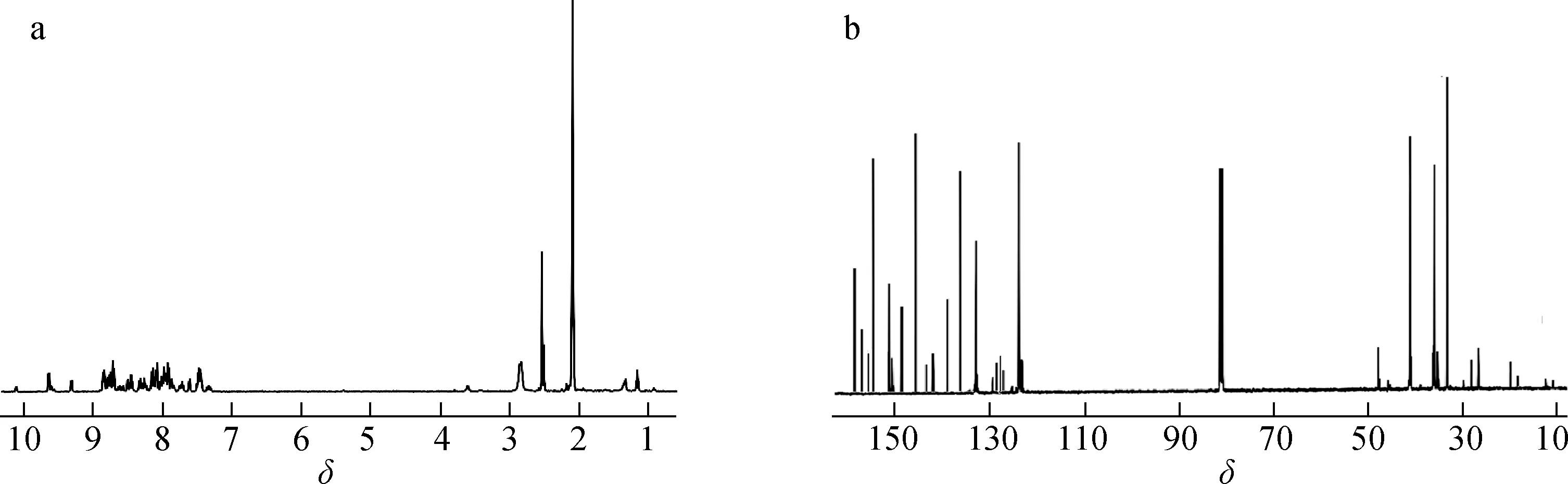
图4 聚戊烯醇金属配合物的的氢谱(a)和碳谱(b)图
2.3 聚戊烯醇-钌多吡啶配合物的性能分析
聚戊烯醇-钌多吡啶配合物的性能主要包括脂水分配系数、光/暗稳定性和光致配体解离能力。脂水分配系数在0~3的范围内亲水亲脂性最优,最适于穿透细胞膜。经过分析发现,聚戊烯醇和聚戊烯醇金属配合物的脂水分配系数分别为5.86和1.35。聚戊烯醇为强疏水性化合物,很难透过细胞膜,经过改性后得到的配合物亲水性增强,有利于其穿透细胞膜,更易于被细胞吸收利用。一个理想的光敏剂应该具有很好的暗稳定性,聚戊烯醇金属配合物溶液在黑暗条件下放置24 h前后的吸收光谱,如图5(a)所示。由图可知,聚戊烯醇金属配合物的吸收光谱在放置24 h之后几乎没发生变化,由此表明聚戊烯醇金属配合物具有较好的暗稳定性。但在可见光(波长≥470 nm)的照射下,聚戊烯醇金属配合物的吸收光谱随光照时间延长表现出如图5(b)所示规律性变化。聚戊烯醇金属配合物在480 nm处出现明显的等吸收点,表明有新产物生成。随着光照的进行,聚戊烯醇金属配合物逐渐发生配体解离,当光照到90 min后配合物的最大吸收峰红移到490 nm,是典型的Ru(Ⅱ)(bpy)双水合物[Ru(bpy)2(H2O)2]2+的特征吸收峰[15],表明氰基聚戊烯醇配体发生了解离。
2.4 聚戊烯醇金属配合物的光控抗肿瘤活性
图6为聚戊烯醇金属配合物浓度与A549肿瘤细胞抑制率之间的关系。
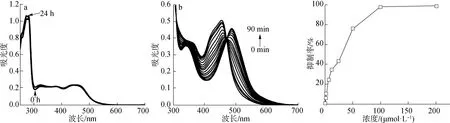
图5 聚戊烯醇金属配合物在黑暗(a)和光照(b)条件下的紫外吸收光谱变化
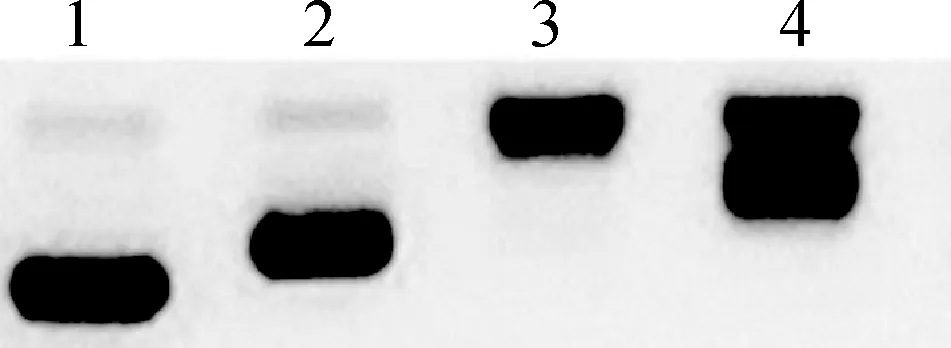
1.DNA; 2.5 μmol/L; 3.10 μmol/L; 4.20 μmol/L图7 不同浓度配合物与DNA作用后的电泳图Fig.7 Gel electrophoresis image of complexes with different concn. after being interacted with DNA
由图6可知,随着配合物浓度的增加,其对肿瘤细胞的抑制率先是急剧增加然后增加变缓。经过分析可知,聚戊烯醇和聚戊烯醇金属配合物对A549肿瘤细胞的半数抑制浓度(IC50)分别为45.8和29.3 μmol/L,说明聚戊烯醇和聚戊烯醇金属配合物均具有较好的A549肿瘤细胞抑制活性。此外,配合物展示出更好的抗A549肿瘤细胞活性,说明配合物在光致解离的同时释放聚戊烯醇和钌多吡啶配合物,这两者可起到协同抗肿瘤的效果。在此基础上,利用基因组全提取试剂盒对A549肿瘤细胞的DNA进行了提取,并通过琼脂糖凝胶电泳实验研究了不同浓度聚戊烯醇金属配合物与该DNA之间的相互作用,结果如图7所示,条带1对应的是A549肿瘤细胞DNA,条带2、 3、 4分别对应的是5、 10、 20 μmol/L 的配合物。由图7可以明显的看出条带1跑到了条带2的前面,因此可以判断低浓度配合物共价结合DNA后,导致DNA迁移速率减慢(条带2)。而在高浓度下,DNA发生单链断裂,导致条带形状发生了改变(条带3和条带4)。因此,推断聚戊烯醇金属配合物的A549肿瘤细胞抑制活性极有可能与其DNA结合能力有关。
3 结 论
以银杏叶聚戊烯醇为原料,成功合成了氰基聚戊烯醇和聚戊烯醇-钌多吡啶配合物。合成的配合物具有较好的脂水分配系数(1.35),有利于其穿透细胞膜。此外,合成的配合物展示出较好的光致配体解离能力和光控抗肿瘤活性,其对A549肿瘤细胞的半数抑制浓度(IC50)29.3 μmol/L。并且,聚戊烯醇金属配合物的光控抗肿瘤活性极有可能与其DNA结合能力有关。实验的研究结果对于解决银杏叶聚戊烯醇的生物利用度和可控释放问题具有重要的参考意义,同时也可为其功能产品的开发提供理论参考和技术支撑。
