4-酰基吡唑啉酮-5缩γ-氨基丁酸衍生物的合成及对白玉菇菌丝脱氢酶活性影响
2022-08-05王鑫史芯沂美谢芬兰付壮朱华玲班立桐
王鑫,史芯沂美,谢芬兰,付壮,朱华玲,,班立桐
4-酰基吡唑啉酮-5缩γ-氨基丁酸衍生物的合成及对白玉菇菌丝脱氢酶活性影响
王鑫a,史芯沂美a,谢芬兰a,付壮a,朱华玲a,通信作者,班立桐b
(天津农学院a. 基础科学学院,b. 农学与资源环境学院,天津 300392)
采用结构拼接法设计合成了4-三氟乙酰-3-甲基-1-苯基-5-吡唑啉酮缩γ-氨基丁酸(L1)、1-苯基-3-甲基-4-苯甲酰基-5-吡唑啉酮缩γ-氨基丁酸(L2)两种新配体,以及两个配体的Ca、Zn配合物。采用红外分光光度法和紫外分光光度法对合成的6种化合物进行了结构表征,采用MTT法测定了6种化合物对白玉菇菌丝脱氢酶活性的影响。结果表明:6种化合物对白玉菇菌丝脱氢酶的活性均有抑制作用,其中配体L2对白玉菇菌丝脱氢酶活性的抑制能力最强,配体L1最差;采用分子对接法研究了菌丝脱氢酶与原始配体泛醌,以及配体L1和L2的相互作用,发现两个新配体与菌丝脱氢酶的结合能力均好于原始配体泛醌,且配体L2好于配体L1。该结果与MTT试验结果一致,说明配体L1和配体L2可能是通过与泛醌进行结合竞争表现出对琥珀酸脱氢酶的抑制活性。
γ-氨基丁酸; 衍生物; 合成; 表征; 白玉菇; 菌丝脱氢酶活性
γ-氨基丁酸,别名4-氨基丁酸,简称GABA,具有降低神经元活性、防止神经细胞过热以及降低血压的作用[1-3],还具有防止动脉硬化、调节心律失常、降低血脂、增强肝功能等生理功效,对癫痫、惊厥、亨廷顿病和帕金森病等多种神经性疾病具有一定的疗效[4-8]。近年来,GABA作为一种新型功能性因子,广泛应用于药品、保健品以及食品工业等领域[9-12]。4-酰基吡唑啉酮是一类重要的β-二酮含氮杂环体系,可与醛、肼以及胺类化合物反应形成稳定的席夫碱化合物,具有共轭体系大、配位活性高、毒性低等特点,在配位化学、生命科学、生物医学等领域有着广泛的应用前景[13-16]。
将γ-氨基丁酸引入吡唑啉酮的药物分子中设计合成γ-氨基丁酸吡唑啉酮衍生物及金属配合物,具有潜在的药学应用和营养价值。本研究采用结构拼接法设计合成γ-氨基丁酸缩芳基吡唑酮配体及金属配合物,并进一步研究其对白玉菇菌丝脱氢酶活性的影响,旨在为琥珀酸脱氢酶抑制剂的筛选提供参考。
1 材料与方法
1.1 材料
1.1.1 试材
γ-氨基丁酸(99%)、噻唑蓝/MTT(98%),上海源叶生物科技有限公司;4-三氟乙酰-3-甲基-1-苯基-5-吡唑啉酮(>96.0%),东京化成工业株式会社;1-苯基-3-甲基-4-苯甲酰基-5-吡唑啉酮(分析纯),国药集团化学试剂有限公司;五水氯化钙(分析纯),天津市奥淇医科医药销售公司;乙酸锌(分析纯),天津市北方天医化学试剂厂;无水乙醇(分析纯)、二甲基亚砜(分析纯),天津基准化学试剂有限公司。
马铃薯购于天津市南开区华润万家(王顶堤店)。
1.1.2 仪器
恒温鼓风干燥器,天津市华北科技仪器公司;DX-35BI立式压力蒸汽灭菌器;ZHJH-C1214C超净工作台;PHS-3C pH计,上海精科;HH-3数显恒温水槽,江苏省金坛市荣华仪器制造有限公司;FTIR-850红外光谱仪、电子天平(AUY220),日本岛津公司;Q2ION紫外光谱仪,德国布鲁克公司。
1.2 方法
1.2.1 配体的合成
准确称取2 mmol 4-三氟乙酰-3-甲基-1-苯基-吡唑啉酮-5,置于圆底烧瓶中,加入25 mL无水乙醇,搅拌使其溶解。另准确称取2 mmol γ-氨基丁酸,置于烧杯中,加入25 mL无水乙醇,搅拌并微热使其溶解。搅拌同时将含有γ-氨基丁酸的乙醇溶液滴加到4-三氟乙酰-3-甲基-1-苯基-吡唑啉酮-5溶液中,滴加完毕后继续搅拌0.5 h,然后在85 ℃水浴中回流反应6 h,结束后趁热过滤,滤液置于干净干燥的小烧杯中,滤纸封口,室温自然蒸发,所得产物即为配体L1。配体L2的合成与配体L1相似,只需将4-三氟乙酰-3-甲基-1-苯基-吡唑啉酮-5替换成1-苯基-3-甲基- 4-苯甲酰基-5-吡唑啉酮即可。
1.2.2 配合物的合成
准确称取0.2 mmol配体L1置于圆底烧瓶中,加入40 mL无水乙醇,搅拌并微热使之溶解。另准确称取0.1 mmol乙酸锌置于烧杯中,加入15 mL无水乙醇,搅拌并微热使其溶解。搅拌下将乙酸锌溶液逐滴加到配体L1溶液中,滴加完毕后继续搅拌0.5 h,然后在90 ℃水浴中回流反应3 h,结束后趁热过滤,滤液置于干净干燥的小烧杯中,滤纸封口,室温自然蒸发,所得产物即为配体L1-Zn配合物。将上述步骤中的乙酸锌替换成无水氯化钙,可得配体L1-Ca配合物。将配体L1替换成配体L2,可得配体L2-Zn配合物和配体L2-Ca配合物。
1.2.3 化合物结构表征
1.2.3.1 红外可见光谱分析
在波数4 000~400 cm-1范围内,利用FTIR- 850型红外光谱仪采用KBr压片法对配体L1、配体L2及其Ca、Zn的配合物,进行光谱扫描。
1.2.3.2 紫外可见光谱分析
以无水乙醇为溶剂,配制质量浓度为2.5 g/L 的配体L1、配体L2及其Ca、Zn配合物溶液。以无水乙醇溶液做参比溶液,用Q2ION紫外光谱仪在波长200~400 nm范围内对上述溶液进行紫外光谱扫描。
1.2.4 生物活性测试
1.2.4.1 试验准备
(1)配制溶液。分别称取一定量的配体L1,配体L2以及其Ca、Zn配合物,用无水乙醇溶解并配制各合成物溶液质量浓度为2.5 g/L。
(2)配制PDA固体培养基。将马铃薯洗净去皮,称取200 g,切成约1 cm的正方形小块,加水煮烂(煮沸20~30 min,能被玻璃棒戳破即可),用8层纱布过滤,在滤液中加入20 g琼脂,继续加热搅拌混匀,待琼脂溶解完全后,加20 g葡萄糖,搅拌均匀,稍冷却后补足蒸馏水至1 000 mL,分装,115 ℃灭菌25 min,取出后倒平板,冷却后备用。
(3)菌丝的活化及培养。在无菌环境下,在超净台上将白玉菇菌种接种到PDA平板中,封口膜封口,25 ℃,55%相对湿度下培养14 d,所得菌丝用于琥珀酸脱氢酶活性测试试验。
1.2.4.2 菌丝脱氢酶活性测试
采用MTT法测试菌丝脱氢酶活性。准确称取0.01 g从斜面培养基表面刮取的白玉菇菌丝体,放入10 mL离心管中,向离心管中加入4 mL蒸馏水、0.4 mL 2.5 g/L的MTT溶液、0.2 mL待测化合物溶液,避光35 ℃水浴,静置2 h,用注射器抽走溶液,仅保留菌丝,然后加入4 mL DMSO,充分振荡20 min(直至菌丝体褪色至白色)。用紫外可见分光光度计在490 nm波长处测定离心管中DMSO溶液的吸光度,以溶剂DMSO作为参比溶液,以蒸馏水替代待测化合物溶液的离心管为空白对照,计算各吸光度的平均值,并按公式(1)计算抑制率。
抑制率(%)=[(空白对照处理-药剂处理)/空白对照处理]×100…………………………(1)
1.2.5 分子对接研究
从蛋白质晶体数据库(http://www.rcsb.org)下载琥珀酸脱氢酶(PDB编码为1NEK)晶体数据,在Autodock-tools 1.5.6软件[17-18]中通过去水、删除原始配体(泛醌)、添加非极性氢和电荷、设置原子AD4类型等处理,保存为PBDBQT文件,作为受体。采用Chemdraw软件绘制配体(L1和L2)分子结构,Chem3D软件转化为三维构象,Autodock-tools 1.5.6软件将优化后的三维结构打开,通过去水、添加电荷和非极性氢等处理,保存为PBDBQT文件,作为配体。泛醌作为对照配体,进行对接研究。
运行Autogrid程序,以中心坐标(87.391,96.108,103.607),格点盒子(Grid Box)为50× 46×66,格点间距为0.037 5 nm,进行格点地图运算。采用拉马克遗传算法(Lamarckian GA),运用Autodock进行分子对接,选择最佳对接构象进行结果分析。
2 结果与分析
2.1 红外光谱分析
2.1.1 配体
对合成的两个配体在400~4 000 cm-1波数范围内进行红外光谱表征,结果如图1所示。
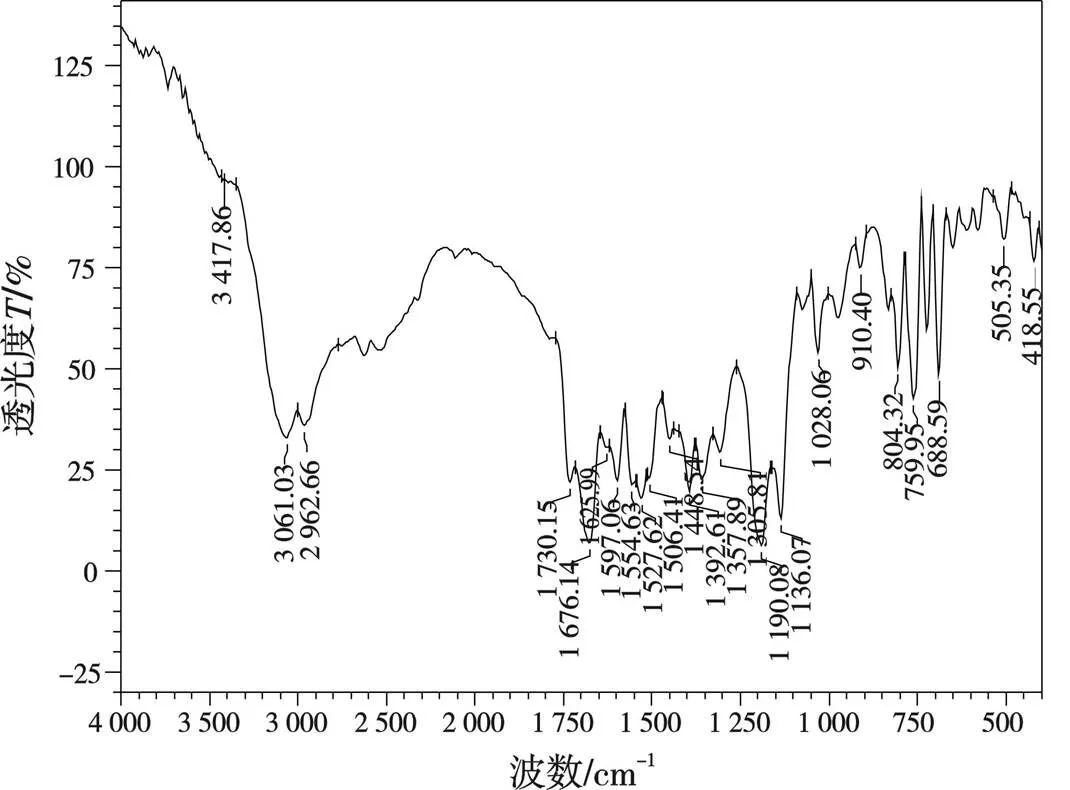
图1 配体L1(左)和L2(右)的红外光谱
由图1可见,3 417.86、3 442.94 cm-1处为—OH的伸缩振动峰,3 061.03、3 057.17cm-1处为芳环H的伸缩振动峰,2 962.66、2 958.80 cm-1处为—CH3伸缩振动峰,2 937.59、2 926.01 cm-1处为—CH2伸缩振动峰,1 730.15、1 722.43 cm-1处为C=O的伸缩振动峰,1 676.14、1 614.42 cm-1处为酰胺 C=O的伸缩振动峰,1 597.06、1 591.27 cm-1处为苯环骨架的伸缩振动峰,688.59、692.44 cm-1处为单取代苯环的弯曲振动峰。据此可推测得到合成的配体化合物结构,如图2所示。
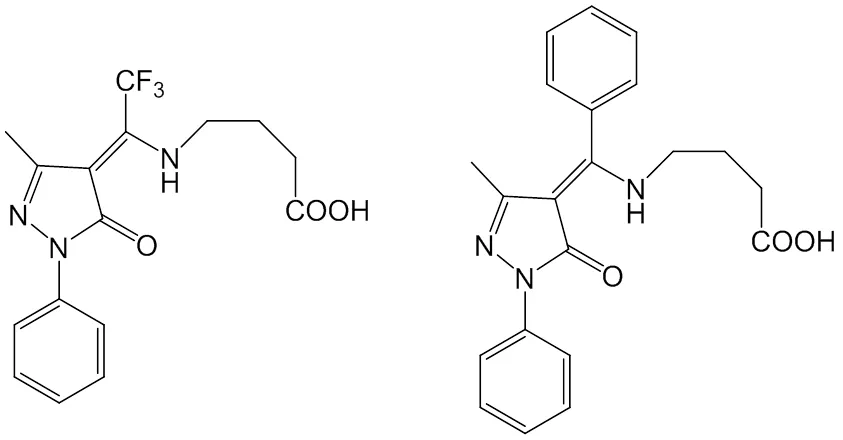
图2 配体L1(左)和L2(右)的结构式
2.1.2 配合物
对合成的两个配体的Ca、Zn配合物在400~ 4 000 cm-1波数范围内进行了红外光谱表征,其红外谱图如图3~图4所示。将各化合物的红外特征峰进行汇总,得到表1所示的配体及配合物的部分红外光谱峰数据。
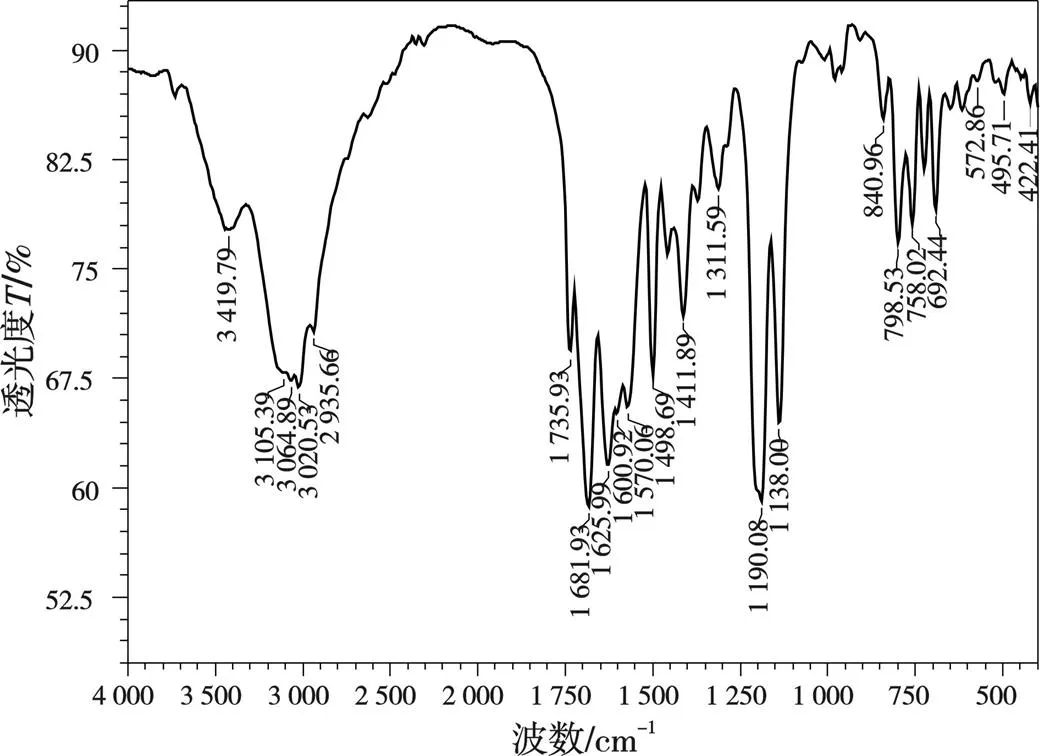
图3 配体L1(左)和L2(右)钙配合物的红外光谱
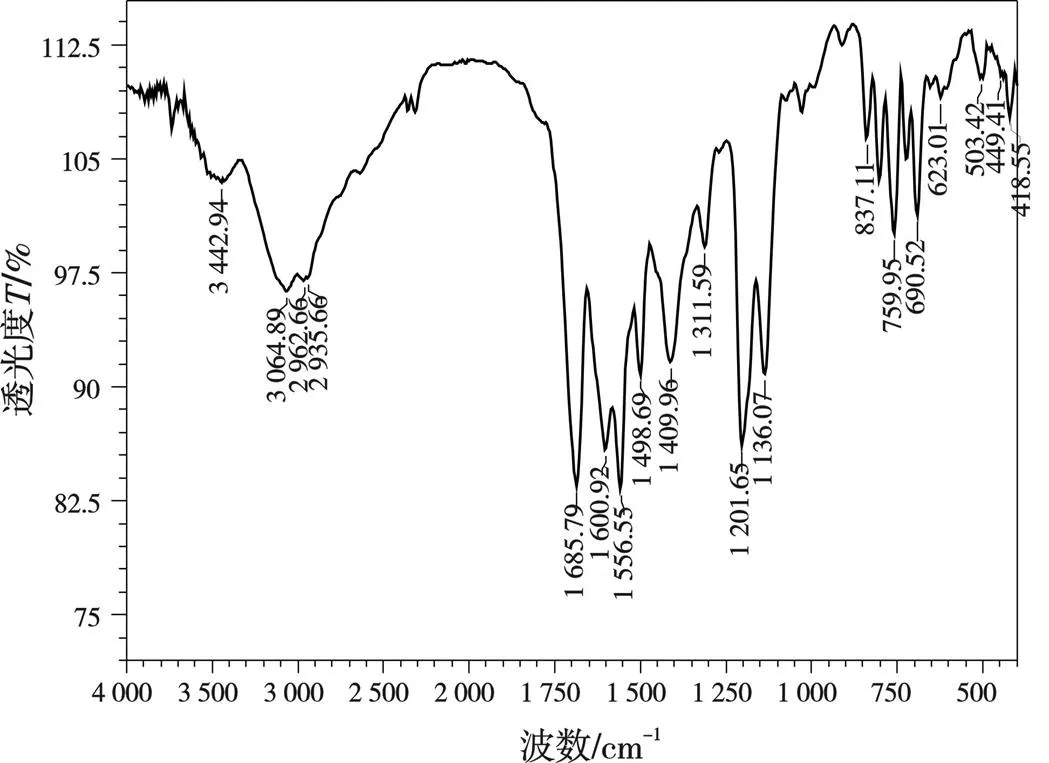
图4 配体L1(左)和L2(右)锌配合物的红外光谱
表1 配体及配合物的部分红外光谱数据 cm
化合物ν—OHνph—Hν—CH3νC=Oν酰胺C=Oν单取代苯νM—OνN—M L1+Ca3 419.793 064.892 935.661 735.931 681.93692.44572.86495.71 L1+Zn3 419.793 064.892 962.661 693.501 683.86692.52503.42453.27 L13 417.863 061.032 962.661 730.151 676.14688.59—— L2+Ca3 400.503 057.172 926.011 705.071 620.21700.16507.28445.56 L2+Zn3 427.513 059.102 926.011 714.721 610.56692.44509.21443.63 L23 442.943 057.172 926.011 722.431 614.42692.44——
注:表中“—”表示不出现
分析图3~图4和表1数据可以发现,Ca、Zn配合物的光谱图在453.27~495.71、443.63~445.56 cm-1出现M—N的配位峰,在503.42~572.86、507.28~509.21 cm-1出现M—O的配位峰,表明金属离子配位成功。配合物谱图中3 419.79、3 400.50~3 427.51 cm-1处为O—H的伸缩振动峰,1 693.50~1 735.93、1 705.07~1 714.72 cm-1处为 C=O的伸缩振动峰,而配体的O—H伸缩振动峰在3 417.86、3 442.94 cm-1,C=O的伸缩振动峰在1 730.15、1 722.43 cm-1。与配体相比,配合物的O—H和C=O伸缩振动峰发生明显移动,表明O—H、N—H和C=O参与配位。据此可以推断出所合成配合物的结构式,如图5所示。
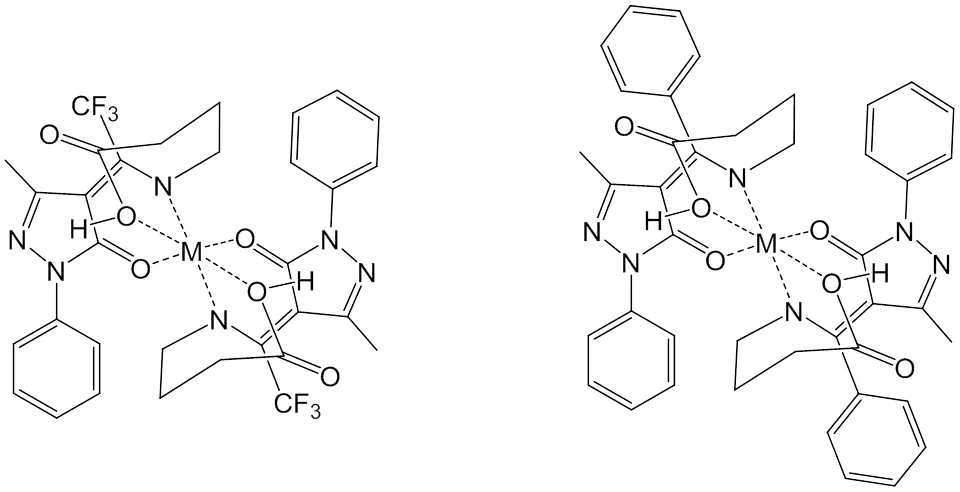
图5 配体L1(左)和L2(右)所合成配合物的结构式
2.2 配体及配合物的紫外表征分析
以无水乙醇为溶剂,在波长200~400 nm范围处对配体及其金属配合物进行紫外光谱测定,结果如表2所示。从表2可以看出,在200~400 nm范围内,对合成的化合物进行紫外光谱测定,在化合物的紫外光谱上,202~207 nm范围吸收峰为K带,多含有共轭双键,归属于σ→π*跃迁。配 体与其配合物相比,发生了移动,表明配位反应成功。
表2 配体及配合物的紫外光谱数据 nm
化合物λmax K带B带R带 L1+Ca203253290 L1+Zn207251290 L1202252284 L2+Ca202253301 L2+Zn202252302 L2207251289
由表2可知,240~260 nm范围吸收峰为B带,是芳香族化合物的特征吸收峰,归属于ππ*跃迁。配体与其配合物相比,吸收峰发生了变化,说明发生了反应。284~302 nm范围吸收峰为R带,可能含C=O、—N=O、—N=N—等基团,归属于nπ* 跃迁,配体与其配合物相比,发生了红移,表明配位反应成功。综上所述,化合物应存在双键,可能含有苯环等结构。
2.3 MTT法测定菌丝脱氢酶活性结果分析
采用分光光度法在490 nm处测定各待测化合物与菌丝脱氢酶作用后DMSO溶液的吸光度。吸光度值越低,抑制率越大,表明该化合物对菌丝脱氢酶抑制能力越强。MTT法测定各化合物吸光度和抑制率数据如表3所示。
表3 MTT法测定化合物的吸光度和抑制率
化合物吸光度平均值抑制率/% L10.0960.1280.0760.10053.5 L1+Zn0.0700.0960.0840.08361.4 L1+Ca0.0670.0890.0760.07764.2 L20.0540.0560.0810.06470.2 L2+Zn0.0740.0720.0890.07863.7 L2+Ca0.0550.0680.1400.08859.1 Blank0.2550.1820.2080.215 0.0
由表3可知,合成的6个化合物对白玉菇菌丝脱氢酶活性均有一定的抑制能力,抑制能力由大到小的顺序依次是:L2>L1+Ca>L2+Zn>L1+Zn>L2+Ca>L1。对两个配体而言,L2抑制效果远好于L1。配体与配合物相对比,L2好于其配合物,而L1弱于其配合物。
2.4 分子对接结果分析
分子对接法是利用空间结构互补和能量最小化原则在受体活性位点区域进行配体构象搜寻,进而确定配体与受体能否产生相互作用以及它们之间的最佳结合模式,该方法是研究酶与配体之间相互作用的重要手段之一[19]。本试验中以琥珀酸脱氢酶为受体,将原始配体泛醌、配体L1和配体L2分别对接到琥珀酸脱氢酶分子的活性中心,得到了对接的最稳定构象和最低对接能,结果如表4和图6所示。
表4 配体与琥珀酸脱氢酶的分子对接结果
配体泛醌配体L1配体L2 最低对接能/kJ∙mol-1-23.56-29.19-34.10 抑制常数/μm 77.78 8.08 1.12
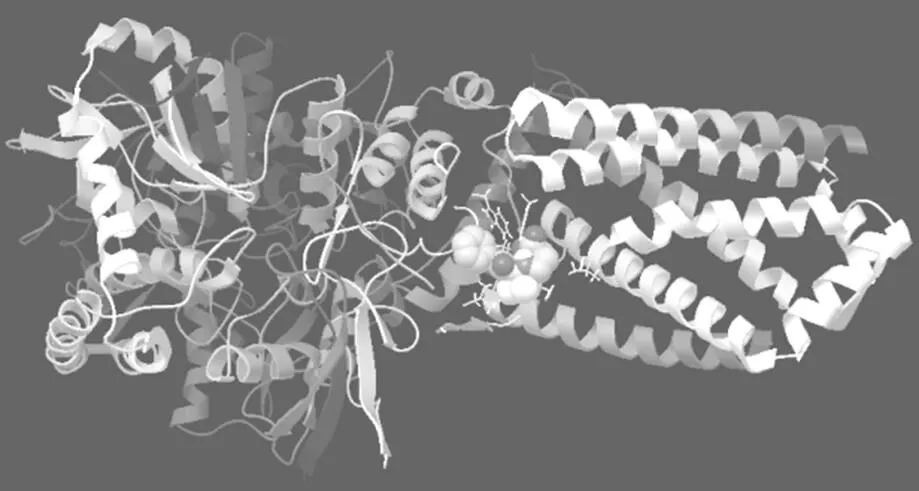
图6 配体L1(左)和配体L2(右)与琥珀酸脱氢酶对接的最稳定构象
从表4和图6可以看出,配体L1、配体L2与琥珀酸脱氢酶的最低对接能低于原始配体泛醌与琥珀酸脱氢酶的最低对接能,表明配体L1、配体L2与琥珀酸脱氢酶的对接能力好于原始配体泛醌。配体L1与琥珀酸脱氢酶的最低对接能高于配体L2与琥珀酸脱氢酶的最低对接能,表明配体L2与琥珀酸脱氢酶的对接能力好于配体L1。从抑制常数的大小来看,也具有这样的特点。此结果与MTT试验结果一致,说明配体L1和配体L2可能是通过与泛醌进行结合竞争表现出对琥珀酸脱氢酶的抑制活性。
3 结论
本研究中通过结构拼接方法将γ-氨基丁酸引入吡唑啉酮的药物分子中,设计合成了γ-氨基丁酸吡唑啉酮衍生物及金属配合物,利用红外吸收光谱、紫外可见吸收光谱对化合物进行了结构表征,并采用MTT法测定了6种化合物对白玉菇菌丝脱氢酶活性的影响。研究发现,6种化合物对白玉菇菌丝脱氢酶的活性均有抑制作用,其中配体L2对白玉菇菌丝脱氢酶活性的抑制能力最强,配体L1最差。采用分子对接法研究了菌丝脱氢酶与泛醌、配体L1、配体L2的相互作用,发现两个配体与菌丝脱氢酶的结合能力均好于原始配体泛醌,且配体L2好于配体L1,此结果与MTT试验结果一致。说明配体L1和配体L2可能是通过与泛醌进行结合竞争表现出对琥珀酸脱氢酶的抑制活性。
[1] WONG C G T,BOTTIGLIERI T,SNEAD O C. GABA,gamma-hydroxybutyric acid,and neurological disease[J]. Ann Neurol,2003,54(Suppl 6):S3-S12.
[2] 程传兴,刘晓飞,王薇. γ-氨基丁酸的生理功能及制备方法[J]. 哈尔滨商业大学学报(自然科学版),2017,33(6):693-697.
[3] 李珂,徐恩. γ-氨基丁酸在中枢神经系统发育中的作用及机制[J]. 神经科学通报(英文版),2008,24(3):195-200.
[4] 杨胜远,陆兆新,吕风霞,等. γ-氨基丁酸的生理功能和研究开发进展[J]. 食品科学,2005,26(9):546-551.
[5] PRIYA M,SHARMA L,KAUR R. et al. GABA (γ- aminobutyric acid),as a thermo-protectant,to improve the reproductive function of heat-stressed mungbean plants[J]. Sci Rep,2019,9(1):7788-7802.
[6] 林亲录,王婧,陈海军. γ-氨基丁酸的研究进展[J]. 现代食品科技,2008,24(5):496-500.
[7] 王姣姣,白卫东,梁彬霞. γ-氨基丁酸的生理功能及富集的研究进展[J]. 农产品加工(学刊),2012(1):40-42,45.
[8] SHILPA J,PRETTY M A,ANITHA M,et al. Gamma aminobutyric acid B and 5-hydroxy tryptamine 2A receptors functional regulation during enhanced liver cell proliferation by GABA and 5-HT chitosan nanoparticles treatment[J]. Eur J Pharmacol,2013,715(1/3):154-163.
[9] GAO Z F,XIE W J,ASHRAF U,et al. Exogenous γ-aminobutyric acid(GABA)application at different growth stages regulates 2-acetyl-1-pyrroline,yield,quality and antioxidant attributes in fragrant rice[J]. J Plant Interact,2020,15(1):139-152.
[10] 王辉,项丽丽,张锋华. γ-氨基丁酸(GABA)的功能性及在食品中的应用[J]. 食品工业,2013,34(6):186-189.
[11] ZHOU L,YAN P,BINGRU H. Alteration of transcripts of stress-protective genes and transcriptional factors by γ- aminobutyric acid(GABA)associated with improved heat and drought tolerance in creeping bentgrass()[J]. Int J Mol Sci,2018,19(6):1623-1640.
[12] 张亚青. 高产γ-氨基丁酸(GABA)食用菌资源的筛选与利用[D]. 杭州:浙江科技学院,2020.
[13] 李俊华. 有机催化构建新型吡唑啉酮衍生物的研 究[D]. 北京:北京理工大学,2019.
[14] OKAFOR E C. The metal complexes of heterocyclic β-diketones and their derivatives-VI. The synthesis, structure and i.r. spectral studies of some new metal(II)complexes of 1- phenyl-3-methyl-4-benzoyl-pyrazolone-5(HPMBP)[J]. Spectrochimica Acta Part A Molecular Spectroscopy,1981,37(11):945-950.
[15] MARCHETTI F,PETTINARI C,PETTINARI R. Acylp- yrazolone ligands:Synthesis,structures,metal coordination chemistry and applications[J]. Coordin Chem Rev,2005,249(24):2909-2945.
[16] 李锦州,蒋礼,安郁美. 呋喃甲酰基吡唑啉酮缩β-丙氨酸配合物的合成、表征及生物活性[J]. 应用化学,2004,21(2):150-153.
[17] SANNER M F. Python:A programming language for software integration and development[J]. J Mol Graph Model,1999,17(1):57-61.
[18] MORRIS G M,HUEY R,LINDSTROM W,et al. Autodock4 and AutoDockTools4:Automated docking with selective receptor flexiblity[J]. J Computat Chem,2009,30(16):2785-2791.
[19] 刘举,宫雪,徐亮,等. 光谱法联合分子对接研究人血清白蛋白与新的抗肿瘤活性小分子的体外结合[J]. 分析测试学报,2018,37(4):20-27.
Synthesis of the derivatives from 4-acylpyrazolone-5 and γ-aminobutyric acid and their effects on the dehydrogenase activity ofmycelia
Wang Xina, Shi Xinyimeia, Xie Fenlana, Fu Zhuanga, Zhu Hualinga, Corresponding Author, Ban Litongb
(Tianjin Agricultural University, a. College of Basic Sciences, b. College of Agronomy and Resource Environment, Tianjin 300392, China)
A new ligand(L1)derived from γ-aminobutyric acid and 4-trifluoroacetyl-3- methyl-1-phenyl-5-pyrazolone, and a new ligand(L2)derived from γ-aminobutyric acid and 1-phenyl-3-methyl-4-benzoyl-5-pyrazolone were synthesized and characterized by IR and UV, so did their Ca, Zn complexes. The inhibititted effect of the compounds on the mycelium dehydrogenase activity ofwas determined by MTT methods. The results showed that ligand L2 had stronger inhibitition ability to mycelium dehydrogenase while ligand L1 was the weaker. Molecular docking method was used to analysize the interaction of the mycelium dehydrogenase and the ligands. The results suggested that the two new ligands showed higher interactions to mycelium dehydrogenase than original ubiquinone, and ligand L2 showed higher interactions to mycelium dehydrogenase than ligand L1.
γ-aminobutyric acid; derivatives; synthesis; scharacterization;; dehydrogenase activity
1008-5394(2022)02-0001-06
10.19640/j.cnki.jtau.2022.02.001
O621.1
A
责任编辑:宗淑萍
