钌取代的磷钼钒多金属氧酸盐在γ-戊内酯制备中的性能研究
2021-05-11邵雪婷时君友段喜鑫
邵雪婷, 孙 钟, 时君友, 段喜鑫*
(1.北华大学 材料科学与工程学院,吉林 吉林 132013; 2.东北电力大学 化学工程学院,吉林 吉林 132012)
γ-戊内酯(GVL)被认定是一种重要的生物衍生平台化学品,既可以用作燃料添加剂,也可以通过化学转化制备高级烃类燃料。同时GVL也是目前最具前景的生物质转化绿色溶剂,不但能够促进纤维素、半纤维素的溶解,也能溶解反应过程中产生的副产物胡敏素[1],降低其在反应底物表面的附着程度进而可以提高目标产物的选择性。目前常规的GVL合成方法是纤维素经水解、脱水、再水合得到乙酰丙酸(LA),然后LA加氢环化[2]。从LA制备GVL通常有2种路线:一种是LA先加氢生成不稳定的中间体γ-羟基戊酸,再通过分子内酯化发生闭环并自发脱水生成GVL;另一种是LA先脱水形成当归内酯,然后再氢化生成GVL。反应过程中通常需要H2和贵金属(如Ru、Pt、Pd等)催化剂,王琰[3]采用铱(Ir)催化剂,在1 MPa 的H2压力和120 ℃下催化LA转化制备GVL,GVL产率最高可达98%。但均相催化体系存在反应条件苛刻,所需的贵金属催化剂成本高昂,副产物较多导致产物选择性低,以及金属的回收利用困难等问题,近年来非贵金属逐渐替代贵金属的非均相催化体系发展了起来。张迪[4]采用负载型Ni/HZSM-5催化剂,以3 MPa 的H2为氢源,催化LA和纤维素转化制备GVL,GVL产率分别达到85.9%和31.9%。但由于GVL制备过程中使用H2导致其生产成本较高,温度高,能耗较大,因此近年来采用非贵金属或酸改性贵金属非均相催化剂,酸、醇等有机溶剂作为H2的替代氢源来制备高产率的GVL受到了极大关注。多金属氧酸盐(POMs)或杂多酸(HPAs)具有可调控的酸性和氧化还原性,其中含有金属钒(V)的POMs具有较高的氧化性[5-6],被广泛用于环己烯氧化[5]、异丁烷的选择性催化氧化[7]、淀粉氧化[8]等多种氧化反应。而贵金属钌(Ru)是目前公认的能够高效生产GVL的催化剂[9-10],但Ru的价格昂贵、不易回收、反应条件苛刻,同时鉴于POMs可控的酸性和氧化性能,且可与不同金属复合制备非均相POMs催化剂。本研究将氧化型磷钼钒(PMoV)系列POMs与Ru复合,制备同时具有酸性和氧化性能的非均相POMs催化剂,一方面可保证在LA氢化制备GVL过程中需要的Lewis酸性位点,即Ru的活性位点,另一方面含V多酸阴离子还可以提高催化剂的氧化性能,有利于提高GVL的产率和选择性;并表征了催化剂的结构,考察了催化剂的性能,以期为GVL的生产提供新型、高效的催化剂。
1 实 验
1.1 材料与仪器
Na2HPO4、NaVO3·2H2O、浓硫酸、Na2MoO4·2H2O、乙醚、RuCl3·H2O、乙酰丙酸(LA)、甲酸(FA)、γ-戊内酯(GVL)和二氯甲烷,均为分析纯;十二烷和无水乙醇为色谱纯;实验用水为去离子水,自制。
D/max-2500X型X射线衍射(XRD)仪,日本Rigaku公司;WQF-520型傅里叶变换红外光谱(FT-IR)仪,北京北分瑞利公司;Quanta FEG型场发射环境扫描电子显微镜(SEM),荷兰FEI公司;ESCALAB 250型电子能谱仪,美国Thermo公司;BelcatⅡ型全自动化学吸附仪,日本MicrotracBEL公司;GC 7980型气相色谱(GC)仪,上海天美公司。
1.2 多金属氧酸盐的合成
根据文献[11]的方法合成了不同氧化性的PMoV系列多金属氧酸盐(HPMoV):H4PMo11VO40(V1)、H5PMo10V2O40(V2)和H6PMo9V3O40(V3)。
按照所需制备Ru3+全部置换H+的RuPMoV催化剂,准确计算出所需的RuCl3·H2O与HPMoV的物质的量比。将RuCl3·H2O(0.1 mol/L)水溶液缓慢滴加到HPMoV水溶液(5 mL 0.1 mol/L)中,然后室温下继续剧烈搅拌至少1 h,反应完全后再静置陈化24 h。80 ℃水浴将溶剂蒸干,然后将得到的棕黑色固体研碎,置于微型箱式炉中,在静态空气气氛下以5 ℃/min的速率升温到350 ℃,煅烧2 h,冷却至室温,取出备用。由V1、V2、V3制备得到的多金属氧酸盐(RuPMoV)分别为Ru4/3PMo11VO40(4-V1)、Ru5/3PMo10V2O40(5-V2)和Ru2PMo9V3O40(6-V3),产率分别为82.0%、97.4%和96.6%,催化剂中含钌分别为6.8%、9.3%和11.6%。
1.3 催化剂的表征
采用X射线衍射(XRD)仪测定催化剂的晶体结构;采用傅里叶变换红外光谱(FT-IR)表征催化剂官能团,将测试样品与KBr混合压片,测试范围400~4000 cm-1;SEM及EDX分析采用场发射环境扫描电子显微镜(SEM),加速电压为20.00 kV;X射线光电子能谱(XPS)分析采用电子能谱仪;采用全自动化学吸附仪测定催化剂的酸强度。
1.4 LA加氢环化制备GVL
称取一定质量的LA、催化剂、FA和5 mL水,混合加入到Synthware的厚壁耐压瓶中,在160 ℃下以750 r/min的转速搅拌反应一段时间。反应结束后冷却至室温,然后过滤回收催化剂,液体产物用二氯甲烷萃取,并减压蒸馏除去二氯甲烷,得到淡黄色的黏性液态产物。用无水乙醇溶解,采用气相色谱检测LA和GVL,并计算LA转化率、GVL产率及选择性。
1.5 产物分析方法
产物用气相色谱进行检测,检测条件为:FID检测器;进样口温度270 ℃;进样量1 μL;正十二烷为内标物;TM-5毛细管柱。柱温采用程序升温:初温100 ℃保持1 min,以10 ℃/min升至230 ℃保持8 min;分流比10 ∶1。
LA转化率(αLA)、γ-戊内酯产率(YGVL)和γ-戊内酯选择性(ηGVL)的计算公式见式(1)~式(3):
αLA=(1-n1/n0)×100%
(1)
YGVL=n2/n0×100%
(2)
ηGVL=YGVL/αLA×100%
(3)
式中:n0—起始反应液中LA的物质的量,mol;n1—产物中LA的物质的量,mol;n2—产物中GVL的物质的量,mol。
2 结果与讨论
2.1 催化剂的表征
2.1.1XRD分析 由于Ru2PMo9V3O40(6-V3)稳定性差,易吸水潮解,导致样品黏度过大,不适于表征,因此以下表征仅测试了V1、V2、4-V1和5-V2。图1为催化剂的XRD图,由图可以看出,所有的样品都具有Keggin型多酸的立方二级结构(PDF No.45- 483和PDF No.84-234)。V1在18.16°、 20.4°、 22.52°和26.9°处有4个典型的衍射峰,分别对应于(211)、(220)、(310)和(222)晶面[13];V2在20.18°、27.9°和28.9°处有3个典型的衍射峰,分别对应于(220)、(224)、(410)晶面[13]。但引入Ru3+后,与纯的V1和V2相比,4-V1位于24.82°、25.9°和29.02°的衍射峰与5-V2位于19.64°、24.9°和28.86°处的衍射峰均变得更加明显,说明引入多酸阴离子后,Ru3+与POMs阴离子发生重排,Ru3+的引入虽然导致多酸阴离子衍射峰的强度发生变化,但4-V1和5-V2仍保持母体多酸阴离子的结构。
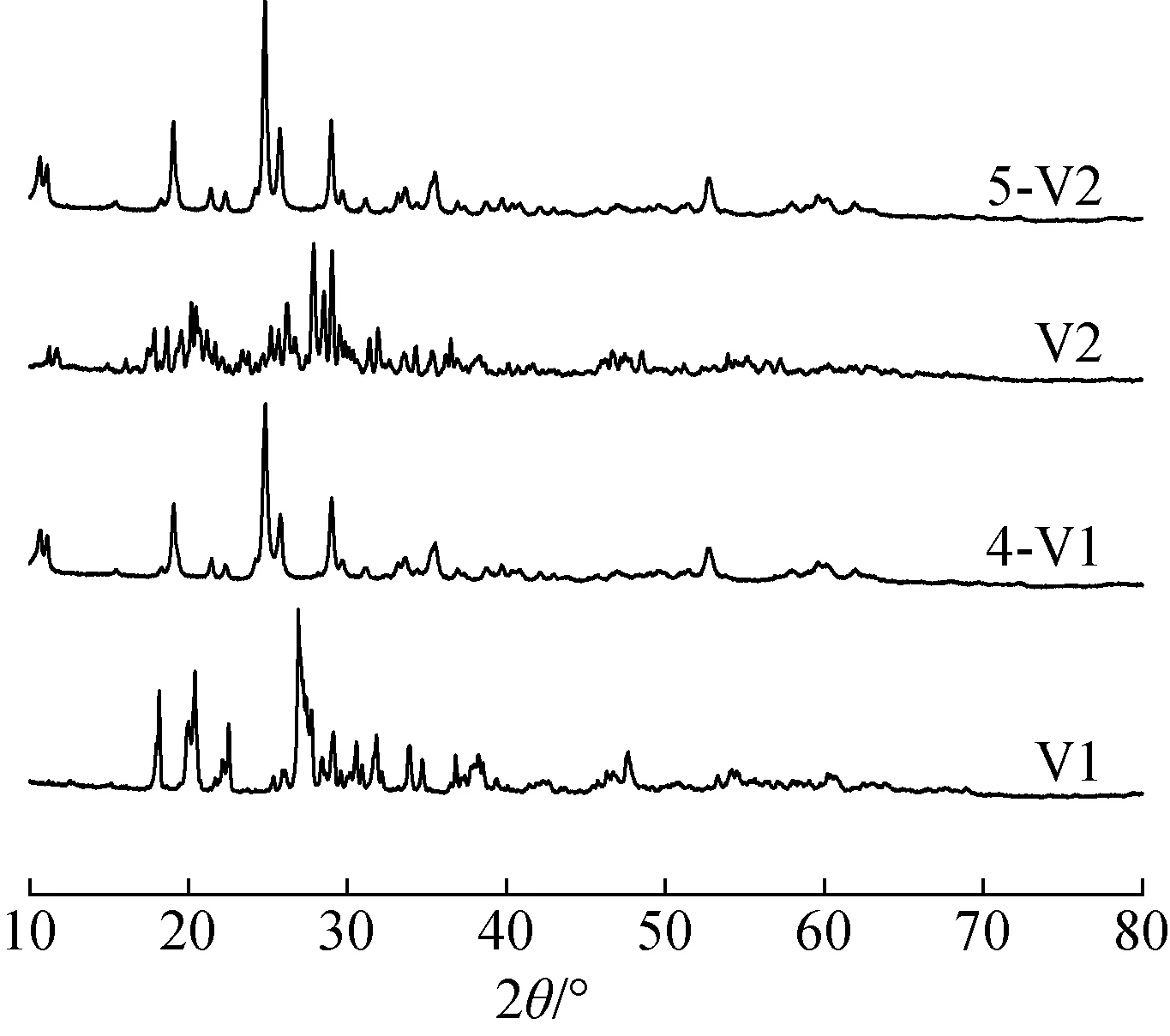
图1 HPMoV及RuPMoV的XRD图
2.1.2FT-IR分析 图2为催化剂的红外谱图。

图2 HPMoV及RuPMoV的FT-IR图
由图可以看到,V1、V2都显示出4个红外吸收峰,其中位于1066 cm-1处的峰可归因于杂原子O的不对称伸缩振动(νasP—O)[7],958 cm-1处的尖峰归因于Mo—O[11],850~700 cm-1的2个峰对应Mo—O—Mo的吸收峰。Ru3+置换H+后的4-V1和5-V2同样存在上述4个多酸阴离子的特征吸收峰,说明Ru3+置换H+后的多酸盐依然保持Keggin结构。
2.1.3SEM及EDX分析 HPMoV具有较规则的长方体结构[14],由图3可知,5-V2样品也具有较规则的几何结构,但由于Ru3+的存在,样品尺寸较大,可达0.5~1.5 μm。同时EDX结果证明样品的元素组成与分子式相符。

图3 5-V2的SEM(a)和EDX(b)图
2.1.4XPS分析 图4表明Ru3+全部置换H+后的5-V2出现了属于H5PMo10V2O40的O1s、V2p、Mo3d的光电子能量吸收峰。说明Ru3+与H5PMo10V2O40成功结合并且多酸阴离子的结构没有发生改变。
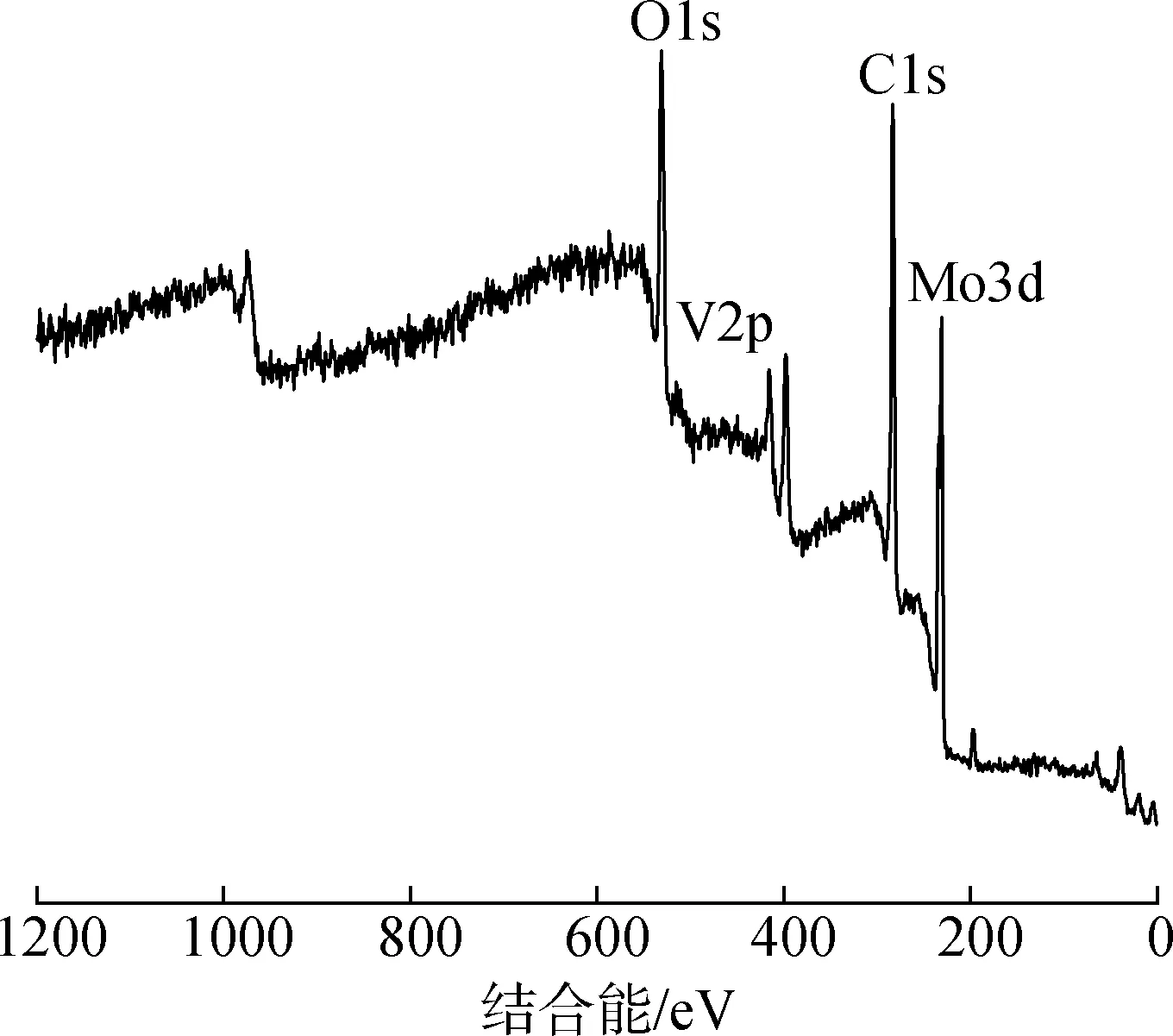
图4 5-V2的XPS谱图
2.1.5催化剂酸强度测试(NH3-TPD分析) 催化剂的NH3-TPD图见图5,酸强度测试结果见表1。
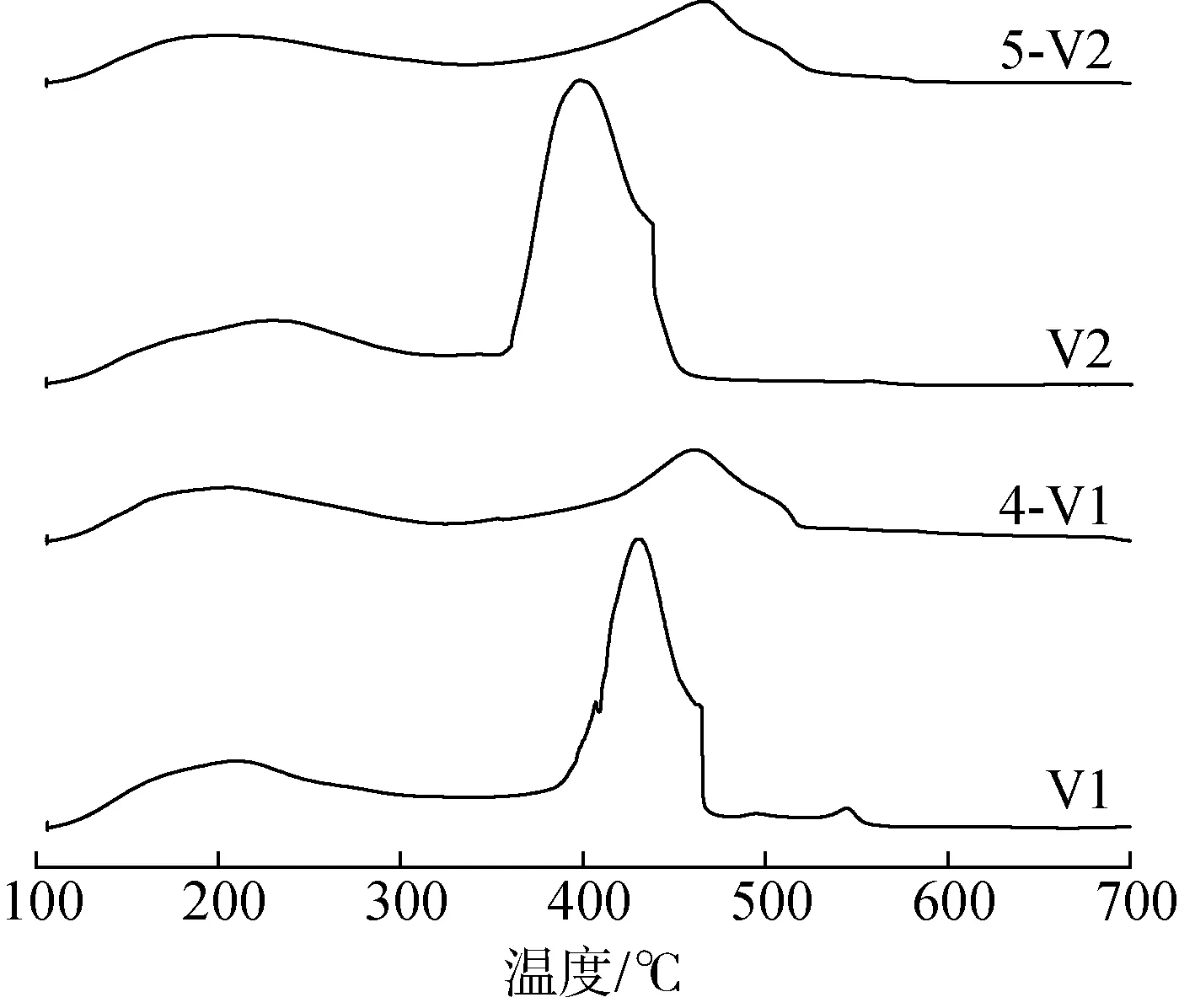
图5 HPMoV及RuPMoV的NH3-TPD图
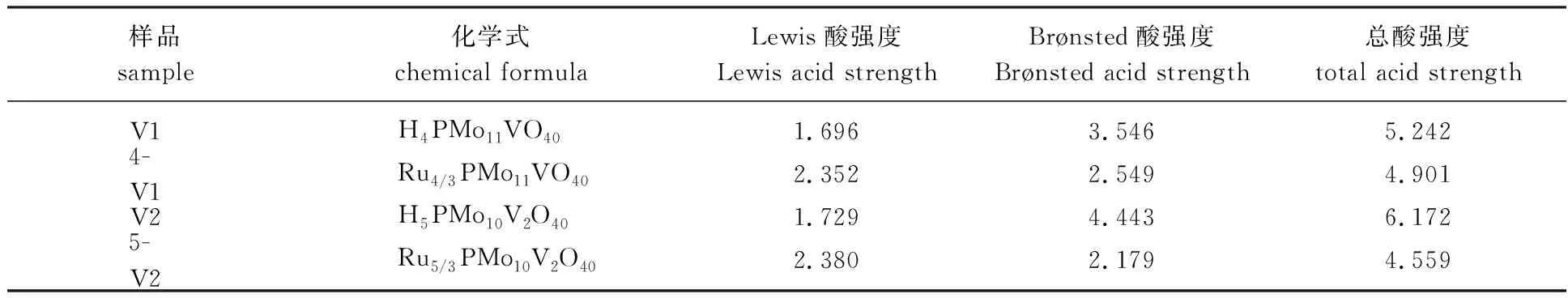
表1 HPMoV及RuPMoV的酸强度
由图5可知,所有的样品都在180~220 ℃和350~520 ℃的2个温度区间内有NH3解吸峰,分别对应于杂多酸(盐)的弱酸位点和强酸位点[15]。因为杂多酸的Lewis酸(L酸)强度低,所以弱酸位点的解吸峰小而宽;而Brønsted酸(B酸)强度高,所以强酸位点的解吸峰比较尖锐。Ru3+取代后,弱酸位点的解吸峰面积变大,L酸强度增强;强酸位点的解吸峰面积变小,B酸强度明显减弱。
2.2 催化LA制备GVL的活性
2.2.1催化剂性能比较 由于LA加氢环化生成GVL需要强氧化性的催化剂,根据文献[5]选择氧化性和热稳定性均较好的V1、V2、V3和RuCl3,及Ru3+全部置换H+的4-V1、5-V2和6-V3为催化剂,以乙酰丙酸(2.5 mmol)为原料,当催化剂用量0.1 g、FA 6 mmol、5 mL水,在160 ℃下反应8 h时,比较不同催化剂的催化活性,结果见表2(由于纯的杂多酸V1、V2、V3催化活性较差,几乎没有GVL生成,因此未在表2中列出)。
由表2可知,当RuCl3与含钒的多酸复合后,4-V1、5-V2和6-V3催化活性均显著高于纯RuCl3,活性由大到小的顺序为:4-V1>5-V2>6-V3>RuCl3。氧化性多酸阴离子与Ru3+的复合可进一步提高GVL的产率和选择性,但由于6-V3的V含量最高,氧化性最强,但其稳定性最差,室温下暴露在空气中很快潮解,会导致催化活性有所降低,虽然LA的转化率可以达到96.3%,但GVL产率和选择性均显著下降,表明催化剂适当的氧化性对GVL产率和选择性具有较大影响。而4-V1和5-V2均具有良好的催化活性,GVL产率分别可达98.8%和97.1%,此结果可归因于4-V1和5-V2均具有强Lewis酸性,有利于GVL产率的提高[16-17]。此外5-V2具有最高的GVL选择性(99.0%),这是由于该催化剂具有较低的B酸强度(见表1),通常在LA转化为GVL过程中,降低B酸强度有利于提高GVL的选择性[18-19]。

表2 不同催化剂对催化反应的影响
表3比较了近年来不同催化体系下LA加氢环化制备GVL的催化性能,结果表明:5-V2和4-V1在GVL转化中具有相当高的产率和选择性,催化活性优于大多数催化体系。因此,接下来选择GVL选择性最高的5-V2作为催化剂探究不同反应条件对GVL制备的影响。
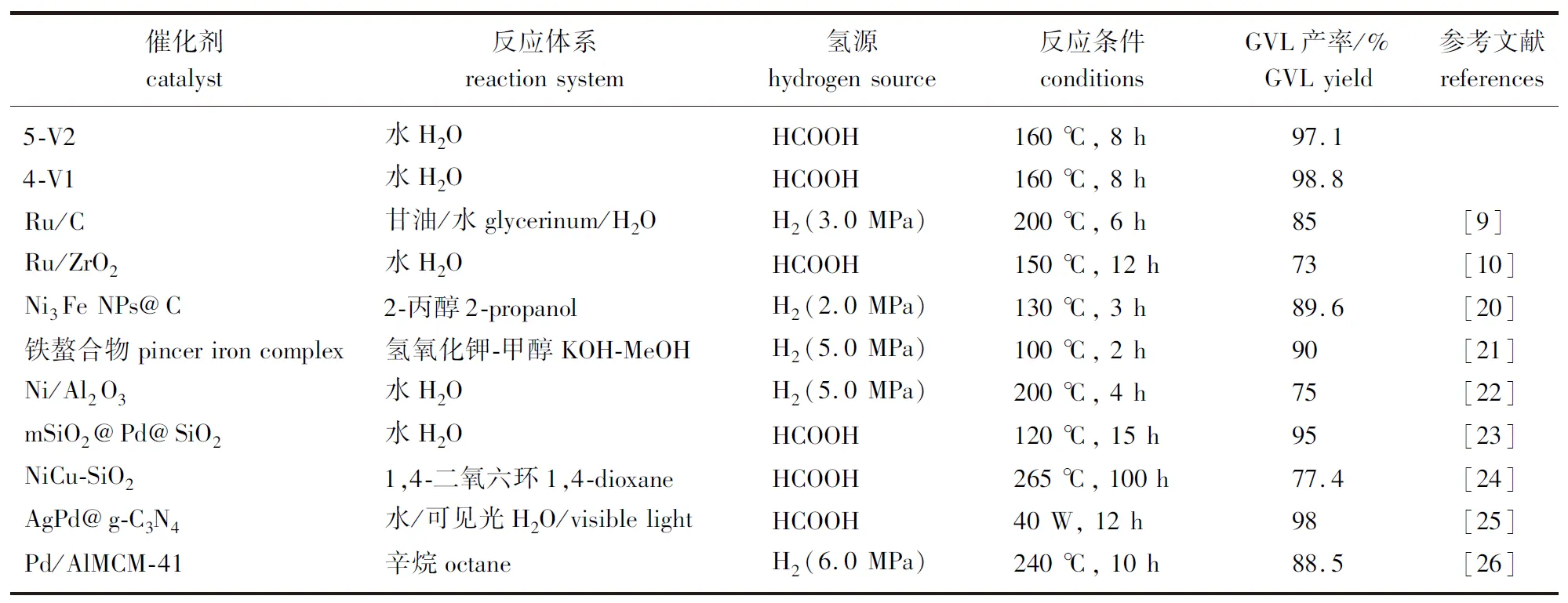
表3 其他催化体系催化LA加氢环化制备GVL
2.2.2不同反应条件对催化反应的影响 在LA 2.5 mmol,FA 6 mmol,H2O 5 mL,160 ℃反应8 h的条件下,催化剂用量对LA制备GVL的影响见图6(a)。由图可以看到,随催化剂的用量从0.03 g增加到0.1 g,GVL的产率和选择性分别从37.8%和41.9%增加至97.1%和99.0%,但是催化剂用量达到0.15 g 时,GVL产率和选择性分别降低到84.6%和90.5%。这是由于催化剂用量过少时,活性位点少,LA很难加氢环化生成GVL,导致GVL的产率和选择性低。如果催化剂过量使用,可能由于反应的中间产物当归内酯在酸催化下形成了焦炭[27],副反应程度加大从而导致转化率和产率降低。
以FA为氢源,首先FA在催化剂的作用下分解生成H2和CO2,然后LA在H2下环化生成产物GVL。在LA 2.5 mmol,5-V2 0.1 g,H2O 5 mL,160 ℃反应8 h的条件下,FA用量对LA加氢环化制备GVL活性的影响见图6(b)。由图可知,随着FA用量的增加,LA的转化率、GVL产率和选择性均明显增加,这是因为在LA加氢环化过程中需要过量的FA来提供H2,在FA用量为6 mmol时,LA转化率为98.1%,GVL产率为97.1%,GVL选择性为99.0%。然后当FA用量高于6 mmol时,GVL产率和选择性下降,这是因为过高用量的FA导致催化剂失活[28]。
在LA 2.5 mmol,5-V2 0.1 g,FA 6 mmol,H2O 5 mL和160 ℃条件下,反应时间对LA加氢环化制备GVL活性的影响见图6(c)。由图可知,当反应1 h时,GVL的产率和选择性仅为62.3%和71.0%。随着反应时间的延长,LA转化率、GVL产率和选择性先增大后减小,最佳反应时间为8 h。这是由于反应时间较短,LA的转化不充分,导致GVL产率较低;反应时间过长,则副反应的程度增大,从而导致LA转化率和GVL产率显著降低,但在该反应体系下,GVL产率仍能保持在80%左右。
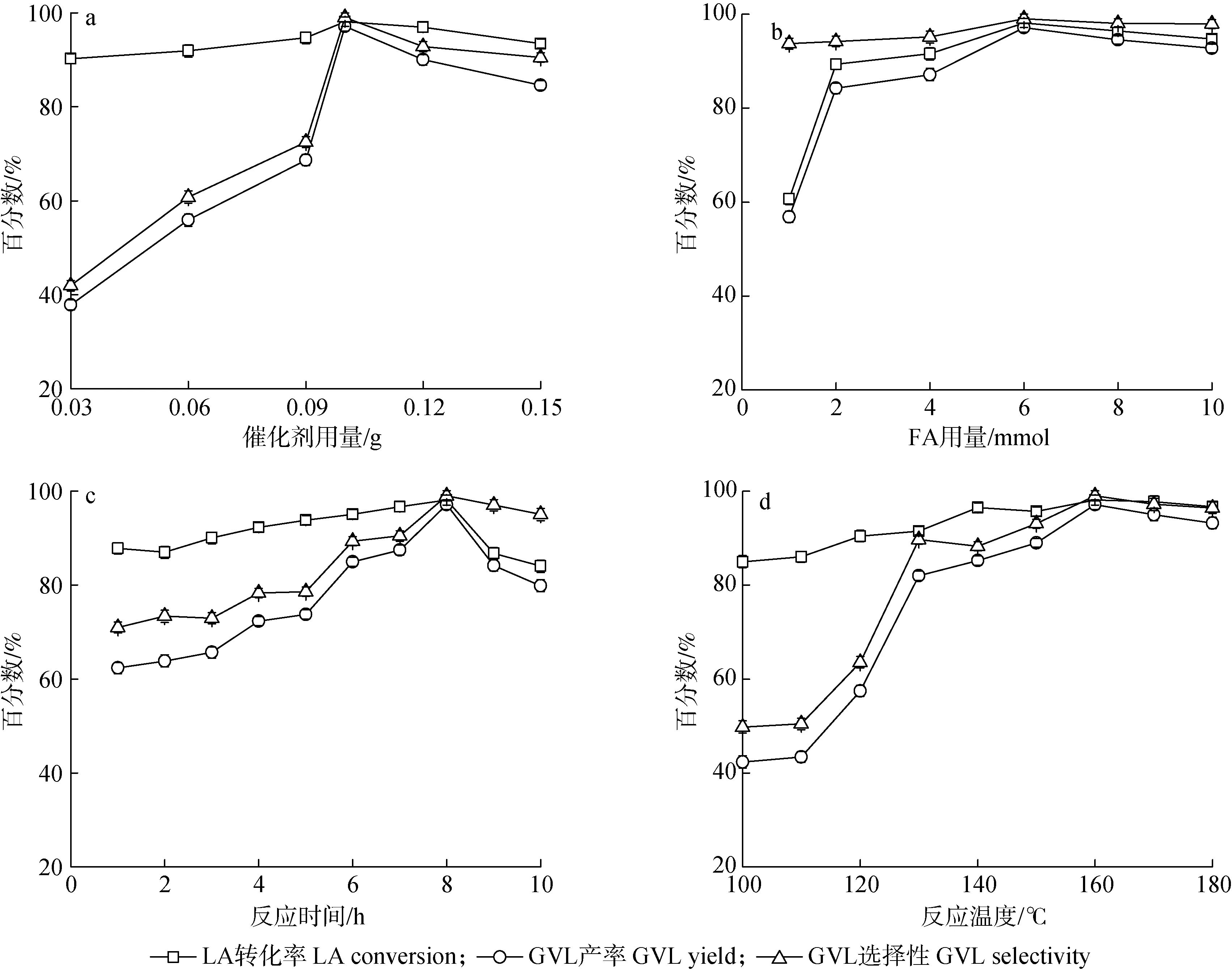
图6 不同条件对催化反应的影响
在LA 2.5 mmol,5-V2 0.1 g,FA 6 mmol,H2O 5 mL条件下反应8 h,反应温度对LA制备GVL活性的影响见图6(d)。由图可知,130 ℃以下LA的转化率和GVL产率不高,这是由于尚未达到FA的分解温度,导致H2量不足,LA不能充分转化为GVL;130 ℃时GVL产率迅速增大到82.0%,继续升高温度产率缓慢增加,在160 ℃时达到最大值;随后温度继续升高,LA转化率和GVL产率均略有下降,说明催化剂具有较高的稳定性,高温下仍能保持催化活性。
2.2.3反应动力学研究 实验针对LA在5-V2/FA-H2O催化体系中的转化进行了反应动力学分析。反应温度和时间对LA转化率的影响见图7(a)。由图7(a)并结合文献[1,29]初步判断此类反应为一级反应。根据Arrhenius经验公式进行拟合:
(4)
(5)
然后以lnk对1/T作图,得到拟合方程为lnk=-5 964.384 9(1/T)+12.574 37,R2=0.993 64。由此计算得到表观活化能(Ea)和表观反应指前因子(A),结果见图7(b)。由图可知,直线的斜率为-5 964.38,截距为12.57,由此可以得出LA在5-V2/FA-H2O催化体系中的表观活化能Ea为49.59 kJ/mol,表观反应指前因子(A)为2.89×105,该反应级数为一级。活化能较低,说明该反应体系下LA更易于高选择性的转化为GVL。
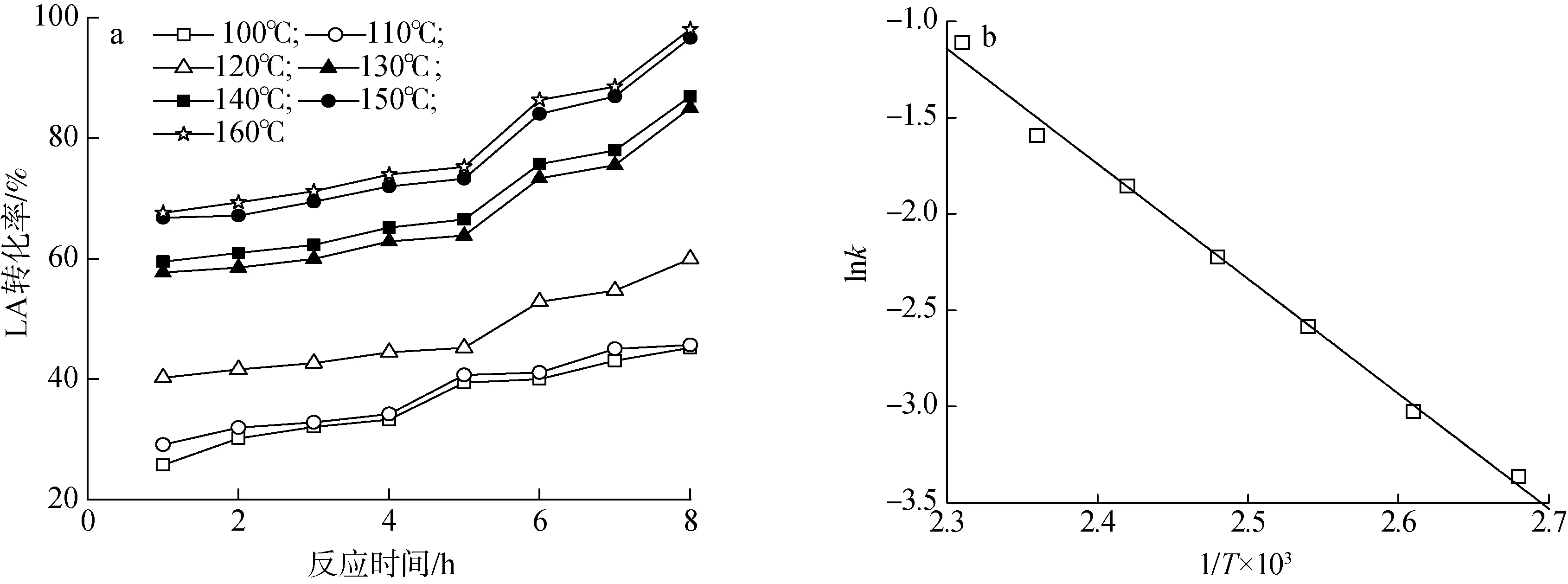
图7 反应温度和时间对LA转化率的影响(a)和lnk-1/T曲线(b)
2.2.4催化剂的重复使用性能 催化剂的重复使用性能在非均相催化体系中十分重要,因此,针对LA在5-V2/FA-H2O催化体系中的催化转化,测试了5-V2催化剂的重复使用性能。反应结束后将反应混合物过滤,回收催化剂,用乙醇洗涤3次,烘干后用于催化剂重复使用。结果发现催化剂使用1~5次时,GVL产率分别为97.1%、 93.5%、 91.4%、 88.3%和87.5%。使用5次后,催化剂质量损失为11.9%,可以认为催化活性降低主要是由于回收过程中操作损失造成的。
3 结 论
3.1采用Ru3+与强氧化性的多金属氧酸盐(HPMoV)复合,制备了同时拥有酸性和强氧化性的多金属氧酸盐(RuPMoV)系列催化剂,通过XRD、FT-IR、SEM、XPS和NH3-TPD等方法对其结构进行表征。结果表明:Ru3+已经成功引入多金属氧酸盐结构中,Ru3+对HPMoV中H+的置换并没有改变多酸阴离子的结构。
3.2RuPMoV系列催化剂的催化活性比较结果表明:强氧化性多酸阴离子有利于提高催化性能,当采用FA作为氢源,4-V1和5-V2均可将LA高效转化为GVL,其中5-V2的选择性更高,LA 2.5 mmol、5-V2 用量0.1 g、FA 6 mmol、H2O 5 mL、160 ℃反应8 h条件下得到LA转化率为98.1%、GVL产率为97.1%和选择性为99.0%。动力学研究结果表明:该反应为一级反应,反应具有较低的活化能(Ea),为49.59 kJ/mol。5-V2催化剂使用5次后GVL产率仍可达到87.5%,具有较好的重复使用性能。
