快速现场评价在经气管镜超声引导针吸活检诊断纵隔病灶中的应用
2021-05-10陈伟庄王辉李优王国安周莹艳吴仕波吴宏成
陈伟庄,王辉,李优,王国安,周莹艳,吴仕波,吴宏成
(宁波市医疗中心李惠利医院呼吸与危重症医学科,浙江宁波315040)
随着内镜介入技术的发展、微创化和精准化诊治观念的普及,一些新技术在临床工作中得到了应用,如:经气管镜超声引导针吸活检(endo-bronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)和电磁导航技术等,这些技术大大提高了内镜下诊断的敏感度和特异度。但内镜下取材时均为小标本,如何提高标本的使用效能,是临床工作的难点。近年来,快速现场评价(rapid on-site evaluation,ROSE)技术受到了广泛关注,包括快速现场细胞学评价(cytological ROSE,C-ROSE)和快速现场微生物学评价(microbiological ROSE,MROSE),两者常联合应用于各类呼吸介入技术中,但其能提高多少诊断效能结论不一。本研究旨在探讨ROSE在EBUS-TBNA诊断纵隔肿物中的应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2018年5月-2020年4月211 例就诊于宁波市医疗中心李惠利医院呼吸与危重症医学科并行EBUS-TBNA 检查的患者的临床资料。将2019年5月-2020年4月行EBUS-TBNA 与C-ROSE 的患者设为C-ROSE 组(n=93),2018年5月-2019年4月行EBUS-TBNA 但未行C-ROSE 的患者设为未行C-ROSE组(n=118)。C-ROSE 组中,男51 例,女42 例,年龄31~81 岁,平均(59.16±11.06)岁;未行C-ROSE 组中,男67 例,女51 例,年龄19~86 岁,平均(59.64±12.03)岁。两组患者年龄与性别比较,差异均无统计学意义(P>0.05)。
纳入标准:①术前胸部CT 显示纵隔/肺门病灶(包括短径≥1 cm 的淋巴结及肿块)者;②术前完善心电图和凝血功能等检查,排除超声支气管镜检查相关禁忌证者;③术前知晓手术操作过程及相关风险,并签署手术同意书者。排除标准:①存在凝血功能障碍及严重心、肺功能衰竭等不能耐受全麻手术者;②通过常规支气管镜或体表肿大淋巴结穿刺活检等手段明确诊断者;③临床资料不完整者。
1.2 方法
1.2.1 人员ROSE操作和判读人员:由同1名呼吸科专科医师完成,该医师在宁波市临床病理诊断中心细胞室细胞专业组病理医师指导下进行培训学习3个月。EBUS-TBNA 操作人员:均由呼吸内科内镜介入组有资质的手术医师进行操作。
1.2.2 术前准备所有患者术前均行血常规、生化、凝血功能、血气分析、心电图、肺功能、心脏彩超、胸部增强CT 和颅脑增强磁共振成像(magnetic resonance imaging,MRI)检查,术前禁食禁饮(术前1天晚上8点禁食,10点禁水)。
1.2.3 EBUS-TBNA 操作过程术前麻醉医师和手术医师综合患者年龄、基础疾病、肺功能和血气分析等资料,决定予以静脉麻醉。置入喉罩连接呼吸机辅助通气后,开通静脉通道,根据手术情况追加芬太尼及咪达唑仑,全程心电监护及指脉氧监测。术中先行常规支气管镜检查,予以利多卡因喷洒声门、气道和穿刺点等部位行表面局部麻醉,清理呼吸道分泌物,观察管腔情况;然后换用超声支气管镜,将凸面探头贴近气道壁达到目标位置,向水囊注入适量的水,切换超声模式,探查肿大淋巴结和(或)肿物大小及部位,确定行病灶处EBUS-TBNA 和(或)淋巴结处EBUS-TBNA。将超声支气管镜调整至合适的穿刺部位,测量病灶大小及穿刺距离,打开彩色多普勒超声模式,观察病灶内血供情况,并确定其与邻近血管的关系,再次确定穿刺部位及穿刺方向,经工作通道送入21G 穿刺针(生产厂家:Olympus,型号:NA-201SX-4021),每次穿刺连接负压空针反复抽吸25~30次[1]。穿刺原则为先纵隔后肺门、先对侧后同侧。单个靶病灶穿刺针数≥3针[2],一般总穿刺针数不超过7针[3]。
1.2.4 ROSE 工作流程靶部位取材后,将穿刺针针头抵于无菌细胞学专用玻片中央,用穿刺针内芯缓慢推送,如有糊状组织标本推出,采用滚片或留片法制片2张,1张用于C-ROSE,另1张固定后送细胞病理学检查,其余大部分标本固定于液基细胞固定液后送检;如无糊状组织标本,采用喷片法制片2 张,1 张用于C-ROSE,另1张固定后送细胞病理学检查,末次穿刺后,穿刺针在液基细胞固定液中反复抽吸后送检[4]。WHO推荐采用迪夫快速染色液对ROSE细胞学基片进行快速染色[5]。把基片浸泡于迪夫A 溶液(20 s)中;再于PBS 染缸中洗掉迪夫A 溶液,甩干缓冲液;然后把基片浸泡于迪夫B 溶液(20 s)中;最后于清水染缸中水洗,用吸水纸吸干、擦干玻片残留液体,完成染色。
评估的三要素包括:①是否取到病变细胞;②病变细胞比例及数量是否足够;③细胞是否完整,进一步判读结果及满意度。当C-ROSE镜下见非诊断材料(大量血细胞、呼吸道黏膜细胞)或病变细胞(少量有核细胞)比例较低,则判定该穿刺标本不合格,需重新穿刺。当C-ROSE镜下见明显病变细胞或者足量的淋巴细胞,则判断为合格标本,进一步判读结论:①若C-ROSE结果为见癌细胞,则在原部位继续穿刺获取标本,若术者认为标本量不够,可更换穿刺靶位;②若C-ROSE结果为未见癌细胞,则需要更换穿刺靶位,再次穿刺获取标本行C-ROSE分析;如有不同N分期淋巴结,确保均有穿刺;③若C-ROSE结果为可疑癌细胞,同②操作。记录C-ROSE诊断结果及镜下细胞学特征[4]。
1.2.5 诊断结果的判断所有病检标本报告由宁波市临床病理诊断中心发布。若EBUS-TBNA 术后送检标本获得明确的病理诊断结果,且符合临床其他资料及诊断,则以此为最终诊断。若EBUS-TBNA 病理诊断与临床其他资料及诊断不符或可疑,但患者之后行经皮肺穿刺活检、纵隔镜活检、胸腔镜活检或开胸手术等有创操作获得了明确病理诊断,则以后者的病理结果为最终诊断;若因各种因素未能行进一步有创检查者,则随访半年以上,以患者的临床诊断为最终诊断。
1.2.6 评估出血量由操作医师按文献[6]评估:极少量出血(<5 mL)、轻度出血(5~20 mL)、中度出血(20~100 mL)、重度出血(>100 mL)。
1.3 统计学方法
选用SPSS 22.0 统计软件分析数据,使用Kappa检验评价C-ROSE 技术与常规病理诊断结果的一致性。计数资料以例或百分率(%)表示,行χ2检验;计量资料以均数±标准差(±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析(ANOVA),两两比较采用Fisher 氏最小显著差检验(Fisher's least significance difference,LSD)。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者穿刺情况
C-ROSE 组15 例行肿物EBUS-TBNA(纵隔肿物4 例,右肺门肿物6 例,左肺门肿物5 例),87 例行淋巴结EBUS-TBNA,共穿刺386 针。未行C-ROSE组17 例行EBUS-TBNA(纵隔肿物5 例,右肺门肿物5 例,左肺门肿物7 例),110 例行淋巴结EBUS-TBNA,共穿刺447 针。穿刺淋巴结位置分布见表1。
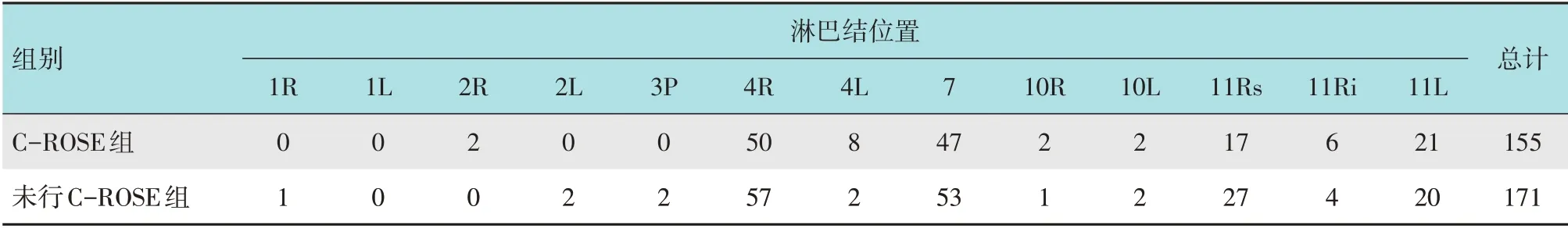
表1 两组患者穿刺淋巴结部位分布和数量 个Table 1 Distribution and number of punctured lymph nodes between the two groups n
2.2 两组患者病理结果
C-ROSE 组最终诊断恶性肿瘤49 例,其中鳞癌8例,腺癌17 例,小细胞癌20 例,低分化癌4 例;良性病变44 例,其中结核5 例,结节病14 例,慢性炎症20例,纵隔囊肿2例,手术证实肺癌淋巴结阴性3例。未行C-ROSE 组最终诊断为恶性肿瘤53 例,其中鳞癌15例,腺癌19例,小细胞癌8例,低分化癌4例,淋巴瘤3例,食管癌转移2例,乳腺癌转移1例,间叶源性恶性肿瘤1例;良性病变65例,其中结核7例,结节病17 例,慢性炎症29 例,纵隔囊肿2,肺淋巴管瘤病1 例,纵隔神经鞘瘤1 例,血嗜酸性粒细胞增多症1例,手术证实肺癌淋巴结阴性7例。
2.3 两组患者诊断准确度、敏感度和特异度比较
C-ROSE 组EBUS-TBNA 与最终诊断相比,阳性病例46 例,阴性病例43 例,假阳性病例为1 例,假阴性病例3 例,其中1 例假阳性病例为EBUS-TBNA玻片见炭末沉着、坏死背景中有少量非典型细胞,最终诊断为结核;EBUS-TBNA 诊断准确度为95.70%(89/93)、敏感度为93.88%(46/49)、特异度为97.73%(43/44)。未行C-ROSE 组EBUS-TBNA 与最终诊断相比,阳性病例49 例,阴性病例61 例,假阳性病例为4例,假阴性病例4例,4例假阳性病例中,3 例EBUS-TBNA 玻片见异型淋巴细胞,最终诊断为慢性炎症,1 例EBUS-TBNA 玻片见不典型细胞和梭形深染,最终诊断为纵隔神经鞘瘤;EBUS-TBNA 诊断准确度为93.22%(110/118)、敏感度为92.45%(49/53)、特异度为93.85%(61/65)。两组患者准确度、敏感度和特异度比较,差异均无统计学意义(P值分别为0.440、0.776和0.342,)
在C-ROSE 组中,由呼吸专科医师出具的ROSE结果与最终诊断相比,阳性病例43 例,阴性病例39例,假阳性病例为5 例,假阴性病例6 例,其中5 例假阳性病例为ROSE玻片见异型淋巴细胞和坏死,最终诊断为:1例结节病,2例结核,1例纵隔镜淋巴结活检为反应性增生,1 例慢性炎症。ROSE 结果诊断准确度为88.17%(82/93)、敏感度为87.76%(43/49)、特异度为88.64%(39/44)。由呼吸专科医师出具的ROSE 结果与最终诊断有较高的一致性(κ=0.763)。ROSE 结果与病理中心EBUS-TBNA 报告的准确度、敏感度和特异度比较,差异均无统计学意义(P值分别为0.139、0.294 和0.09)。由呼吸专科医师出具的ROSE 结果与病理中心EBUS-TBNA 报告有高度一致性(κ=0.806)。
2.4 两组穿刺相关指标比较
2.4.1 两组比较C-ROSE 组穿刺次数较未行C-ROSE 组多,两组比较,差异有统计学意义(P<0.05);C-ROSE 组操作时间较未行C-ROSE 组长,但两组比较,差异无统计学意义(P>0.05)。两组出血发生率比较,差异无统计学意义(P>0.05)。见表2。
2.4.2 亚分组比较C-ROSE 组非小细胞癌亚组穿刺次数较未行C-ROSE组非小细胞癌亚组多,操作时间较未行C-ROSE 组非小细胞癌亚组长,两组比较,差异均有统计学意义(P<0.05)。见表3。
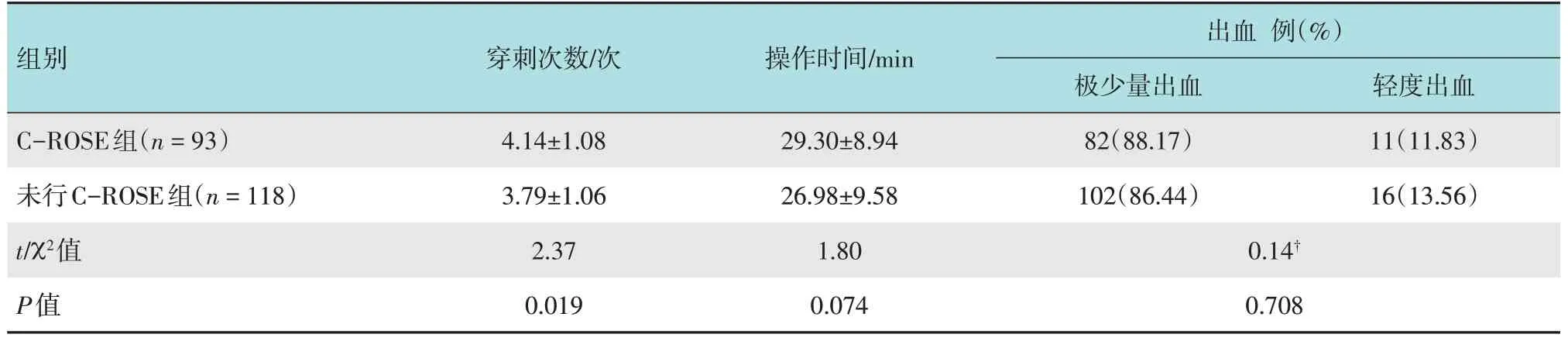
表2 两组穿刺次数、操作时间和出血发生率比较Table 2 Comparison of number of puncture,operation time and bleeding rate between the two groups
表3 两组不同病理类型穿刺次数和操作时间比较(±s)Table 3 Comparison of number of puncture and operation time between the two groups with different pathologic types(±s)
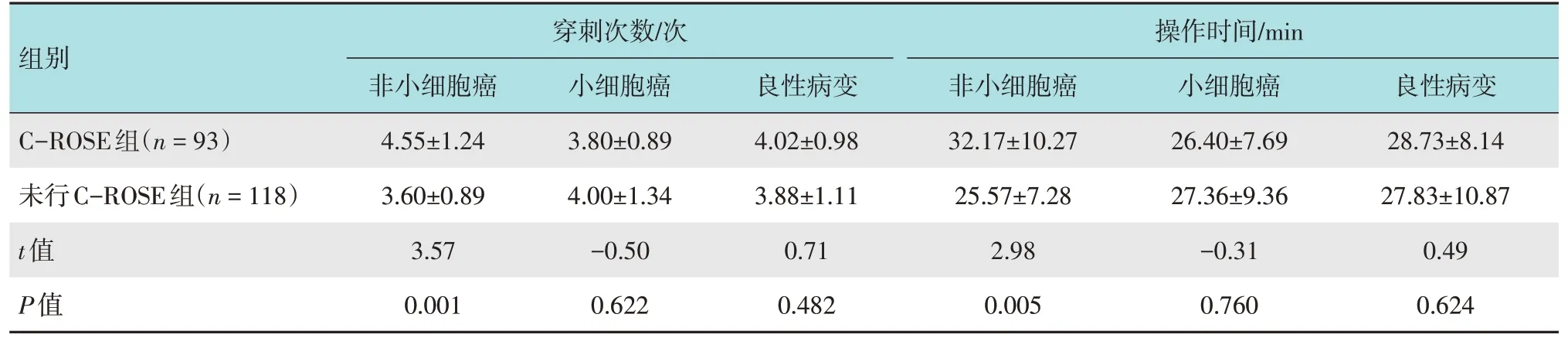
表3 两组不同病理类型穿刺次数和操作时间比较(±s)Table 3 Comparison of number of puncture and operation time between the two groups with different pathologic types(±s)
组别C-ROSE组(n=93)未行C-ROSE组(n=118)t值P值穿刺次数/次非小细胞癌4.55±1.24 3.60±0.89 3.57 0.001小细胞癌3.80±0.89 4.00±1.34-0.50 0.622良性病变4.02±0.98 3.88±1.11 0.71 0.482操作时间/min非小细胞癌32.17±10.27 25.57±7.28 2.98 0.005小细胞癌26.40±7.69 27.36±9.36-0.31 0.760良性病变28.73±8.14 27.83±10.87 0.49 0.624
2.4.3 C-ROSE 组亚分组比较按不同类型病变将C-ROSE 组进行亚分组,单因素ANOVA 方差分析显示,3 组穿刺次数比较,差异有统计学意义(P=0.033);LSD检验提示,非小细胞癌组与小细胞癌组穿刺次数比较,差异有统计学意义(P=0.016),非小细胞癌组与良性病变组穿刺次数比较,差异有统计学意义(P=0.038),小细胞癌组与良性病变组穿刺次数比较,差异无统计学意义(P=0.434)。3组操作时间比较,差异无统计学意义(P=0.070)。见表4。
表4 C-ROSE组不同病理类型穿刺次数和操作时间比较(±s)Table 4 Comparison of number of puncture and operation time of different pathologic types in C-ROSE group(±s)
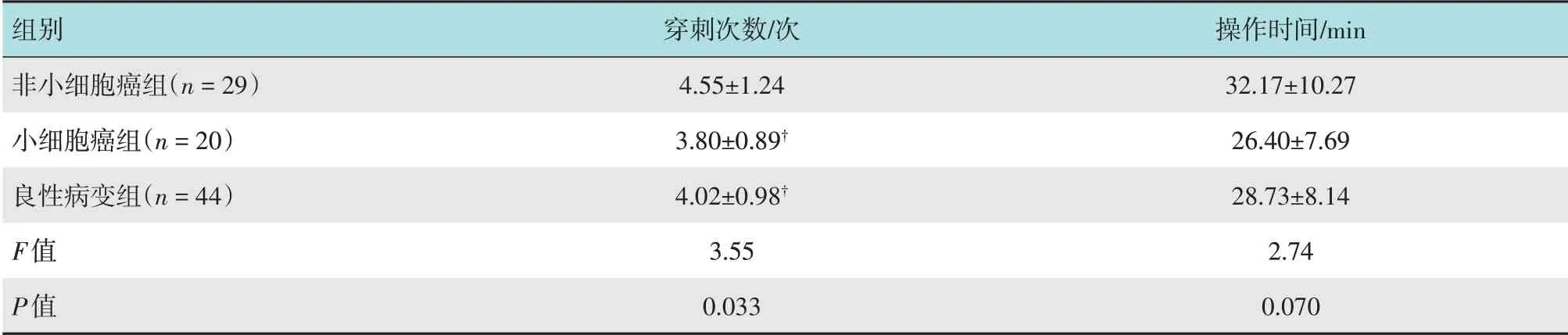
表4 C-ROSE组不同病理类型穿刺次数和操作时间比较(±s)Table 4 Comparison of number of puncture and operation time of different pathologic types in C-ROSE group(±s)
注:†为与非小细胞癌组比较,差异有统计学意义(P<0.05)
组别非小细胞癌组(n=29)小细胞癌组(n=20)良性病变组(n=44)F值P值穿刺次数/次4.55±1.24 3.80±0.89†4.02±0.98†3.55 0.033操作时间/min 32.17±10.27 26.40±7.69 28.73±8.14 2.74 0.070
2.5 基因检测情况
C-ROSE 组的29 例非小细胞癌中,ROSE 判读结果发现25 例非小细胞癌(非鳞癌20 例,鳞癌5 例),其中2例鳞癌患者拒绝基因检测,23例非小细胞癌最终有19例使用EBUS-TBNA标本完成基因检测,完成率为65.52%(19/29),后续完成免疫组化率为31.03%(9/29)。而未行C-ROSE 组的53 例恶性肿瘤中,使用EBUS-TBNA 标本常规先完成免疫组化,最终有28例完成免疫组化,完成率为52.83%(28/53),剩余者因EBUS-TBNA 标本量偏少,未再使用该标本行基因检测。
3 讨论
目前,肺癌仍然是全球癌症死亡的主要原因之一,尽管诊疗技术在不断发展,但大多数情况下,首诊肺癌者已经不能手术治疗[7]。随着人们对癌基因/分子蛋白水平认识的不断提高,靶向治疗和免疫治疗让肺癌治疗的手段和选择越来越精准[8],但前提是有合适的标本采集方式。
超声支气管镜在检查时可实时显示气道附近的结构(包括淋巴结、支气管旁肿块和血管等),并可引导经支气管针抽吸活检(trans-bronchial needle aspiration,TBNA)。美国胸科医师学会(The American College of Chest Physicians,ACCP)肺癌指南建议用EBUS-TBNA 对肺癌纵隔肿物进行采样,以确认诊断及分期[2]。ROSE 被广泛应用于各类肿瘤微创穿刺或内镜下活检取材以提高诊断率[9-10]。2016年ACCP指南[2]报道,ROSE在减少附加程序方面是有效的,但在抽吸次数、诊断率、手术时间和并发症发生率方面,与未行ROSE 无差异。因此,建议对接受EBUS-TBNA的患者进行带或不带ROSE的组织取样,以诊断肺癌(1c级)。有文献[11]将ROSE 和非ROSE 与常规TBNA 和EBUS-TBNA 进行比较,结果发现EBUS-TBNA 用于纵隔淋巴结取样时,ROSE 不会影响诊断敏感性,手术时间和样本充足率也相似,但ROSE 可明显减少EBUS-TBNA 的穿刺次数,常规TBNA 则没有。因此,ROSE 可以简化支气管镜诊断操作程序,并降低并发症发生率[12]。原因考虑为:EBUS-TBNA 是一种实时技术,可以在手术过程中看到针头和目标病灶,以确保手术的准确性,从理论上讲不需要ROSE;行液基细胞学检查时,样品在实验室里被直接转移到防腐液中,无需在现场直接涂片[13]。以上观点是以诊断为目的,当以分子检测为目的时,应考虑额外的针刺情况[2]。但是,当前仍然不清楚需要多少次针刺才能获得足够的用于分子检测的标本。因此,强烈建议使用ROSE指导诊断取样,这样就可以尽可能多地获取标本用于其他检测(如分子检测等)[13]。
也有指南[14]指出:虽然细针穿刺(fine needle aspiration biopsy,FNAB)可以准确诊断绝大多数乳腺病变,但依然建议使用ROSE以减少不充足/不充分病例的出现,并增加对疾病的定性。ROSE可以提供临时诊断,为患者及时分类和选择有益的辅助检查,减少患者焦虑及简化诊疗过程。CAUPENA 等[15]研究发现,采用EBUS-TBNA行纵隔分期的64例肺癌患者中,只有3 例(4.6%)患者的ROSE 和最终诊断有差异。可见,ROSE有助于样品分类[16]。
ROSE 可确保收集足够的材料用于辅助研究,包括肺癌亚型分型的免疫组织化学染色和潜在分子检测[13]。RAVAIOLI 等[17]通过ROSE 观察肺癌细胞形态学特征,总体诊断准确率为90%~97%,还可以区分肺癌类型,帮助内镜医师决定需采集多少肿瘤样品(因为腺癌分子检测需要更多的样品)。ISHIZAWA等[18]在用超声内镜引导下细针穿刺(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)制成的ROSE玻片上提取DNA标本,通过比较下一代测序(next-generation sequencing,NGS)基因检测和PCR检测,分析腺癌KRAS突变情况,两者的一致性率为81%。可见,使用ROSE玻片上提取DNA标本进行癌症基因检测,可以帮助不可切除的腺癌患者分层,并可用于治疗药物的选择。但在手术过程中,并非每次都能得到细胞病理学家或细胞技术专家的ROSE 支持。LEWIN[19]指出,ROSE 可提高EUS-FNA的诊断准确性,细胞病理学家可借助ROSE玻片或通过实时远程技术观察针吸物涂片,以确定采集的诊断材料是否足够,从而减少不满意样本、增加诊断样本和简化对其他程序的需求,缺点是细胞病理学家不能现场参与。因此,肺科医生是否可现场准确评估是需要解决的问题。LIN 等[20]将肺科医师确定的ROSE 结果与正式的印记细胞学报告和病理报告进行比较,以正式的印记细胞学诊断为标准,ROSE 的敏感度为96.90%,特异度为68.20%,阳性预测值(positive predictive value,PPV)为89.90%,阴性预测值(negative predictive value,NPV)为88.20%,诊断准确度为89.50%;以正式的病理结果为标准,ROSE的敏感度为88.20%,特异度80.00%,PPV 为97.10%,NPV 为47.10%,诊断准确度为87.20%;在内镜超声引导下经支气管活检(endobronchial ultrasoundguided transbronchial biopsy,EBUS-TBB)期间行ROSE,诊断准确度更高(88.40% 和68.00%,P<0.01)。因此,训练有素的肺科医师可以在现场充分解释细胞学涂片,并有效提高EBUS-TBB在肺外周病灶(peripheral lung lesion,PPL)诊断中的准确性。LI等[21]认为,肺科医师通过短期和深入的培训,在诊断性介入肺科中进行ROSE将是一种趋势。
本研究发现,C-ROSE 组和未行C-ROSE 组EBUS-TBNA的敏感度(93.88%和92.45%)和特异度(97.73%和93.85%)比较,差异均无统计学意义,这与OKI等[22]研究一致。本文由呼吸与危重症医学科医师担任ROSE 操作和解读结果,ROSE 结果诊断敏感度为87.76%(43/49)、特异度为88.64%(39/44),与最终诊断具有较高的一致性(κ=0.763);由呼吸与危重症医学科医师报告的ROSE 结果与病理中心EBUS-TBNA报告也高度一致(κ=0.806)。
本研究表明,C-ROSE 组穿刺次数较未行C-ROSE 组多,且两组比较,差异有统计学意义(P=0.019),考虑原因为:ROSE 发现肿瘤细胞(特别是非小细胞癌)时,会增加穿刺次数来获得更多标本,以为后续检测(如基因检测等)提供材料,但两组操作时间比较,差异无统计学意义(P=0.074)。本研究中,亚组分析结果发现,C-ROSE组中非小细胞癌组穿刺次数较未行C-ROSE组多,操作时间较未行C-ROSE 组长,两组比较,差异均有统计学意义(P<0.05),考虑原因为:临床工作中需更多标本材料来完善非小细胞肺癌(特别是腺癌)基因检测的需求。从诊断目的看,ROSE的参与不会改变小细胞癌组和良性病变组的穿刺次数和操作时间。C-ROSE组内,非小细胞癌组的穿刺次数要多于小细胞癌组和良性病变组,说明ROSE的参与让临床医师即刻就能知道病变类型,从而影响了后续的诊疗过程;非小细胞癌组的操作时间较小细胞癌组和良性病变组长,但组间比较,差异无统计学意义(P=0.070)。
LABARCA 等[23]的Meta 分析显示,EBUS-TBNA在包含2 497例患者的28项研究中,获得了足够样本来鉴定,表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的总概率为94.50%;在12 项研究共607 例患者中,约为94.90%的样品可行间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变鉴定。ZHANG等[24]发现,从EBUS-TBNA获得的样本平均穿刺次数为(3.41±0.68)次,约有80.40%(201/250)的样本可以进行EGFR 突变和ALK 融合基因分析。ROSE可以提供充足的样品信息(如确认肿瘤细胞的存在并判断样品中的肿瘤负荷,即为肿瘤细胞与有核细胞的比例),进而改善样品分类并分子检测。
临床医师可通过ROSE与病理医师及时沟通,送检的细胞涂片病理结果与ROSE结果一致时,应先保证基因检测所需的材料。本研究中,肺癌基因检测完成率为65.52%(19/29),后续免疫组化完成率为31.03%(9/29)。本院在ROSE 开展之前,恶性肿瘤EBUS-TBNA 标本免疫组化完成率为52.83%,剩余EBUS-TBNA 的标本偏少,未能很好地行基因检测。本研究的不足之处为回顾性分析,ROSE在各病种间的样本量少、不均衡,可能使结果产生偏倚。
综上所述,在EBUS-TBNA 过程中应用ROSE,临床医师与病理医师在诊断上具有高度一致性,临床医生可立即知晓病理倾向,为后续诊疗方案提供了依据。
