胃息肉及胃癌组织中PMS2、MSH6、C-met的表达水平及其临床应用价值
2021-05-10张伟徐斌洪汝涛
张伟,徐斌,洪汝涛
(1.安徽理工大学第一附属医院消化内科,安徽 淮南 232007; 2.安徽医科大学第一附属医院消化内科,安徽 桐城 230022)
胃息肉是胃黏膜的增生性病变,增生组织自黏膜凸向胃腔,主要包括增生性息肉、腺瘤性息肉、胃底腺息肉、炎性息肉4种病理类型[1-2]。临床上多认为胃息肉是胃癌的癌前病变,癌变率为6.0%~47.0%,其中腺瘤性息肉的癌变率最高,为10.0%~23.1%[3-4],而胃底腺息肉既往认为不会发生癌变,但临床也偶有发生癌变的个案。胃息肉向胃癌的演变是一个漫长而复杂的过程,在此过程中若能早期发现并干预可显著降低胃癌的发生率。近年来,随着内镜检查技术的不断提高与广泛普及,胃息肉的检出率也呈升高趋势,相关文献显示,胃息肉在消化内镜检查中的检出率为1.0%~10.0%[5]。随着胃息肉与胃癌研究的不断深入,部分学者发现错配修复基因PMS2、MSH6以及细胞间质表皮转化因子(cellular mesenchymal to epithelial transition factor,C-met)可能参与胃息肉向胃癌的演变,为胃癌的防治提供了重要的基因学证据[6-7]。为进一步探寻胃息肉向胃癌演变的发生发展机制,本研究主要探讨胃息肉及胃癌组织中PMS2、MSH6、C-met的表达情况及其在胃息肉向胃癌转化中的预测价值。
1 资料与方法
1.1一般资料 选取2017年7月至2019年12月安徽理工大学第一附属医院收治的143例胃息肉患者及45例胃癌患者作为研究对象,其中增生性息肉42例,男16例、女26例,年龄39~70岁,平均(57.8±7.5)岁;腺瘤性息肉23例,男15例、女8例,年龄42~68岁,平均(57.0±7.5)岁;胃底腺息肉35例,男14例、女21例,年龄43~69岁,平均(54.9±8.2)岁;炎性息肉43例,男19例、女24例,年龄38~66岁,平均(55.4±7.9)岁。胃癌患者中男17例、女28例,年龄47~72岁,平均(57.2±8.5)岁。5组患者的性别、年龄比较差异无统计学意义(P>0.05)。本研究经安徽理工大学第一附属医院伦理委员会批准,患者均签署了知情同意书。
1.2纳入与排除标准 纳入标准:经消化内镜及病理组织学检查确诊为胃息肉或胃癌;年龄35~70岁。排除标准:家族遗传性胃息肉;既往有恶性肿瘤切除史或当前合并有其他系统恶性肿瘤;妊娠期或哺乳期女性;存在认知功能障碍,不能配合完成全程治疗。
1.3主要试剂与仪器 兔抗人PMS2多克隆抗体(批号:H00005395-D01P)、兔抗人MSH6多克隆抗体(批号:A-6702-050)、兔抗人C-met单克隆抗体(批号:MAB11027)购自武汉艾美捷科技有限公司生产;苏木精-伊红染色液(批号:G1120)、柠檬酸钠抗原修复液(批号:C1032)、磷酸盐缓冲液(phosphate buffer solution,PBS)(批号:P1032-500)购自北京索莱宝科技有限公司生产;辣根过氧化物酶标记链霉卵白素免疫组织化学试剂盒(批号:KB1973)、浓缩型二氨基联苯胺显色试剂盒(批号:BH1805)购自上海恪敏生物科技有限公司生产;显微镜、组织切片机(德国Leica公司);组织脱水机(美国Thermo Shandon公司)。
1.4方法
1.4.1判定病理类型 消化内镜下用活检钳取息肉或肿瘤活组织标本,置于4%的甲醛溶液中固定后,常规行乙醇脱水、二甲苯透明、石蜡包埋、切片、捞片、烤片及苏木精-伊红染色,镜下观察组织病理类型。
1.4.2检测PMS2、MSH6、C-met表达水平 采用免疫组织化学法进行检测,另取备用标本切片并置于60 ℃恒温箱中烤片90 min后,依次于二甲苯及梯度乙醇中浸泡透明、脱蜡;PBS冲洗3次,每次5 min,柠檬酸钠抗原修复液微波修复20 min;自然冷却后,PBS冲洗3次,每次5 min,加入3% H2O2室温孵育20 min;PBS冲洗3次,每次5 min,加入山羊血清封闭15 min;弃血清,加入一抗4 ℃孵育过夜;自然回温后,PBS冲洗3次,每次5 min,加入生物素标记二抗室温孵育20 min;PBS冲洗3次,每次5 min,加入链霉亲和素-过氧化物酶室温孵育20 min;PBS冲洗3次,每次5 min,二氨基联苯胺显色剂室温显色;自来水冲洗终止反应,苏木素复染3 min,流动自来水冲洗至无色;1%盐酸乙醇分化,自来水冲洗后,依次于梯度乙醇及二甲苯中浸泡脱水、透明,中性树胶封片。
以胞质呈现棕黄和(或)棕褐色的细胞为阳性细胞,用半定量法判定PMS2、MSH6、C-met表达情况,高倍镜下(×400)每张切片随机选取5个视野计算阳性细胞百分比,结果取平均值。无阳性细胞记为0分,阳性细胞比值≤10%记为1分,10%<阳性细胞比值≤50%记为2分,50%<阳性细胞比值≤75%记为3分,阳性细胞比值>75%记为4分;无着色记为0分,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分。两项得分相乘≥3分即为表达阳性[8]。
2 结 果
2.1胃息肉及胃癌组织中PMS2、MSH6、C-met表达情况比较 不同病理类型胃息肉及胃癌组织中PMS2、MSH6、C-met阳性表达率比较差异有统计学意义(P<0.01),与增生性息肉组比较,腺瘤性息肉组、胃底腺息肉组、胃癌组的PMS2、MSH6阳性表达率降低(P<0.05),炎性息肉组PMS2的阳性表达率升高(P<0.05),炎性息肉组MSH6阳性表达率比较差异无统计学意义(P>0.05);与腺瘤性息肉组比较,胃底腺息肉组和炎性息肉组PMS2、MSH6阳性表达率升高(P<0.05),胃癌组PMS2阳性表达率比较差异无统计学意义(P>0.05),胃癌组MSH6阳性表达率降低(P<0.05);与胃底腺息肉组比较,炎性息肉组PMS2、MSH6阳性表达率升高(P<0.05),胃癌组PMS2、MSH6阳性表达率降低(P<0.05);与炎性息肉组比较,胃癌组PMS2、MSH6阳性表达率降低(P<0.05)。与增生性息肉组比较,腺瘤性息肉组、胃底腺息肉组、胃癌组的C-met阳性表达率升高(P<0.05),炎性息肉组降低(P<0.05);与腺瘤性息肉组比较,胃底腺息肉组差异无统计学意义(P>0.05), 炎性息肉组降低(P<0.05),胃癌组升高(P<0.05);与胃底腺息肉组比较,炎性息肉组降低(P<0.05),胃癌组升高(P<0.05);与炎性息肉组比较,胃癌组升高(P<0.05)。见表1、图1。
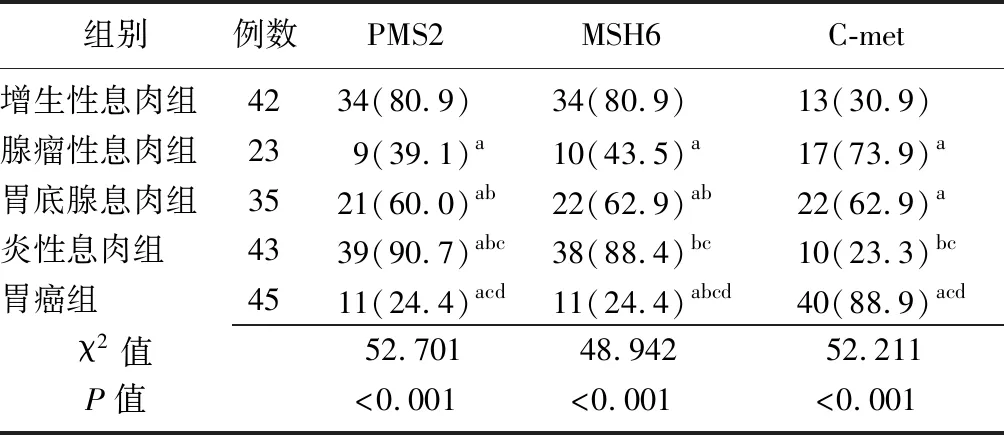
表1 胃息肉及胃癌组织内PMS2、MSH6、C-met阳性表达率比较 [例(%)]
2.2PMS2、MSH6、C-met表达水平与胃息肉病理类型及病变严重程度的相关性 Spearman相关分析结果显示,PMS2、MSH6与胃息肉病理类型及病变严重程度呈负相关(r=-0.324、r=-0.319、r=0.298,均P<0.001),C-met与胃息肉病理类型及病变严重程度呈正相关(r=0.298,P<0.001)。
2.3PMS2、MSH6、C-met在胃息肉及胃癌组织中表达的相关性 Spearman相关分析结果显示,胃息肉及胃癌组织中PMS2与MSH6的表达呈正相关(r=0.796,P<0.001),PMS2、MSH6与C-met的表达呈负相关(r=-0.492、r=-0.483,均P<0.001)。
2.4PMS2、MSH6、C-met在胃息肉向胃癌转化中的诊断价值 PMS2预测胃息肉向胃癌转化的ROC曲线下面积(area under curve,AUC)为0.878,当临界值为35.6%时,灵敏度为83.3%,特异度为74.8%;MSH6预测胃息肉向胃癌转化的ROC曲线下面积为0.865,当临界值为35.6%时,灵敏度为82.5%,特异度为73.6%;C-met预测胃息肉向胃癌转化的ROC曲线下面积为0.837,当临界值为74.5%时,灵敏度为77.8%,特异度为71.2%。见表2、图2。
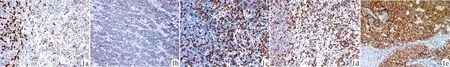
1a:炎性息肉组织(×200);1b:增生性息肉组织(×200);1c:胃底腺息肉组织(×200);1d:腺瘤性息肉组织(×200);1e:胃癌组织(×400);C-met:细胞间质表皮转化因子
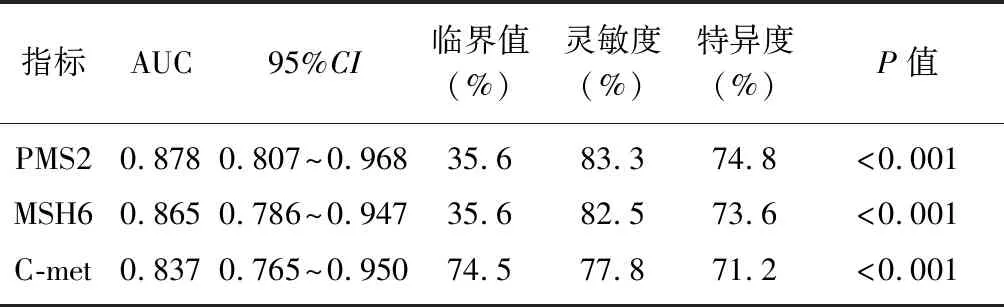
表2 PMS2、MSH6、C-met在胃息肉向胃癌转化中的诊断价值
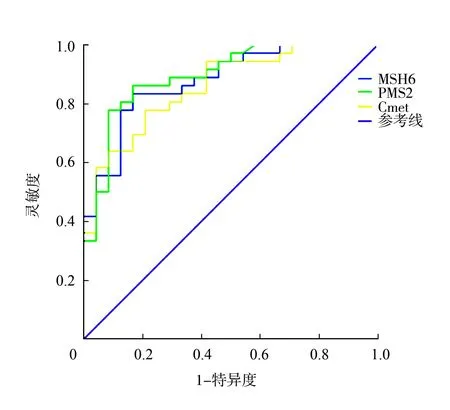
C-met:细胞间质表皮转化因子;ROC:受试者工作特征曲线
3 讨 论
胃息肉常发生于胃体及胃窦,表面多光滑,与周围组织界限清楚,其发病与外界因素及胃内微环境变化有关。研究显示,随着质子泵抑制剂的广泛应用、幽门螺杆菌根除治疗的普及推广,胃息肉的病理类型已由原来的增生性息肉为主(约占70.0%)逐渐演变为胃底腺息肉为主(约占77.0%,而增生性息肉仅占约17.0%)[9-10],特别是长期应用质子泵抑制剂已成为胃底腺息肉大幅增加的主要原因[11]。相关研究表明,胃息肉的存在与胃癌的发生发展密切相关,且不同病理类型胃息肉发展为胃癌的概率也不同,其中腺瘤性息肉发展为胃癌的概率明显高于其他类型[12],尽早明确胃息肉类型对患者预后具有重要意义。近年来有学者指出,错配修复基因中的PMS2、MSH6及原癌基因C-met均可参与胃息肉向胃癌的发展,检测其表达水平对胃癌的预防及治疗具有指导意义[13]。
正常情况下,人体中时刻都发生着基因的重组与复制,在此过程中不可避免地会出现碱基的错配与重组的错配,错配修复可检测并纠正错配、缺失及异常插入的核苷酸序列而保持基因遗传的正确性和稳定性。但错配修复相关基因一旦发生突变就会出现错配修复功能失效,导致微卫星不稳定及基因错误修复,且微卫星不稳定可进一步导致抑癌基因失活,致癌基因激活,从而增加细胞突变及恶变的概率[14-15]。PMS2、MSH6均属于错配修复基因,刘杰等[13]研究指出PMS2、MSH6突变可导致胃息肉向胃癌发展。其原因是PMS2、MSH6的阳性表达提示修复系统的存在,可纠正基因复制与重组过程中的错误,使生物体的遗传具有正确性和稳定性,从而避免肿瘤恶变;而PMS2、MSH6阴性表达则说明修复系统失活,无法纠正基因复制和重组过程中的错误,从而促进恶性肿瘤的发生发展[16-17]。C-met由原癌基因编码合成,具有酪氨酸激酶活性,是重要的肝细胞生长因子受体,除在细胞间传导信息外,还可控制细胞骨架的重排,在细胞的增殖、分化过程中发挥着重要作用[18-19]。正常情况下,机体组织内C-met表达水平较低,而正常组织发生恶变时其表达水平明显升高,并可通过自分泌或旁分泌方式激活多种信号通路而参与恶性肿瘤的发生发展[20-21]。
本研究结果显示,不同病理类型胃息肉及胃癌组织中PMS2、MSH6、C-met阳性表达率比较差异有统计学意义(P<0.01),其中PMS2、MSH6的阳性表达率比较,胃癌组织<腺瘤性息肉<胃底腺息肉<增生性息肉<炎性息肉;C-met阳性表达率比较,胃癌组织>腺瘤性息肉>胃底腺息肉>增生性息肉>炎性息肉;相关分析结果显示,PMS2、MSH6、C-met表达水平与胃息肉病理类型及病变严重程度呈显著相关性,且PMS2表达与MSH6表达呈正相关,PMS2、MSH6表达与C-met表达呈负相关。这一结果说明,PMS2、MSH6、C-met参与不同病理类型胃息肉向胃癌的发生发展,其中PMS2、MSH6在炎性息肉组织内的阳性表达率最高,可阻止胃息肉向胃癌的演变,而C-met在腺瘤性息肉组织内的阳性表达率最高,可促进胃息肉向胃癌的演变,与既往研究显示的腺瘤性息肉癌变率最高且PMS2、MSH6表达与C-met表达呈负相关的结果相一致[12,16]。另外,本研究经ROC曲线分析结果显示,PMS2预测胃息肉向胃癌转化的灵敏度为83.3%、特异度为74.8%,MSH6预测胃息肉向胃癌转化的灵敏度为82.5%、特异度为73.6%,C-met预测胃息肉向胃癌转化的灵敏度为77.8%,特异度为71.2%。明确胃息肉的病理类型并检测PMS2、MSH6、C-met表达情况对防治胃息肉向胃癌转化具有重要意义。
综上所述,不同病理类型胃息肉及胃癌组织中PMS2、MSH6、C-met阳性表达率不同,PMS2、MSH6、C-met表达情况与胃息肉病理类型及病变严重程度显著相关,推测PMS2、MSH6、C-met可能参与不同病理类型胃息肉向胃癌的发生发展。但本研究样本量较小,有待进一步多中心大样本研究的证实。
