两种营养不良风险筛查工具在原发性肝癌住院患者中的应用比较
2021-05-10朱娅鸽吴宇超王娟陈天艳杨瑗
朱娅鸽,吴宇超,王娟,陈天艳,杨瑗
(西安交通大学第一附属医院感染科,西安 710061)
原发性肝癌是我国第四位常见恶性肿瘤及第二位肿瘤致死病因[1-2],严重威胁着人类的生命健康。乙型肝炎病毒感染是我国原发性肝癌的主要病因,多数原发性肝癌患者合并有肝硬化,从而显著增加患者营养不良的发生风险。营养不良与肝硬化患者的肝功能失代偿、并发症发生、不良治疗结局密切相关,并可作为死亡相关的独立预测因子[3-4]。因此,对存在营养不良的患者进行早期识别以及必要的营养干预,可缩短平均住院时间,减少医疗费用,提高患者生活质量,延长生存时间[5-6]。然而,临床上营养不良风险筛查往往被忽视以及不同筛查工具的敏感性不同,使营养干预相对滞后[7]。英国皇家自由医院-营养优先次序工具(The Royal Free Hospital-nutritional prioritizing tool,RFH-NPT)是英国皇家自由医院开发的一种新型、方便、快捷、有效的针对肝硬化患者的营养风险筛查工具,国内外多项研究显示,与常用的营养风险筛查工具2002(nutritional risk screening 2002,NRS-2002)相比,RFH-NPT对肝硬化患者的营养风险筛查更敏感[8-10]。但有研究提出,NRS-2002可作为进展至肝癌的肝硬化患者营养不良风险筛查的工具[11]。目前尚缺乏RFH-NPT与NRS-2002两种营养不良风险筛查工具在住院原发性肝癌患者中的应用比较。本研究主要评价RFH-NPT与NRS-2002在原发性肝癌患者中的应用价值,筛选出更为敏感、便捷的方法,为临床实践中及时的营养干预提供可靠依据。
1 资料与方法
1.1一般资料 选择2018年6月至2019年1月西安交通大学第一附属医院住院的115例原发性肝癌患者作为研究对象,其中男81例、女34例,年龄27~83岁,平均(51±13)岁。纳入标准:①年龄≥18周岁;②符合我国《原发性肝癌诊疗规范(2017年版)》[12]的诊断标准;③患者均能回答提问和配合相关测量;④患者均签署了知情同意书。排除意识障碍、合并其他代谢性疾病者,如合并糖尿病,甲状腺功能异常。本研究经西安交通大学第一附属医院伦理委员会审核批准。
1.2研究方法 在患者入院24 h内,通过翻阅病历记录、现场人体成分测量、座谈等方式,收集患者个人信息及疾病相关资料并进行营养不良风险评估。
1.2.1人体成分测量 包括身高、体重、上臂围(arm circumference,AC)和肱三头肌皮褶厚度(triceps skinfold,TSF)。体质指数(body mass index,BMI)=体重(kg)/身高2(m2),上臂肌围(arm muscle circumference,AMC)=AC(cm)-3.14×TSF(cm)。收集患者生化指标(肝肾功能、电解质、血常规、凝血功能、甲胎蛋白定量)及影像学资料(上腹部B超、CT、磁共振成像)。
1.2.2Child-Turcotte Pugh(CTP)分级和终末期肝病模型(model for end-stage liver disease,MELD)评分 CTP分级根据血清白蛋白、总胆红素、腹腔积液、意识状况、凝血酶原时间结果进行评分,总分5~6分为A级,7~9分为B级,≥10分为C级;MELD评分:根据总胆红素、凝血酶原时间国际标准化比值、血清肌酐及病因进行计算。
1.2.3NRS-2002 根据Kondrup等[13]采用的评分方法进行评估,评分指标包括BMI、近期体重变化、进食量变化、疾病严重程度和年龄5个方面,若患者年龄>70岁总分加1分,最终各项评分相加为NRS-2002的总分。总评分≥3分(或伴有胸腔积液、腹水、双下肢水肿且血清白蛋白<35 g/L)表示患者有营养不良风险,总评分<3分为无营养不良风险。
1.2.4RFH-NPT 参照RFH-NPT量表[14],通过简单的临床问题(了解进食、体重变化、体液潴留情况等)进行评分,依据最终的评分进行营养风险评估,<1分为低风险,≥1分为中高风险。
1.2.5主观全面评定法(subjective global assessment,SGA) 通过近期体重改变、饮食变化、胃肠道症状、活动能力情况、应激反应、肌肉消耗、测量肱三头肌皮褶厚度、检查踝部水肿情况8个方面进行评定,根据不同的情况判定为A、B、C级,至少有5项属于B级或C级者评定为中度或重度营养不良[15]。

2 结 果
2.1一般情况 CTP分级:A级41例,B级48例,C级26例。MELD评分:<15分96例,≥15分19例。BMI 16.8~29.7 kg/m2,平均(21.5±2.9) kg/m2;男性TSF 3.9~40.0 mm,平均(14.9±6.9) mm,女性 TSF 6.5~45.1 mm,平均(18.9±6.5) mm;男性AC 16.3~37.0 cm,平均(21.5±3.8) cm,女性AC 19.6~33.4 cm,平均(24.4±4.9) cm;男性AMC 13.9~25.6 cm,平均(16.8±2.8) cm,女性AMC 14.9~25.5 cm,平均(18.5±3.9) cm。总蛋白(total protein,TP)48.8~85.4 g/L,平均(62.0±7.0) g/L;白蛋白(albumin,ALB)22.2~45.9 g/L,平均(32.9±4.6) g/L;前白蛋白(pre-albumin,PAB)10.3~226.3 g/L,中位PAB 94.0 g/L。
2.2NRS-2002与RFH-NPT筛查结果有无营养风险组传统营养指标的比较 NRS-2002对原发性肝癌患者进行营养不良风险筛查,营养不良风险组BMI显著低于无营养不良风险组(P<0.05),而两组间AMC、TP、ALB、PAB比较差异无统计学意义(P>0.05)。RFH-NPT对原发性肝癌患者进行营养不良风险筛查,营养不良风险组BMI低于无营养不良风险组(P<0.05),两组AMC、TP、ALB、PAB比较差异无统计学意义(P>0.05),见表1。
2.3两种营养不良风险筛选工具的评价结果与临床指标的相关性 NRS-2002与BMI、AMC(男)、TP、PAB呈负相关(P<0.05),与CTP评分、MELD评分呈正相关(P<0.05),与AMC(女)、ALB无相关性(P>0.05);RFN-NPT与BMI、PAB呈负相关(P<0.05),与CTP评分、MELD评分呈正相关(P<0.05),与AMC(男)、AMC(女)、TP、ALB无相关性(P>0.05)。见表2。
2.4两种营养不良风险筛选工具筛查结果的比较 NRS-2002与NPT-RFH筛查营养不良风险的阳性率分别为58.3%(67/115)、79.1%(91/115),RFH-NPT筛查营养不良风险的阳性率显著高于NRS-2002(χ2=11.646,P=0.001)。对患者进行BMI、CTP分级分层分析,在BMI≥18.5 kg/m2、CTP A级原发性肝癌患者中,RFH-NPT筛查营养不良风险的阳性率高于NRS-2002(P<0.05);在BMI<18.5 kg/m2、CTP B级和C级原发性肝癌患者中,FH-NPT与NRS-2002筛查营养不良风险阳性率比较差异无统计学意义(P>0.05),见表3。
2.5基于SGA的两种营养不良筛查工具的效果比较 SGA评价结果为无营养不良者32例,营养不良者83例,营养不良阳性率为72.2%(83/115)。依据SGA评定结果,对NRS-2002与RFH-NPT营养不良风险筛查效果进行评价,NRS-2002与SGA具有一致性(Kappa=0.625,P<0.001);RFH-NPT与SGA具有较好的一致性(Kappa=0.812,P<0.001)。
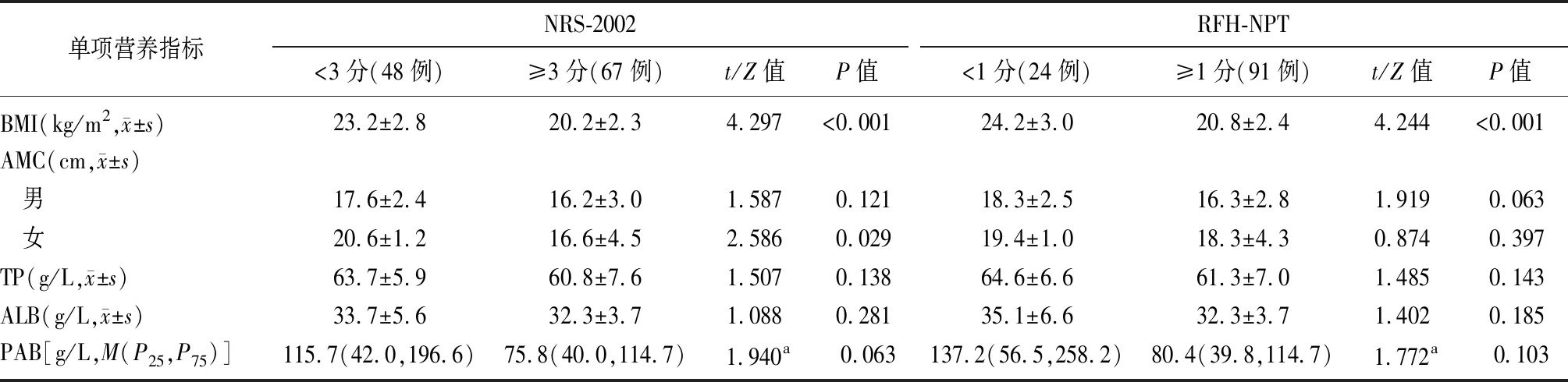
表1 NRS-2002与RFH-NPT筛查结果有无营养风险组传统营养指标的比较

表3 NRS-2002与RFH-NPT筛查营养不良风险阳性率比较 [例(%)]
RFH-NTP筛选营养不良风险的灵敏度高于NRS-2002(χ2=18.008,P<0.001),两种筛选营养不良风险的特异度比较差异无统计学意义(χ2=2.963,P=0.082),见表4。

表4 基于SGA比较NRS-2002与RFH-NPT的营养不良风险筛查效果 (例)
3 讨 论
既往研究提示,住院的恶性肿瘤患者超过60%存在营养不良风险,不同部位肿瘤发生的营养不良发生率存在一定差异,营养不良对患者临床结局(如感染相关并发症、切口愈合、皮肤压疮发生、自我感觉舒适度、理想和实际住院时间、质量调整寿命年、生存期)造成严重影响[16-19]。本研究对115例住院的原发性肝癌患者的营养风险及营养状况进行调查,利用SGA发现72.2%(83/115)的患者存在营养不良。既往研究显示,SGA对肝癌患者的营养评估更可靠[20],但该营养评定方法较为复杂,需要专业人员进行全面评估,可操作性差,不易临床广泛推广。因此,寻找高效、准确、易于操作的营养风险评估工具,建立合理的评估流程及营养治疗策略,对原发性肝癌患者的综合治疗具有重要的临床意义。
近年来多个营养不良风险筛查工具在临床上用于原发性肝癌患者营养风险的筛查与评估[21],但更加便捷、有效的营养不良筛选评估方法仍需要不同地区对更多患者进行临床调查研究。NRS-2002是在我国恶性肿瘤疾病中被首先推荐的营养风险筛查工具,在肝癌患者中得到广泛应用;RFH-NPT是一种设计简单、易操作的营养不良风险筛选工具,与肝硬化并发症、疾病严重程度及预后密切相关[22]。近年来越来越多的研究提出,RFH-NPT在临床中操作简便,部分研究发现其对肝硬化患者的营养风险筛查较传统的NRS-2002更为灵敏[8-10,23],但在原发性肝癌患者中的营养风险筛查效果仍缺乏相关研究。
本研究结果显示,RFH-NPT筛选出的具有营养不良风险的患者BMI显著低于无营养不良风险患者,与NRS-2002筛选结果一致;RFH-NPT筛查工具评分与BMI、PAB呈负相关,与CPT评分、MELD评分呈正相关,NRS-2002筛查工具评分与BMI、AMC(男)、TP、PAB呈负相关,与CPT评分、MELD评分呈正相关。NRS-2002筛选出58.3%的患者存在营养不良风险,而使用RFH-NPT工具筛选出79.1%的患者存在营养不良风险,显著高于NRS-2002。本研究对患者进行BMI、CTP分级分层分析,结果显示,在BMI≥18.5 kg/m2、CTP A级原发性肝癌患者中,RFH-NPT筛查营养不良风险的阳性率高于NRS-2002(P<0.05)。表明随着肝脏疾病进展、肝功能恶化,营养不良风险显著增加,这与既往两种营养不良风险筛选工具在肝硬化患者的筛选结果存在差异[9-10]。在肝硬化患者中,RFH-NPT对CPT C级患者的营养不良风险阳性率显著高于NRS-2002,而在CPT A级和B级患者中阳性率比较差异无统计学意义[9]。欧洲临床营养和代谢学会、欧洲肝病学会及我国肝病学会所发布的肝病营养指南提出[16,22,24],CPT C级的肝硬化患者存在较高的营养不良风险,直接进行详细营养评定以确定营养不良类型和程度,而对于其他终末期肝病患者需进行营养不良风险筛查。因此,CPT A级的原发性肝癌患者采用RFH-NPT工具进行早期营养不良风险筛查较NRS-2002更为灵敏,能够早期筛选出存在营养不良风险的人群并给予营养干预,早期改善营养不良状况,提高患者生存质量,延长生存时间。
SGA被广泛应用于肝病患者营养不良风险筛查,且被欧洲肠外肠内营养学会推荐应用于肝病患者的综合营养评估,以指导临床营养干预研究[15,22,24]。本研究结果显示,RFH-NPT和NRS-2002与SGA营养评定工具评定的营养不良状况具有较好的一致性,其中RFH-NPT与SGA的一致性优于NRS-2002,且RFH-NPT对肝癌患者营养不良风险筛查的灵敏度高于NRS-2002。因此,RFH-NPT工具对肝癌患者的营养不良筛查更灵敏。
综上所述,RFH-NPT可能是一种便捷、更适合肝癌患者营养不良风险筛查的工具,对肝癌患者营养不良风险的早期筛查更为灵敏。但本研究为单中心横断面研究,样本量有限,在未来的研究中,将进行前瞻性多中心研究,从而早期识别患者营养不良风险,预测患者的预后,及时实施营养干预,延长肝癌患者的生存期。
