壳聚糖/小干扰RNA溶液对大鼠原代心肌细胞转染方法学的研究△
2021-05-09马晓彬吴岳恒林吉进
马晓彬,吴岳恒,陈 景,林吉进
[1.华南理工大学医学院,广州 510006;2.广东省人民医院(广东省医学科学院)广东省心血管病研究所心内科,广州510080]
目前,心血管疾病是人类致死致残的主要原因之一,随着全球生态环境和人类生活方式的改变,以及在人口老龄化等因素的作用下,每年因心血管疾病死亡的人数逐渐增加。因此,如何增加心血管疾病药物治疗的安全性和有效性,是当下全球研究的热点之一。壳聚糖(chitosan,CS)是甲壳类动物外骨骼和真菌细胞壁中的结构元素几丁质脱乙酰后得到的,是一种可降解的多糖,由重复的D-葡萄糖胺和N-乙酰基-D-葡萄糖胺单元组成,通过1-4糖苷键连接[1-2]。CS具有毒性低、免疫原性低、生物相容性好的特点[1,3-5],其作为一种安全传递质粒DNA、寡核苷酸和小干扰RNA(small interfering RNA,siRNA)等基因材料的载体,已成为人们日益关注的非病毒载体之一。CS游离骨架上的氨基使其带正电荷,很容易与带负电荷的siRNA通过静电相互作用形成聚电解质复合物[1-2],并且可保证siRNA稳定不被降解。CS作为生物材料载体,已经在肿瘤[5-6]、肾脏[4,7]和心脏[2,8-9]等领域有广泛研究。本研究通过合成氮磷比为70∶1的CS/siRNA溶液,分析粒径分布和Zeta电位,验证其对1~3 d Sprague-Dawley(SD)大鼠原代心肌细胞活性的影响和转染效率,为今后CS/siRNA在心血管疾病动物模型的研究和临床心血管疾病药物治疗提供参考。
1 材料和方法
1.1 主要材料
1~3 d龄SD大鼠乳鼠由南方医科大学实验动物中心提供;0.25% 胰酶(Gibco,25200056);DMEM/F12培养液(Hyclone,SH30023.01);南美胎牛血清(Gibco,10270106);CS(MW=50-190 KDa,Sigma-Aldrich,448869);siRNA(吉玛基因):阴性对照siRNA(forward 5′-UUCUCCGAACGUGUCAC⁃GUTT-3′,reverse 5′-ACGUGACACGUUCGGAGA⁃ATT-3′,NC-siRNA),cy5修饰阴性对照siRNA(for⁃ward 5′-UUCUCCGAACGUGUCACGUTT-3′,re⁃verse 5′-ACGUGACACGUUCGGAGAATT-3′,cy5-NC-siRNA);CCK8(凯基,KGA317);Hoechst33342(DOJINDO,H342)。
1.2 主要仪器
活细胞成像系统(Essen BioScience,Incucyte Zoom);全波长酶标仪(Thermo Scientific,Multiskan GO);激光粒度分析仪(Anton Paar,Litesizer 500);激光共聚焦显微镜(德国徕卡仪器有限公司,徕卡TCS SP5)。
1.3 壳聚糖溶液和壳聚糖/NC-小干扰RNA溶液的制备与评估
将20 mL pH为5.5的无菌醋酸钠溶液缓慢加入含有20 mg CS颗粒的无菌小烧杯中,边加边使用磁力搅拌器搅拌,常温持续搅拌2 h,而后将溶液加热至约60℃,继续搅拌15 min,整个过程保证无菌操作,得到约1 mg/mL的无菌CS溶液,将20 μL的NC-siRNA(100 μmol/L)溶液缓慢加入1 mL的CS(1 mg/mL)溶液中,使用漩涡混匀仪持续震荡2~3 min,得到CS/NC-siRNA溶液(浓度为1 mg/mL,氮磷比为70∶1),使用激光粒度分析仪(Anton Paar,Litesizer 500)评估相应的粒径大小和Zeta电位。
1.4 原代心肌细胞的提取与培养
将12只1~3 d的SD大鼠乳鼠心脏取出,放入装磷酸盐缓冲液(PBS)的无菌玻璃皿中,去除血液及可见的心房、血管组织,保留心室组织,而后转移至50 mL无菌离心管中,使用眼科剪将心室组织剪碎成1~2 mm3大小的均匀小块,于0.25%胰蛋白酶消化后将上清液转移至胎牛血清中终止消化,离心收集沉淀的细胞,将细胞使用培养基稀释,得到20 mL细胞悬液,接种于75培养瓶,2 h后收集未贴壁细胞,分别接种于96孔板和共聚焦皿。
1.5 壳聚糖/NC-小干扰RNA溶液对原代心肌细胞活性影响检测
将差速贴壁后原代心肌细胞悬液接种于96孔板,每孔100 μL。培养48 h后选取形态正常、搏动良好的原代心肌细胞进行实验。实验分为两大组,分别为12 h孵育组和24 h孵育组。12 h孵育组分别与7个不同浓度的CS/NC-siRNA孵育12 h(终浓度分别为0、4×10-3、8×10-3、12×10-3、16×10-3、20×10-3、24×10-3mg/mL,每个浓度6孔细胞);24 h孵育组分别与7个不同浓度的CS/NC-siRNA孵育24 h(终浓度分别为0、4×10-3、8×10-3、12×10-3、16×10-3、20×10-3、24×10-3mg/mL,每个浓度6孔细胞)。分别于孵育12 h和24 h后,应用CCK-8法细胞增殖检测试剂盒(凯基,KGA317)测定细胞活性。方法如试剂盒说明书所述,每100 μL细胞培养液内加入10 μL CCK8溶液。孵育2 h后,使用全波长酶标仪(Thermo Scientific,Multiskan GO)在450 nm波长处检测吸光度。以如下方法计算细胞活性:细胞活性(%)=(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%。
1.6 壳聚糖/cy5-NC-小干扰RNA溶液对原代心肌细胞转染的活细胞成像检测
选择12 h孵育组进行活细胞成像检测。将差速贴壁后原代心肌细胞悬液接种于96孔板,每孔100 μL。培养48 h后选取形态正常、搏动良好的原代心肌细胞进行实验。12 h孵育组分别与6个不同浓度的CS/cy5-NC-siRNA孵育12 h(终浓度分别为4×10-3、8×10-3、12×10-3、16×10-3、20×10-3、24×10-3 mg/mL,每个浓度2孔细胞),于孵育12 h后清洗并更换培养基,使用活细胞成像系统(Essen BioScience,Incucyte Zoom)观察各浓度组CS/cy5-NC-siRNA于12 h,24 h和48 h转染心肌细胞的情况,使用Image Pro Plus 6.0半定量分析对应红色荧光的灰度值。
1.7 壳聚糖/cy5-NC-小干扰RNA溶液对原代心肌细胞转染的激光共聚焦显微镜检测
选择12 h孵育组进行激光共聚焦显微镜检测。将差速贴壁后原代心肌细胞悬液接种于共聚焦皿,每个皿300 μL,使用培养基稀释至2 mL,充分摇匀细胞。培养48 h后选取形态正常、搏动良好的原代心肌细胞进行实验。12 h孵育组分别与2个不同浓度的CS/cy5-NC-siRNA孵育12 h(终浓度分别为20×10-3、24×10-3mg/mL,每个浓度对应1个共聚焦皿),于孵育12 h后清洗并更换培养基,24 h后每个共聚焦皿加入2 μL Hoechst 33342(DOJINDO,H342),充分摇匀,2~3 min后使用磷酸盐缓冲液清洗3次,更换新的培养基,使用激光共聚焦显微镜(德国徕卡仪器有限公司,徕卡TCS SP5)观察各浓度组CS/cy5-NC-siRNA于24 h转染心肌细胞情况。
1.8 统计学分析
采用GraphPad Prism 8.3.0和SPSS 25统计软件分析统计学数据。计量资料以()表示,单因素多组间均数比较采用one-way ANOVA,具有两个因素的多组间均数比较采用two-way ANOVA。以P<0.05表示差异有统计学意义。
2 结果
2.1 壳聚糖溶液和壳聚糖/NC-小干扰RNA溶液的制备与评估
激光粒度分析仪分析结果表明,氮磷比70∶1 CS/NC-siRNA纳米颗粒粒径为370.50 nm,Zeta电位为28.17 mV(具体见图1),而纳米颗粒(粒径小于1 000 nm)能够被细胞摄取,且粒径越小对细胞的毒性越小,Zeta电位水平表明溶液胶态分散相对稳定。
2.2 壳聚糖/NC-小干扰RNA溶液对原代心肌细胞活性影响的检测结果
细胞活性检测结果表明,12 h孵育组中0 mg/mL组细胞活性与其他浓度组相比,差异无统计学意义(P>0.05),见图2A;24 h孵育组中0 mg/mL组细胞活性明显高于4×10-3mg/mL组(P<0.0001)、8×10-3mg/mL组与16×10-3mg/mL组(P<0.001)、12×10-3mg/mL组与20×10-3mg/mL组(P<0.01)及24×10-3mg/mL组(P<0.05),见图2B;12 h孵育组中4×10-3mg/mL组、8×10-3mg/mL、12×10-3mg/mL组、16×10-3mg/mL组与24×10-3mg/mL组(P<0.000 1)和20×10-3mg/mL组(P<0.004 3)的细胞活性明显比24 h孵育组中对应浓度组的细胞活性高,见图2C。
2.3 壳聚糖/cy5-NC-小干扰RNA溶液对原代心肌细胞转染的活细胞成像检测结果
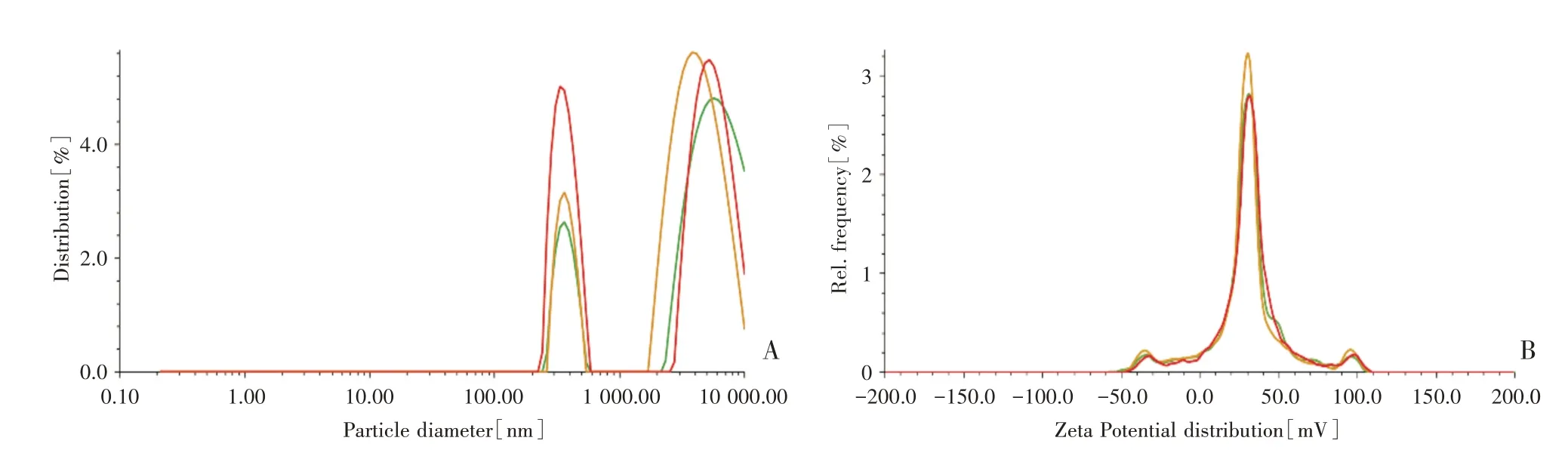
图1 CS/NC-siRNA颗粒粒径分布和Zeta电位分布(A:粒度仪检测CS/NC-siRNA颗粒粒径分布;B:粒度仪检测CS/NCsiRNA颗粒Zeta电位分布;每种颜色的曲线代表一次检测,每组CS/NC-siRNA颗粒均检测3次)
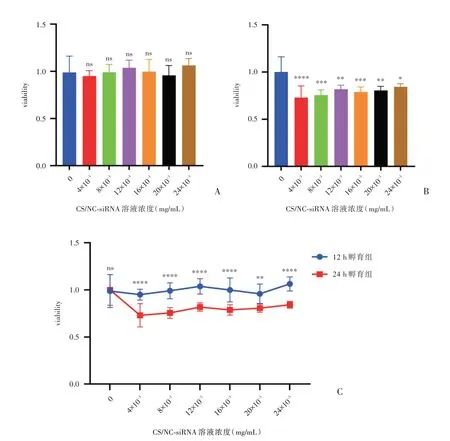
图2 CS/NC-siRNA溶液对原代心肌细胞活性的影响(A:12 h孵育组不同浓度CS/NC-siRNA溶液对心肌细胞活性的影响;B:24 h孵育组不同浓度CS/NC-siRNA溶液对心肌细胞活性的影响;C:12 h孵育组和24 h孵育组对应浓度CS/NC-siR⁃NA溶液对心肌细胞活性影响比较;*P<0.05,**P<0.01,***P<0.001,****P<0.0001;n=6)
根据活细胞成像系统检测结果,12 h孵育组中不同浓度CS/cy5-NC-siRNA溶液转染原代心肌细胞24 h后均能够较好地进入心肌细胞,并出现最亮红色荧光,转染48 h后4×10-3mg/mL组和8×10-3mg/mL组红色荧光有较明显衰减,而其余浓度组红色荧光未见明显衰减(见图3,图4);红色荧光灰度值半定量分析表明,各浓度组于转染24 h后转染效率均高于对应浓度组于转染12 h的转染效率(P<0.000 1),4×10-3mg/mL组和8×10-3mg/mL组于转染24 h后转染效率均高于对应浓度组于转染48 h的转染效率(P<0.000 1),而其他浓度组转染24 h和48 h的转染效率比较,差异无统计学意义(P>0.05),见图5A;20×10-3mg/mL组于转染24 h后转染效率与其他浓度组比较,差异无统计学意义(P>0.05);24×10-3mg/mL组于转染48 h后转染效率与20×10-3mg/mL组比较,差异无统计学意义(P>0.05),但明显高于其他浓度组(P<0.000 1),见图5B。
2.4 壳聚糖/cy5-NC-小干扰RNA溶液对原代心肌细胞转染的激光共聚焦显微镜检测结果
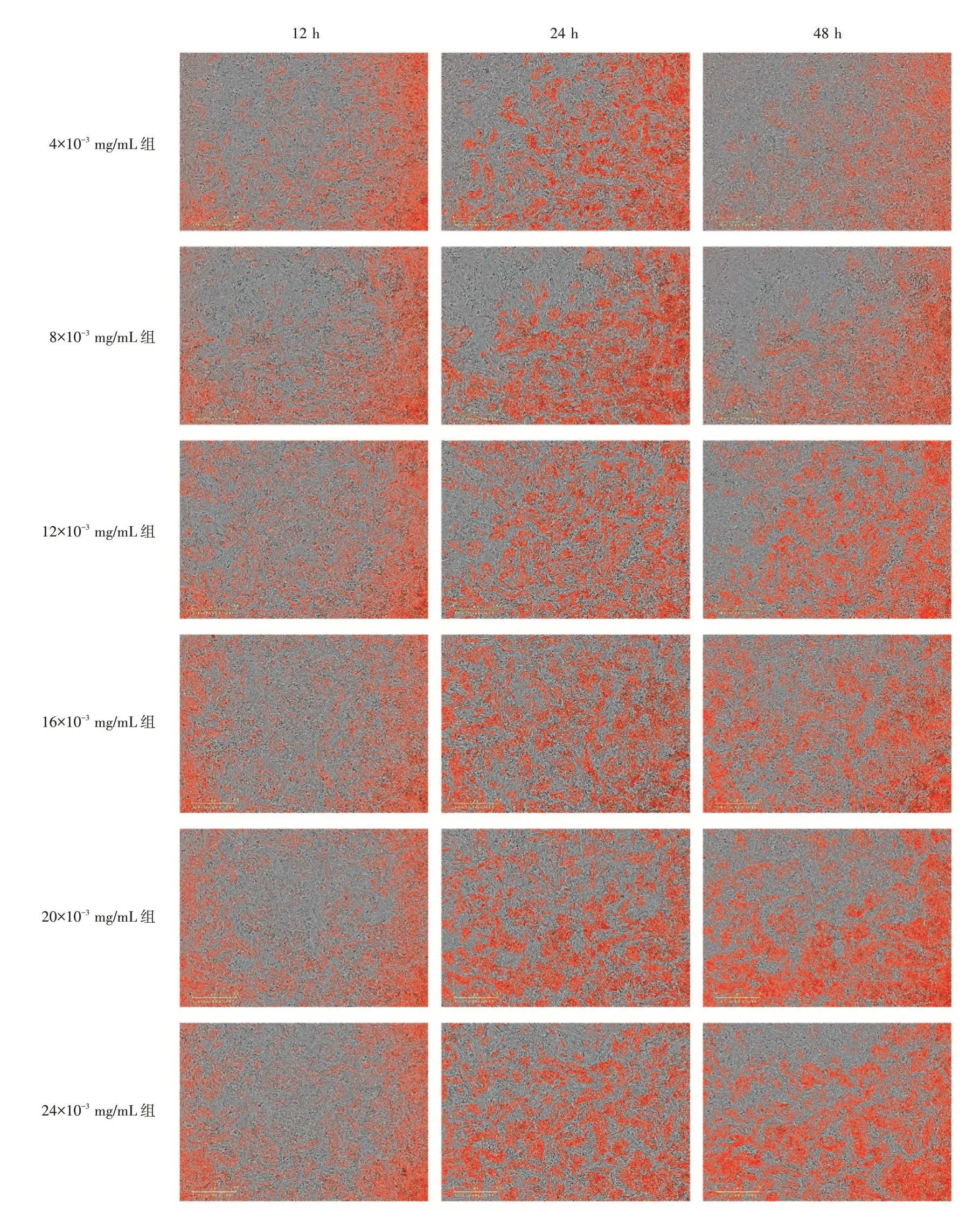
图3 CS/cy5-NC-siRNA溶液对原代心肌细胞的转染光学荧光图像(标尺=300 μm)

图4 CS/cy5-NC-siRNA对原代心肌细胞的转染光学荧光图像(去除细胞;标尺=300 μm)
激光共聚焦显微镜可见20×10-3mg/mL组和24×10-3mg/mL组于转染24 h后能充分转染原代心肌细胞,见图6A,且两者转染效率比较,差异无统计学意义(P>0.05),见图6B。
3 讨论
近年来,基因传递研究发展迅速,其成为一种未来临床应用治疗策略的巨大潜力而备受关注。siRNA长约20~25个碱基对,参与RNA干扰基因表达,具有特异性好和高效的特点[6-7]。siRNA被引入细胞后,与其他成分组装成含有核糖核酸内切酶的复合物,称为RNA诱导沉默复合物,而后通过siRNA链引导RNA诱导沉默复合物找到互补的mRNA分子,促使靶mRNA序列特异性降解[10]。但是,裸siRNA在血浆和细胞质中可被RNA酶快速降解,导致其半衰期短,而且细胞外的siRNA不能直接通过细胞膜扩散[1,11-12]。所以,直接应用裸siRNA面临易降解、细胞摄入差、转染效率低等问题[1]。因此,制备生物相容性高、毒性低、转染效率高和靶向性好的载体成为研究重点。
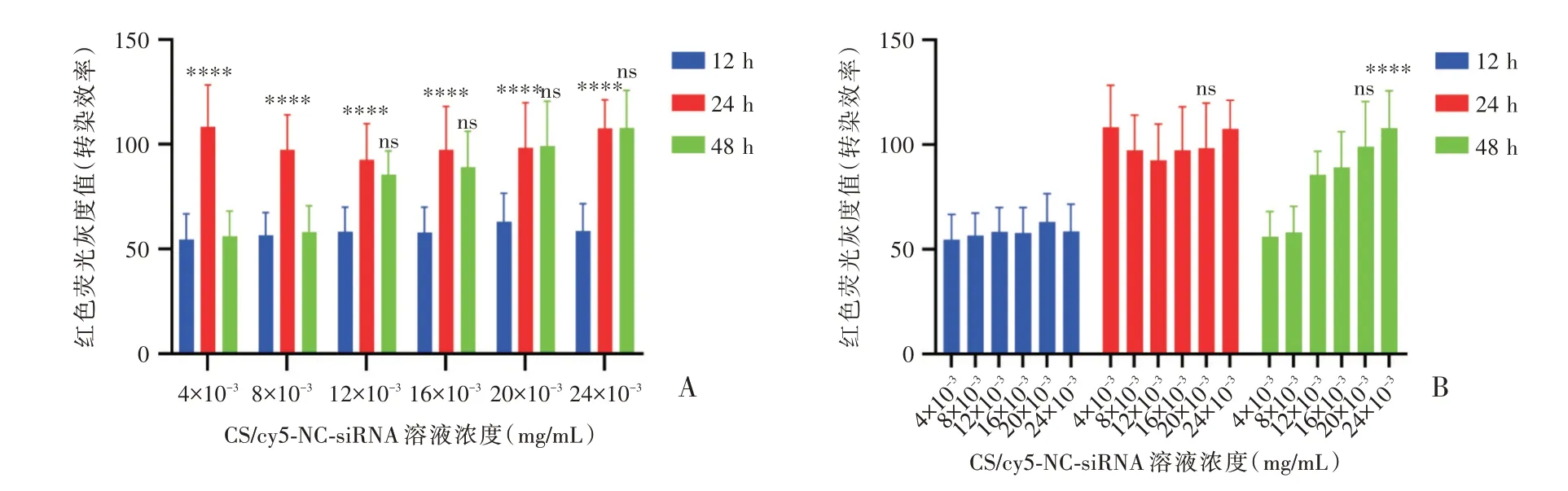
图5 12 h孵育组CS/cy5-NC-siRNA溶液对原代心肌细胞转染效率评估(A:相同浓度CS/cy5-NC-siRNA溶液在3个不同时间点对原代心肌细胞转染效率评估;B:不同浓度CS/cy5-NC-siRNA溶液在相同时间点对原代心肌细胞转染效率评估;****P<0.0001;n=30)

图6 激光共聚焦显微镜分析CS/cy5-NC-siRNA溶液对原代心肌细胞转染效率(标尺=50 μm,侧放大图标尺=10 μm;A:CS/cy5-NC-siRNA溶液对原代心肌细胞的转染;B:红色荧光灰度值半定量分析CS/cy5-NC-siRNA溶液对原代心肌细胞的转染效率,n=10)
目前,基因传递系统主要使用病毒或非病毒载体,将基因材料转染进入细胞,发挥相应的疗效。尽管病毒载体在体内有非常好的转染效果,但其主要缺点包括可能的毒性、免疫原性、炎症的诱发和基因突变等[1]。因此,使用非病毒载体传递基因材料越来越受人们关注。
CS作为低毒性和高生物相容性的生物材料,已经广泛应用于各个领域基础研究。CS包裹siR⁃NA组成纳米颗粒后,在体外和体内都有助于解决siRNA的细胞摄取不良和快速降解问题[13]。CS与siRNA组成复合物的转染效率取决于CS本身的分子量、脱乙酰化程度、两者之间的氮磷比和转染细胞类型[1]。有统计称,高分子质量的CS(80~300 KDa)与siRNA形成的纳米颗粒体外的基因沉默效率在50%以上,其他分子质量的CS均不能达到较好的基因沉默效果[3]。CS高度脱乙酰化(超过80%)被认为是siRNA介导高效敲除特异性mRNA的一个重要因素[1]。CS和siRNA组成复合物的氮磷比过低会使两者形成的复合物不稳定,同时细胞转染效率下降,而两者组成复合物的氮磷比过高,则细胞转染效率也会下降[1]。
目前,CS/siRNA已经广泛用于基础研究,对一些细胞模型和动物疾病模型的治疗效果也较好,然而其在心血管方面的研究依然较少。在Yang等[4]和Nawroth等[14]的研究中,使用氮磷比为63∶1的CS/siRNA分别对肾损伤和放射性纤维化动物模型进行治疗,均能取得较好疗效。因此,本研究选择氮磷比与之相近的CS/siRNA进行实验。其中,CS分子质量范围为50~190 KDa,脱乙酰化程度为75%~85%,配制氮磷比为70∶1的CS/siRNA,得到的CS/siRNA纳米颗粒粒径为370.50 nm,Zeta电位为28.17 mV。进一步研究发现,该溶液与原代心肌细胞孵育12 h可以减少细胞毒性,浓度为20×10-3mg/mL和24×10-3mg/mL的CS/siRNA溶液转染效率优于本实验其他浓度CS/siRNA溶液。然而,本实验使用的CS并未通过任何特定修饰,而特定修饰的CS可以增加CS/siRNA的稳定性和进一步减少细胞毒性[15-16]。
综上所述,本研究得到的氮磷比为70∶1的CS/siRNA在原代心肌细胞中有低毒性和转染效率高的特点,接下来还需要研究其经特定修饰后对心肌组织的靶向性及对动物模型的潜在毒性作用,并使用CS包裹特异的siRNA作用于特定的心肌细胞模型和相应的动物模型,验证相应的疗效,为临床心血管疾病的药物治疗提供一个新的方向。
