急性A型主动脉夹层伴灌注不良综合征术后死亡危险因素分析△
2021-05-09王晓武袁彬彬王显悦蔡治祥张卫达
林 曦,王晓武,马 涛,袁彬彬,王显悦,董 柱,蔡治祥,张卫达
[海军军医大学附属广州临床医学院(解放军南部战区总医院)心血管外科,广州510010]
急性A型主动脉夹层(acute type A aortic dis⁃section,AAAD)一直以来都是心血管外科最具挑战的疾病之一,尽管诊断技术不断提高以及各种主动脉手术方法的创新应用于临床,手术早期死亡率仍然居高不下。研究已明确,患者的术前状态及并发症与预后密切相关[1],这其中,肢体或各种脏器灌注不良综合征(malperfusion syndrome,MPS)对预后影响最大,术前并发MPS患者的手术死亡率要明显高于非并发MPS患者[2]。本研究旨在通过回顾性分析本中心AAAD并发MPS患者的临床资料,明确MPS患者术后死亡的危险因素,为更合理地制定临床治疗策略,改善患者预后及生存率提供参考。
1 资料和方法
1.1 一般资料
回顾性分析2006年8月至2018年9月期间海军军医大学附属广州临床医学院连续手术治疗的299例AAAD患者,通过询问病史、查体、经胸超声心动图、胸腹部计算机断层扫描(computed tomog⁃raphy,CT)或(和)冠状动脉计算机断层扫描血管造影(computed tomography angiography,CTA),以及术中探查来综合诊断MPS。根据AAAD并发MPS患者术后死亡与否,将研究总体分为死亡组和存活组,观察并记录两组患者的围术期资料。MPS的诊断依据[3]:有临床症状或体征的器官供血不足情况,导致组织器官功能障碍,可发生于1个或多个器官组织,如脑部(意识障碍、脑卒中或一过性脑缺血发作),心脏(心电图显示缺血改变、心肌酶谱提示心肌损害、术前冠状动脉造影或(和)CTA提示冠状动脉夹层),肢体(肢体疼痛或麻木、动脉搏动减弱或消失、感觉或运动功能减退或丧失等缺血症状),肠系膜(腹部压痛、肠麻痹、肝脏或胰腺功能损害、血便或黑便、主动脉CTA提示腹腔干和肠系膜动脉累及等),肾脏[肌酐浓度升高、无尿或少尿、主动脉CTA显示肾动脉受累和(或)肾脏无显影等]。排除标准:发病至就诊时间超过2周的亚急性或慢性患者、单纯壁间血肿型患者、局限于升主动脉的DebakeyⅡ型夹层患者、术前呼吸、心搏骤停抢救的患者。
一共有110例(36.8 %)AAAD患者诊断并发有MPS,其中男97例(88.2%),年龄(50.51±10.81)岁,术后死亡28例,纳入死亡组,其余82例存活患者纳入存活组。MPS发生在132个器官部位,其中脑部8例(7.3%),冠状动脉29例(26.4%),四肢38例(34.5%),肠系膜16例(14.5%),肾脏41例(37.3%),两个及以上器官25例(22.7%),见图1。

图1 患者灌注不良发生部位构成的饼形图
1.2 手术方法
患者全身麻醉,常规胸骨正中切口,游离主动脉弓部分支血管。(1)升主动脉置换/Bentall/半弓置换手术:采用右侧腋动脉及右心房插管行体外循环,部分患者同时行股动脉灌注。降温至32℃左右,阻闭升主动脉,切开升主动脉后直接冠状动脉冷灌HTK液使心脏停搏。清除夹层内血栓后,行升主动脉置换。如术中须探查主动脉弓部或行半弓置换,则持续降温至18℃~26℃后,阻闭头臂血管,开放主动脉阻闭钳,经右腋动脉单侧顺行脑灌注(2011年以后大部分患者采用右腋动脉+左颈总动脉双侧脑灌注法),完成主动脉远端吻合后恢复全身灌注并复温。(2)全弓置换手术:2012年以前均采用传统孙氏手术[4]。2012年至2016年,大部分患者采用“弓部优先”重建技术[5],首先取四分叉人工血管,在常温心脏搏动下依次行人工血管分支与三根头臂血管吻合。然后建立体外循环-打开主动脉弓部-释放胸降主动脉支架-吻合升主动脉远、近心端,最低鼻咽温度降至24℃。2017年以来,大部分患者采用“优化选择性动脉灌注”策略[6],同样右腋动脉+左颈总动脉双侧脑灌注,单侧股动脉插管行主动脉远端灌注。阻闭升主动脉,鼻咽温度降至26℃后,打开主动脉弓-释放胸降主动脉支架-四分叉人工血管吻合降主动脉切口,吻合完毕后再停股动脉灌注,经人工血管行远端主动脉顺行灌注。人工血管吻合主动脉根部切口后心脏复搏,最后再依次行人工血管分支与头臂血管吻合。术前有明显心肌缺血表现、术中探查夹层累及冠状动脉以及术后心脏复搏不良的患者同期行冠状动脉旁路移植术(coronary atery bypass grafting,CABG)。常规在体外循环停止前,使用残余主动脉壁或心包补片包裹人工血管,必要时与右心耳吻合行右心房分流术。手术后患者进入重症监护病房(ICU)密切监护,出现少尿、无尿或严重肾功能损害时,及时给予连续肾脏替代治疗(continuous renal replacement therapy,CRRT),个别患者应用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)辅助循环。
1.3 统计学分析
所有数据采用SPSS 24.0软件包进行分析。计量资料以()表示,组间比较采用独立样本t检验。计数资料以[n(%)]表示,组间比较采用四格表χ2检验和Fisher确切概率检验。将单因素分析有统计学差异的指标(P<0.05)纳入多因素Logistic回归分析,以向后逐步法确定患者术后死亡的独立危险因素。受试者工作特征(receiver operating characteristic,ROC)曲线评判所得独立危险因素以及联合预测概率的检验效能,计算曲线下面积(area under the curve,AUC)及95%可信区间(confidence interval,CI)。以P<0.05为差异有统计学意义,采用双侧检验。
2 结果
2.1 两组患者术前基线资料比较
两组患者的性别、年龄及体质量指数、头臂血管受累、动脉血乳酸浓度等比较,差异无统计学意义(均P>0.05);与存活组患者比较,死亡组患者的术前动脉血氧分压更低,急诊手术比率更高,术前血肌酐浓度更高,差异有统计学意义(均P<0.05);术前并发灌注不良脏器比较:死亡组患者并发肾脏和2个以上脏器灌注不良的发生率高于存活组患者,差异有统计学意义(均P<0.05);两组患者并发脑、心脏、四肢、肠系膜灌注不良发生率比较,差异无统计学意义(均P>0.05),详见表1和表2。
表1 两组患者术前计量基线资料比较 []
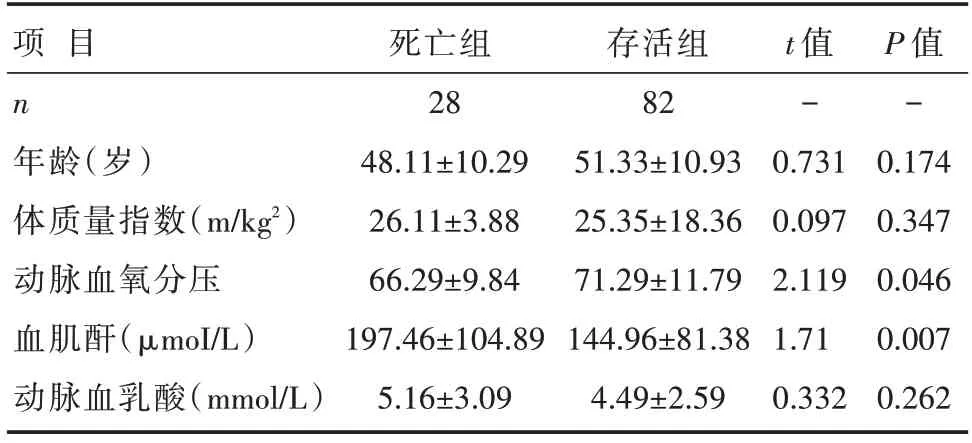
表1 两组患者术前计量基线资料比较 []
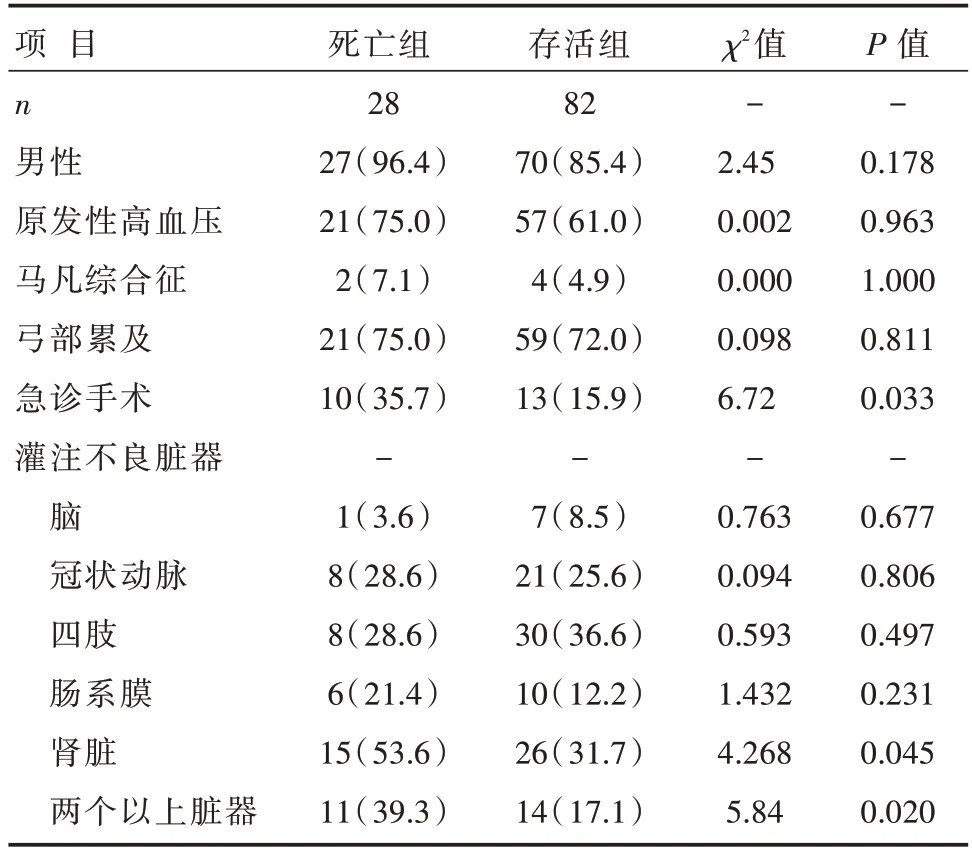
表2 两组患者术前计数基线资料比较 [n(%)]
2.2 两组患者术中临床资料比较
两组患者的手术方式(非全弓置换/全弓置换:孙氏手术、弓部优先手术、优化动脉灌注策略)、并发CABG比例、双侧脑灌注比例以及术中最低鼻咽温度比较,差异无统计学意义(均P>0.05);与存活组患者比较,死亡组患者的体外循环时间、主动脉阻闭时间、低流量脑灌注时间要更长,差异有统计学意义(均P<0.05),见表3和表4。
2.3 两组患者术后情况比较
两组患者术后用血量及并发症:死亡组患者脓毒症、CRRT、恶性心律失常发生率均明显高于存活组,差异有统计学意义(均P<0.05);死亡组患者二次开胸和短暂性神经功能障碍(temporary neurolo⁃gical dysfunction,TND)发生率低于存活组,但差异无统计学意义(均P>0.05);死亡组的用血量[(15.65±9.35)Uvs.(13.47±7.01)U,P>0.05]、永久性神经功能障碍(permanent neurological dysfunction,PND)、低心排血量综合征发生率均明显高于存活组,但差异无统计学意义(均P>0.05),详见表5。
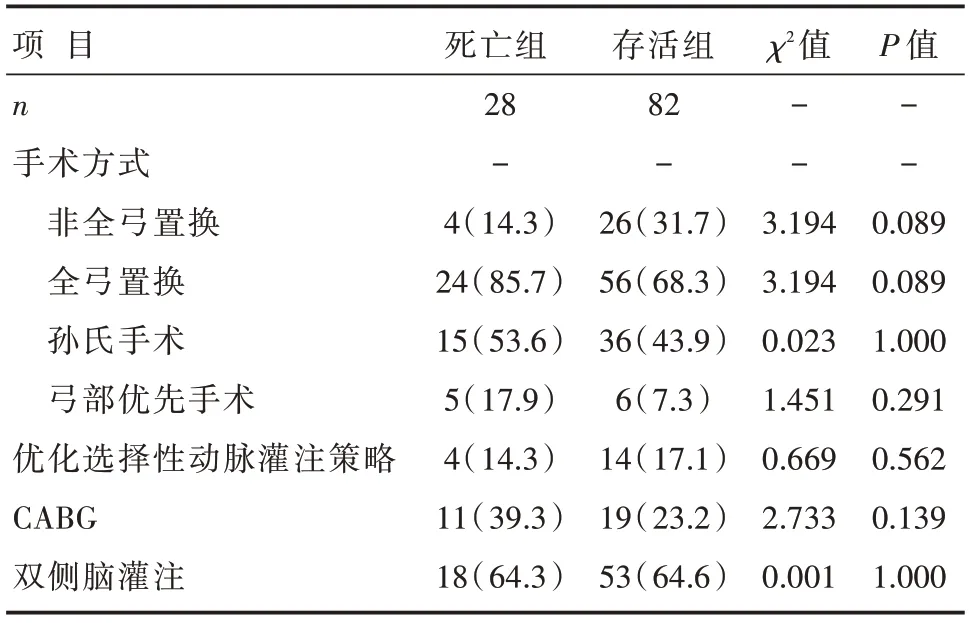
表3 两组患者术中计数临床资料比较 [n(%)]
表4 两组患者术中计量临床资料比较 []
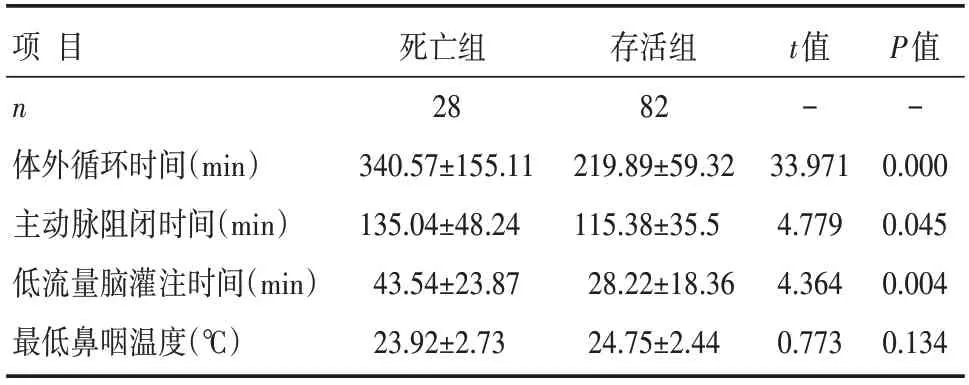
表4 两组患者术中计量临床资料比较 []
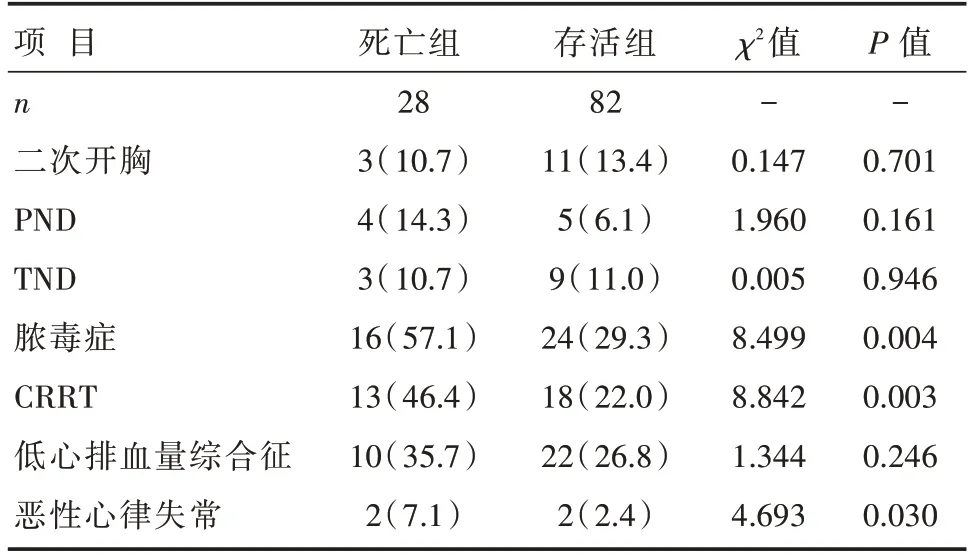
表5 两组患者术后并发症情况比较 [n(%)]
2.4 多因素Logistic回归分析结果
将单因素比较差异有统计学意义的指标:动脉血氧分压、血肌酐浓度、急诊手术、肾脏灌注不良、2个及以上脏器灌注不良全弓置换手术、体外循环时间、主动脉阻闭时间、低流量脑灌注时间、脓毒症、CRRT、恶性心律失常(P均<0.05)纳入患者术后死亡的多因素Logistic回归分析,采用向后逐步法。其中计量资料以均值做为分界值进行二分类赋值。最后得出:2个以上脏器灌注不良、急诊手术、体外循环时间>240 min、主动脉阻闭时间>120 min是AAAD并发MPS术后死亡的独立危险因素,见表6。

表6 多因素Logistic回归分析结果
2.5 受试者工作特征曲线评价危险因素预测效能的结果
以各独立危险因素以及Logit(P)(联合预测概率)进行多变量ROC曲线分析,结果见图2。联合预测概率的AUC为0.896,95%CI:0.835~0.958,有统计学意义(P<0.01),预测敏感性为92.9%,特异性为51.2%。2个以上脏器灌注不良的AUC为0.687,95%CI:0.570~0.805,P=0.003;急诊手术的AUC为0.653,95%CI:0.527~0.778,P=0.016;体外循环时间>240 min的AUC为0.699,95%CI:0.591~0.808,P=0.002;主动脉阻闭时间>120 min的AUC为0.632,95%CI:0.514~0.750,P=0.038。ROC曲线分析评价结果显示4个独立危险因素AUC均>0.5,且P均<0.05,有统计学意义,说明对预测AAAD并发MPS患者术后死亡有意义,且诊断效能大。
3 讨论
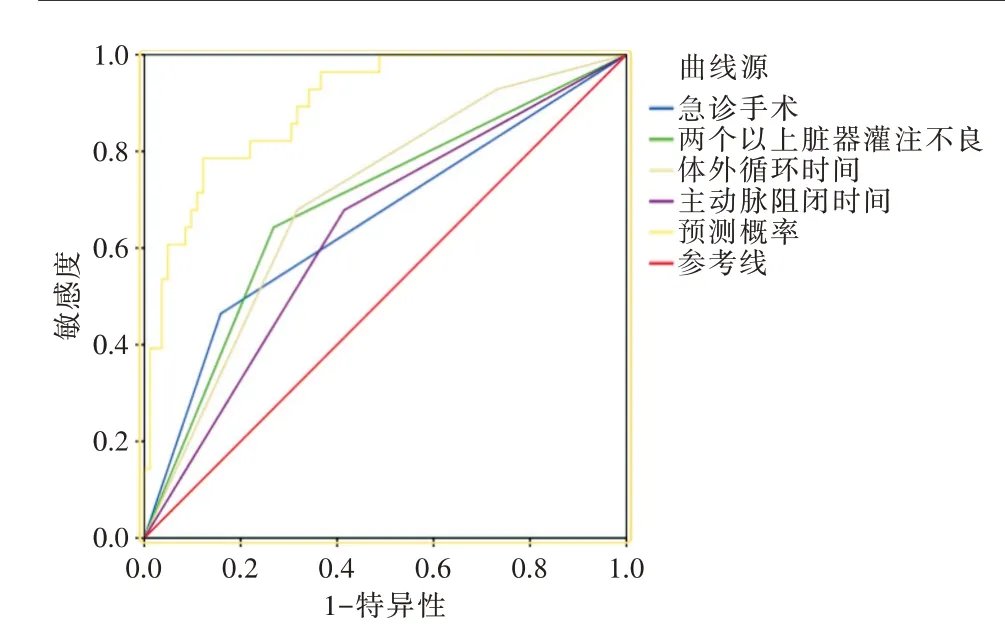
图2 危险因素的ROC曲线图
近年来,随着诊断技术和认识的提高,在接受手术的AAAD患者中,据报道20%~40%术前并发MPS[3,7](本中心为36.8%)。MPS的发生通常认为是由于夹层撕裂后,真腔塌陷以及假腔压迫真腔引起狭窄导致脏器缺血,进而引发功能障碍。Chung等[8]通过建立血流动力学模型显示真腔塌陷的机制:(1)大的内膜破口导致大量血流入假腔而没有出口再进入真腔;(2)由于真腔血管阻力下降进而导致低心排血量的发生。Orihashi[9]通过研究肠系膜灌注不良患者,认为导致灌注不良的原因应分为夹层假腔压迫型(动力型)和分支血管栓塞型(静力型)。动力型应尽早行外科主要手术处理,静力型则优选内科介入“开窗”或支架植入。MPS是一种严重的主动脉夹层并发症,导致不良预后,手术死亡率高达29%~89%[7,10-11](本中心为25.5%)。虽然手术预后的改善有待于手术策略、体外循环技术、器官保护技术以及重症监护病房管理等综合因素提高,但对患者术前状况的细致评估,参考有价值的危险预测因素,将有利于判断患者手术风险以及选择合适的治疗策略。Czerny等[7]回顾性分析了2 137例急性夹层手术患者资料,33.6%患者术前并发各个部位器官的灌注不良。经多因素分析得出,年龄、肠系膜灌注不良、累及弓部分支、冠状动脉灌注不良、脊髓灌注不良、降主动脉内膜破口以及术前昏迷状态是患者死亡的独立危险因素。作者认为,鉴于并发灌注不良对临床预后的严重影响,A型夹层应分为两个亚型:无灌注不良型和伴灌注不良型。
本研究中,死亡组患者的全弓置换比例要更高(85.7%vs.68.3%),但差异无统计学意义(P=0.089)。关于是否行全弓置换,很多医生考虑到手术风险和死亡率,选择将手术范围局限在升主动脉。毋庸置疑,这将保持更高的手术成功率,但导致了更高的再手术比例。本中心通过持续改进全弓置换术中的手术技术策略(孙氏手术-弓部优先策略-优化选择性动脉灌注策略),以期缩短手术时间、减少手术创伤、提供更好的器官保护,取得良好的近期效果,中远期疗效有待进一步分析总结。另外,死亡组术中行CABG的患者比例也高于存活组(39.3%vs.23.2%),但差异无统计学意义(P=0.139)。由于急诊患者CTA评估不完全、冠状动脉造影限制、心电图特异性不强等原因,术前诊断冠状动脉灌注不良一直是困扰我们的一个难点,大部分患者确诊只能通过术中探查判断。近期一项研究显示,通过常规术前冠状动脉造影发现21%的灌注患者并发有冠状动脉粥样硬化性心脏病(冠心病)[12]。Neri等[13]报道了24例主动脉夹层并发冠状动脉灌注不良患者急诊手术情况,发生率为11.3%(24/211),手术死亡率为20%。本中心策略:通过尽快手术及时恢复患者心肌血供,另外制定更好的心肌保护策略,比如在停搏过程中经冠状静脉窦行间断逆行血流灌注。
本研究得出2个以上脏器灌注不良为夹层手术死亡的独立危险因素,这方面各项报道均趋于一致意见:AAAD患者术前并发多个脏器灌注不良,可显著增加手术死亡率。前面Czerny等[7]的研究即显示,术前并发3个器官灌注不良的手术死亡率高达43.5%,2个是30.9%。本研究中,并发2个以上脏器灌注不良患者手术死亡率是44%,是科室同期无脏器灌注不良夹层患者术后死亡率(17.5%)的2.5倍[14],提示临床医师对AAAD并发MPS患者的手术指征把握要更为精准和慎重。
关于手术时机,目前研究观点各不相同:有的作者鉴于并发灌注不良会明显增加患者手术风险及死亡率,倾向于急诊手术治疗,以尽快恢复真腔灌注,使假腔减压,进而解除主动脉主要分支的梗阻。Chiu等[15]报道了305例AAAD(均累及弓部)行急诊手术治疗,根据术前是否并发器官灌注不良分为灌注不良组、非灌注不良组。中期随访发现,两组死亡率、平均生存时间差异无统计学意义(P>0.05),但灌注不良组主动脉弓部分支再干预率要显著高于对照组(12.5%vs.5.7%,P=0.00)。作者认为:伴有灌注不良的患者,传统理念“aortic-first”(主动脉修复优先)仍然适用。Nakamura等[16]均报道了对AAAD术前并发脑灌注不良患者急诊行主动脉修复手术,取得了很好的近期疗效,认为急诊手术是安全的,有利于积极改善患者的神经系统症状。但近年来,腔内隔绝技术和杂交手术更多替代了传统开胸手术。Patel等[17]报道了一组10年196例主动脉夹层患者手术情况,其中70例患者并发脏器灌注不良。作者研究发现,对并发灌注不良,尤其是累及多个脏器的患者应遵循“腔内优先”策略,先解除灌注不良,主动脉主要修复手术应推迟至合适时机。虽然增加了主动脉破裂风险,但存活下来的患者拥有与无灌注不良患者相似的手术死亡率和远期生存率。另一篇最新的20年随访研究显示,AAAD并发肠系膜灌注不良患者首先采用介入治疗方法(包括内膜开窗及支架植入),再行主动脉夹层修复手术,手术死亡率下降2.1%,患者生存率获得提高,术后随访远期生存率与无灌注不良患者对比,差异无统计学意义(P>0.05)[18]。研究结论支持在开放手术前,优先纠正肠系膜动脉缺血情况。本研究中,急诊手术是患者术后死亡的独立危险因素,死亡组患者的急诊手术比例确实明显高于存活组,差异有统计学意义(29.7%vs.14.3%,P=0.039)。一方面说明急诊手术确实增加了手术风险和死亡率,另一方面也可能与死亡组的患者病情更复杂,灌注不良更严重,无法推迟手术有关。而且,国内目前仅有几个大的心脏外科中心建设有杂交手术室,相当一部分AAAD患者没有条件接受杂交手术治疗,延期手术又增加了患者的术前死亡风险和医疗负担。关于手术时机的选择值得进一步开展研究。
众多研究均证实体外循环时间、主动脉阻闭时间是患者术后死亡的危险因素[19-20],长时间的心脏停搏和转机可导致心肌、肾脏、脑等重要脏器组织损害加重。本研究结果也显示,体外循环时间>240 min、主动脉阻闭时间>120 min是患者术后死亡的独立危险因素。分析具体患者的临床资料,死亡组患者主动脉阻闭时间与体外循环时间的过长,原因多与术中合并CABG、复搏后出现严重低心排血量综合征须长时间体外循环辅助、止血困难等相关。通过更精确的诊断,改进手术方法,采用综合止血技术是应对策略。本课题组于浩等[6]的报道中,应用优化选择性动脉灌注策略行A型主动脉夹层全弓置换手术,结果显示优化组与对照组(常规孙氏手术)患者体外循环时间、主动脉阻闭时间比较,差异有统计学意义(P>0.05)。
综上所述,AAAD并发MPS病情凶险、预后差,是对外科医生的极大挑战。尽快评估患者的术前情况,及时诊断和鉴定灌注不良的类型和程度,合理选择手术时机,缩短手术时间,对改善患者早期预后至关重要。本研究是一项单中心回顾性研究,时间跨度较大,加上样本量限制,研究中不可避免地存在一些偏倚。今后还需针对各脏器灌注不良的具体分型,做更多的分析和总结,为手术时机、策略的选择提供更精确的指导。
