狼疮性肾炎病人肾脏巨噬细胞浸润与血和尿TNF-α水平的关系
2021-05-08胡晓燕周燕崔珺魏玉娇马瑞霞
胡晓燕 周燕 崔珺 魏玉娇 马瑞霞
[摘要]目的观察狼疮性肾炎(LN)病人肾组织巨噬细胞的局部浸润情况,探讨其与病人血清、尿液肿瘤坏死因子-α(TNF-α)水平的关系。方法选取60例经肾组织活检诊断为LN病人和10例肾组织正常病人(对照组)为研究对象。采用免疫组织化学染色方法观察肾组织中巨噬细胞的浸润情况,酶联免疫吸附试验双抗体夹心法测定血清、尿液TNF-α水平,并对两者进行相关性分析。结果60例LN病人中,活动组34例(SLEDAI≥9分定义为疾病活动),非活动组26例。LN病人肾组织巨噬细胞表现出异常激活,即浸润程度较对照组明显增高,且活动组明显高于非活动组(F=56.085,P<0.01)。LN病人血清、尿液中TNF-α水平较对照组明显升高,且活动组明显高于非活动组(F=50.234、52.982,P<0.01)。Pearson直线相关分析显示,LN病人肾组织巨噬细胞浸润与血清、尿液TNF-α水平有明显相关性(r=0.728、0.716,P<0.01)。结论LN病人肾组织中巨噬细胞浸润明显增多,巨噬细胞浸润与血清、尿液TNF-α水平呈正相关,且与肾脏损伤和疾病活动性存在明显相关性。
[关键词]狼疮肾炎;巨噬细胞;肿瘤坏死因子α
[中图分类号]R593.242[文献标志码]A[文章编号]2096-5532(2021)01-0091-04
[ABSTRACT]ObjectiveTo investigate local macrophage infiltration in the renal tissue of patients with lupus nephritis (LN) and its correlation with the level of tumor necrosis factor-α (TNF-α) in serum and urine. MethodsA total of 60 patients with LN diagnosed by renal biopsies and 10 subjects with normal renal tissue were enrolled. Immunohistochemistry was used to observe macrophage infiltration in renal tissue, double-antibody sandwich ELISA was used to measure the level of TNF-α in serum and urine, and a correlation analysis was performed. ResultsAmong the 60 patients with LN, 34 had an active disease (a Systemic Lupus Erythematosus Disease Activity Index of ≥9 was defined as active systemic lupus erythematosus) and 26 had a non-active disease. The patients with LN had abnormal activation of macrophages in renal tissue, with a significantly higher degree of macrophage infiltration than the normal control group, and the active group had a significantly higher degree of macrophage infiltration than the non-active group (F=56.085,P<0.01). Compared with the normal control group, the patients with LN had significant increases in the level of TNF-α in serum and urine, and the active group had significantly higher levels than the non-active group (F=50.234,52.982;P<0.01). The Pearson linear correlation analysis showed that renal macrophage infiltration was significantly correlated with the level of TNF-α in serum and urine in patients with LN (r=0.728,0.716;P<0.01). ConclusionPatients with LN have a significant increase in macrophage infiltration, which is positively correlated with the level of TNF-α in serum and urine and is significantly correlated with renal injury and disease activity.
[KEY WORDS]lupus nephritis; macrophage; tumor necrosis factor-alpha
系統性红斑狼疮(SLE)多见于青年女性,是一种自身免疫性疾病,其临床表现复杂多样,主要特征是产生大量自身抗体以及多系统受累。肾脏为其最常见和严重的损害器官,肾活检显示SLE几乎全部存在肾脏受累[1],其中50%~80%有肾炎表现,即为狼疮性肾炎(LN)。LN严重影响病人预后,因此及时有效地诊断及治疗至关重要。免疫调节失衡与炎症反应是LN的主要特征,同时也是LN的重要发病机制[2]。而巨噬细胞是人体免疫系统的重要组成部分,是炎症反应中最主要的调节细胞和免疫反应中最重要的吞噬细胞,已证实活化的巨噬细胞在LN 的发病机制中起关键性作用。巨噬细胞可以直接损伤肾脏固有细胞,还可以分泌多种细胞因子导致炎症细胞浸润和广泛的细胞增生。有研究结果显示,巨噬细胞广泛参与LN小鼠的增生性病变,若特异性地清除巨噬细胞则可明显抑制LN的增生性病变[3]。肿瘤坏死因子-α(TNF-α)由单核细胞、巨噬细胞以及T淋巴细胞等分泌,在免疫细胞间起着相互联系的介导作用[4],决定免疫应答的性质,因此研究TNF-α在LN中的表达具有重要的临床价值。目前,国内有关LN病人肾组织中巨噬细胞浸润与血清、尿液TNF-α水平关系的研究报道甚少。故本研究对二者的关系进行了分析,旨在进一步探讨LN的发病机制,为LN病人提供活动性预测及药物治疗反应性评估的无创性指标。
1对象和方法
1.1研究对象
2017年12月—2019年6月,青岛大学附属医院肾病科及风湿免疫科收治的有完整病情记录的LN病人60例(年龄≥18岁)。60例LN病人均符合美国风湿协会SLE的分类诊断标准且经肾穿刺活检术证实为LN[5]。所有病人均无类风湿性关节炎、银屑病、中枢神经系统疾病、感染性疾病等,非妊娠及哺乳期妇女,均无肾脏原发性损害及糖尿病、高血压等继发的肾脏损害,近3个月内无服用免疫抑制剂史或3个月内使用泼尼松的剂量<30 mg/d。60例病人,男18例,女42例,平均年龄(32.30±9.41)岁。根据LN病理类型将病人分为Ⅲ型组12例,Ⅳ型组18例,Ⅴ型组16例,Ⅴ+Ⅳ型组14例。根据疾病活动性(SLEDAI≥9分定义为SLE疾病活动)将病人分为活动组34例和非活动组26例。另选择10例肾组织正常的病人作为对照组(肾组织标本为外伤手术标本及肾移植供肾活检标本),均无其他原发性及继发性引起肾损害的情况。对照组10例病人,男3例,女7例,平均年龄(30.40±6.45)岁。LN组病人与对照组性别、年龄比较差异均无显著性(P>0.05)。
1.2血、尿及肾组织标本采集
所有研究对象于清晨空腹状态下采集上肢静脉血3 mL,分离血清置于-80 ℃冻存待用;收集所有研究对象晨起中段尿10 mL,离心后置于-80 ℃冻存待用。LN病人均行肾组织活检术采集肾组织标本。在穿刺前告知肾组织活检术必要性及相关风险,病人及家属同意后签订知情同意书。病人俯卧于硬板床上,在B超下定位,标记穿刺部位,常规皮肤消毒,铺无菌洞巾,以10 g/L利多卡因局部麻醉,用穿刺针快速取得1 cm左右肾组织1~2条,用40 g/L甲醛固定,石蜡包埋后制成2 μm厚切片。
1.3免疫组织化学检测肾组织巨噬细胞的浸润
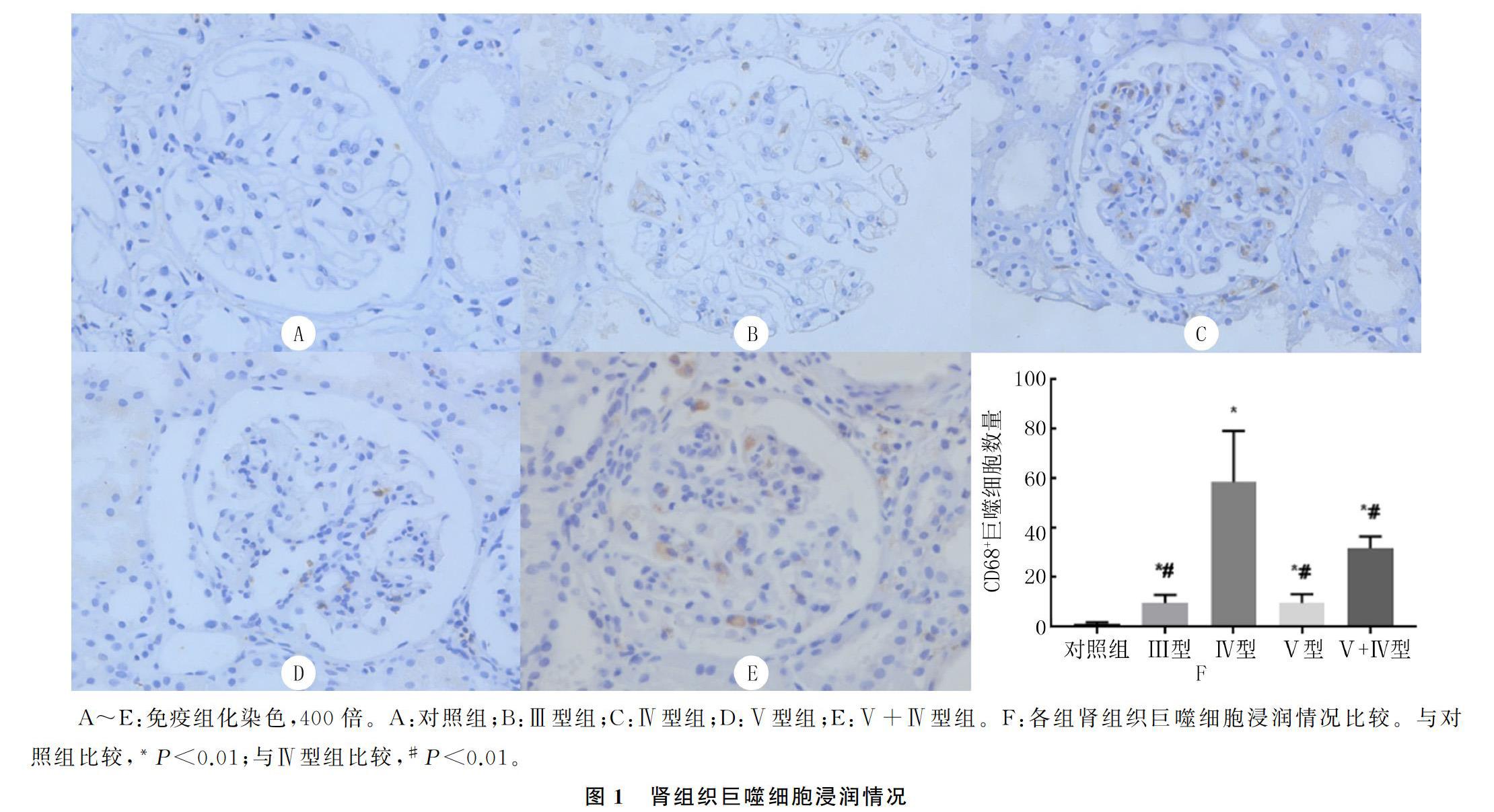
肾组织石蜡切片常规脱蜡至水后,用枸橼酸钠修复液微波热修复10 min,冷却后洗片3次,每次7 min。用体积分数0.03的过氧化氢溶液浸泡组织10 min,洗片后加入10 g/L的BSA 30 μL,37 ℃孵育1 h。洗片后加入CD68单克隆抗体(1∶50,Santa Cruz,美国)30 μL,37 ℃孵育1.5 h。洗片后加入山羊抗鼠HRP酶标二抗(1∶500,abcam,英国)30 μL,37 ℃恒温孵育20 min。洗片后加入DAB底物30 μL避光孵育5 min进行显色,显色结束后用自来水轻洗5 min。用苏木精染核30 s,自来水轻洗5 min。脱水、封片,光镜下观察,摄片保存,应用图像软件进行图像半定量分析。
1.4酶联免疫吸附试验(ELISA)检测血清、尿液TNF-α水平
应用人TNF-α ELISA试剂盒(Elabscience Biotechnology Co., Ltd),采用双抗体夹心法测定血清、尿液中TNF-α表达水平,严格按照说明书进行操作。
1.5统计学处理
计量资料以±s表示,多组间比较采用单因素方差分析,两变量关系分析采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2结果
2.1免疫组织化学检测
对照组肾组织中几乎无巨噬细胞浸润(图1A),LN病人与对照组肾脏比较有明显的巨噬细胞浸润(图1B~E),巨噬细胞主要分布于肾小球且呈散在或者簇状分布,肾小管间质中较少浸润。对照组、LN活动组和LN非活动组CD68+细胞数分别为1.26±0.59、45.01±21.43和9.18±2.20。LN病人肾组织巨噬细胞浸润程度较对照组明显增高,且活动组明显高于非活动组(F=56.085,P<0.01)。不同病理类型组间比较,Ⅳ型组LN 病人肾组织中有明显巨噬细胞浸润,且其浸润程度与Ⅲ型、Ⅴ型及Ⅴ+Ⅳ型组LN病人比较差异均有显著意义(F=67.977,P<0.01),而Ⅲ型组和Ⅴ型组LN病人间差异不明显(图1F)。
2.2ELISA检测
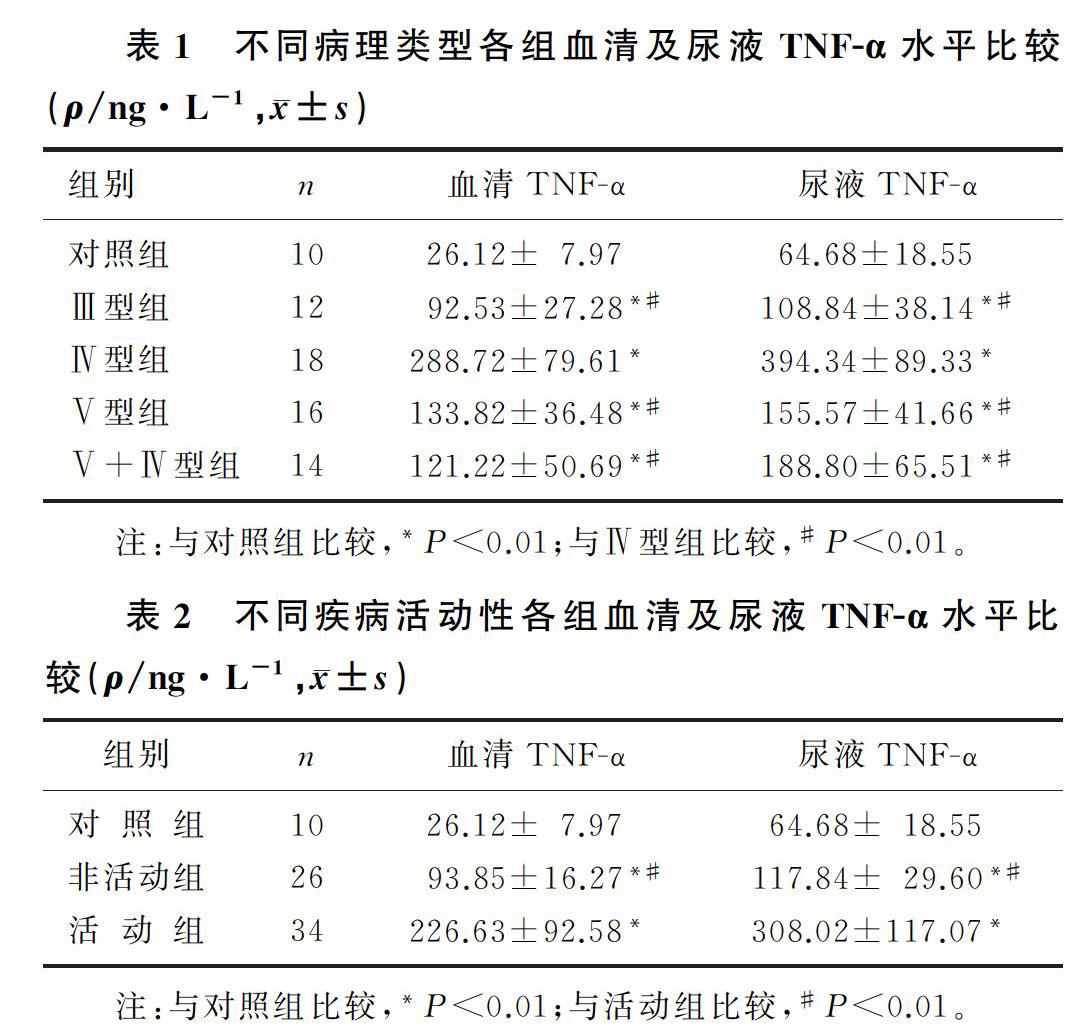
LN病人血清、尿液中TNF-α的表达水平较对照组明显升高,且活动组明显高于非活动组(F=50.234、52.982,P<0.01)。不同病理类型组间比较,Ⅳ型组病人血清、尿液中TNF-α水平较Ⅲ型、Ⅴ型及Ⅴ+Ⅳ型组明显增高,Ⅴ+Ⅳ型组病人尿液中TNF-α水平较Ⅲ型组明显增高,差异均有统计学意义(F=53.103、68.381,P<0.01)。见表1、2。
2.3肾组织巨噬细胞浸润与血清、尿液TNF-α水平的相关性
Pearson直线相关分析显示,LN病人肾组织巨噬细胞浸润与血清、尿液TNF-α水平有显著相关性(r=0.728、0.716,P<0.01)。
3討论
LN是SLE病人最常见的并发症之一,严重影响SLE病人的预后,因此探讨其具体发病机制和寻求新的治疗方法尤为重要。LN的临床表现多样,从单纯性蛋白尿至肾炎综合征、肾病综合征、急进型肾炎和肾衰竭等[6],与肾脏病理的多样性相平行。目前蛋白尿仍是LN病人疾病活动最主要的临床表现,也是影响病人预后的重要指标。寻找新的相关生物标记物对LN活动性预测、疾病治疗及预后评估有重要意义。近年来,肾脏疾病中巨噬细胞的浸润受到越来越多的关注,在大多数肾脏病中巨噬细胞起着重要作用,巨噬细胞浸润与肾组织受损(新月体形成、肾间质纤维化等)、尿蛋白水平及肾功能减退等明显相关。本课题组前期研究显示,巨噬细胞是介导LN病人肾组织损伤的重要细胞,与LN病变严重程度有密切关系[7],尤其在活动期病人中表现格外明显,且干预巨噬细胞在肾组织的浸润能够改善这种肾脏损伤[8]。不同病理类型LN病人,特别是表现为弥漫增殖性病变的Ⅳ型LN病人和表现为膜性病变的Ⅴ型LN病人,其临床特征和病理表现相差甚大,提示其免疫发病可能存在不同的机制。本课题组前期研究显示,与对照组肾脏相比较,LN病人肾小球中巨噬细胞浸润明显增多,肾脏中巨噬细胞的大量浸润是引起肾组织学病变的机制之一[9]。本文研究显示,LN病人肾脏巨噬细胞浸润较对照组明显增加,且不同病理类型的LN巨噬细胞浸润程度不同。Ⅳ型LN的活动性明显高于其他类型LN,且病人肾组织巨噬细胞浸润程度高于Ⅲ型、Ⅴ型及Ⅴ+Ⅳ型LN,差异具有统计学意义,表明不同病理类型LN的发病机制、疾病活动性及严重程度有很大差异。LN活动组与非活动组巨噬细胞浸润亦有明显差异,提示巨噬细胞浸润参与LN发病且其浸润程度可能与疾病的活动性有关[10]。
TNF-α能抑制急性自身反应淋巴细胞的正常生理作用,致使机体内淋巴细胞在发育过程中出现凋亡异常从而导致自身耐受平衡被破坏,然后通过自分泌途径诱导多种免疫细胞因子,激活以及产生一系列自身抗体致使多脏器免疫损伤。国内外新近研究证实,TNF-α在自身免疫反应与炎症反应的调控中至关重要[11-12],且在LN的异常免疫调节中亦起到了重要的作用,与LN的发生发展和转归有着密切联系[13],其可能成为早期预测LN发生的相关标志。本文的研究结果显示,LN病人血清和尿液的TNF-α表达水平明显升高,且与肾组织巨噬细胞浸润呈正相关,活动期的LN与非活动期相比较,TNF-α表达亦明顯升高,表明肾组织TNF-α高表达在LN的发病过程中同样发挥重要作用[14],并与LN的疾病活动性密切相关,提示TNF-α可能通过促进LN病人肾脏的巨噬细胞浸润引起疾病发生及肾脏损伤。
综上所述,LN病人发病与免疫调节失衡有密切联系,其中包括巨噬细胞的肾脏浸润,且浸润程度与疾病活动性密切相关。LN病人巨噬细胞浸润与血清、尿液的TNF-α水平呈正相关,提示血清、尿液TNF-α水平可能成为判断病人疾病活动性及严重程度的指标之一。虽然巨噬细胞与LN的发病机制有密切联系,其中包括肾脏足细胞的损伤,但是不同表型巨噬细胞的浸润对肾脏损伤的影响在国内外研究甚少,本课题组后续将进一步研究肾脏不同表型巨噬细胞浸润与LN病人足细胞损伤关系,为LN的活动性预测及疾病治疗提供依据。
[参考文献]
[1]WANG H P, WANG C Y, PAN Z L, et al. Relationship between clinical and immunological features with magnetic resonance imaging abnormalities in female patients with neuropsychiatric systemic lupus erythematosus[J]. Chin Med J, 2016,129(5):542-548.
[2]MOHAN C, PUTTERMAN C. Genetics and pathogenesis of systemic lupus erythematosus and lupus nephritis[J]. Nat Rev Nephrol, 2015,11(6):329-341.
[3]YUNG S, YAP D Y, CHAN T M. Recent advances in the understanding of renal inflammation and fibrosis in lupus nephritis[J]. F1000Research, 2017,6:874.
[4]KALLIOLIAS G D, IVASHKIV L B. TNF biology, pathogenic mechanisms and emerging therapeutic strategies[J]. Nat Rev Rheumatol, 2016,12(1):49-62.
[5]HOCHBERG M C. Updating the American college of rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis & Rheumatism, 1997,40(9):1725.
[6]YAP D Y, CHAN T M. Lupus nephritis in Asia: clinical features and management[J]. Kidney Dis Basel Switz, 2015,1(2):100-109.
[7]孙益婷,王祥花,李明慧,等. 狼疮肾炎患者肾组织巨噬细胞浸润与骨桥蛋白表达的关系[J]. 中华风湿病学杂志, 2019,23(3):175-178,后插2.
[8]CHALMERS S A, CHITU V, HERLITZ L C, et al. Macrophage depletion ameliorates nephritis induced by pathogenic antibodies[J]. J Autoimmun, 2015,57:42-52.
[9]王莹,李明慧,张岩,等. 狼疮性肾炎患者足细胞损伤与肾组织巨噬细胞浸润的关系[J]. 北京大学学报(医学版), 2019,51(4):723-727.
[10]ZIZZO G, GUERRIERI J, DITTMAN L M, et al. Circulating levels of soluble MER in lupus reflect M2c activation of monocytes/macrophages, autoantibody specificities and disease activity[J]. Arthritis Res Ther, 2013,15(6):R212.
[11]赵媛,王宏亮,张丽华,等. 系统性红斑狼疮患者外周血IL-17、TNF-α和INF-γ表达水平及临床意义[J]. 解放军医药杂志, 2017,29(6):86-88.
[12]FLEISCHER V, SIEBER J, FLEISCHER S J, et al. Epratuzumab inhibits the production of the proinflammatory cytokines IL-6 and TNF-α, but not the regulatory cytokine IL-10, by B cells from healthy donors and SLE patients[J]. Arthritis Res Ther, 2015,17:185.
[13]凌磊,皮肖冰,余旸弢,等. 系统性红斑狼疮患者血清干扰素-α的水平变化及其临床意义[J]. 实用医学杂志, 2016,32(1):106-108.
[14]CIGNI A, PILERI P V, FAEDDA R, et al. Interleukin 1, interleukin 6, interleukin 10, and tumor necrosis factor α in active and quiescent systemic lupus erythematosus[J]. Journal of Investigative Medicine, 2014,62(5):825-829.
(本文编辑 马伟平)
