小白菊内酯对肝癌HepG2细胞凋亡作用及其机制
2021-05-08徐伟华葛科立郭云良綦萍萍孙锐周永红
徐伟华 葛科立 郭云良 綦萍萍 孙锐 周永红

[摘要]目的探討小白菊内酯(PN)对人肝癌HepG2细胞的抗肿瘤作用及其机制。方法取对数生长期的HepG2细胞分成两组,DMSO组以换液形式加入含1/1 000 DMSO的DMEM高糖培养基,PN处理组分别加入PN浓度为15.0、17.5、20.0、22.5、25.0、27.5 μmol/L的DMEM高糖培养基,应用WST-8法检测PN处理24、48、72 h对HepG2细胞活力的影响。取对数生长期的HepG2细胞,随机分为DMSO组与PN(25.0 μmol/L)处理组(6、12、24 h),流式细胞术检测PN对HepG2细胞内Ca2+水平、线粒体膜电位、凋亡细胞比例的影响,Western blot法检测PN对细胞凋亡相关蛋白(Caspase-3、Caspase-9、FLIPL、FLIPS、LC3-Ⅱ、Beclin-1、P62)的影响,DCFH-DA探针流式细胞术检测活性氧(ROS)水平,比色法检测PN对细胞内谷胱甘肽(GSH)生成的影响,以及联合使用N-乙酰-L-半胱氨酸(NAC)1 mmol/L处理细胞24 h对上述指标的影响。结果与DMSO组相比,随着PN作用浓度以及时间的增加,细胞活力明显降低(F浓度=1 778.0,F时间=439.4,F交互=44.3,P<0.01)。PN作用细胞24 h,细胞内Ca2+水平明显升高(t=31.58,P<0.01)。PN组随着作用时间延长,线粒体膜电位显著下降(F=971.1,P<0.01),凋亡细胞比例升高(F=211.3,P<0.01),Caspase-3、Caspase-9活化增加(F=430.9、866.0,P<0.01),FLIPL和FLIPS表达下降(F=57.8、83.3,P<0.01),LC3-Ⅱ和Beclin-1蛋白表达上调(F=2 219.0、527.7,P<0.01),P62蛋白表达下调(F=1 533.0,P<0.01),而HepG2细胞中ROS水平明显升高(t=18.06,P<0.01)、GSH水平明显降低(F=263.4,P<0.01)。联合应用NAC处理24 h后,PN诱导的细胞凋亡增加、ROS水平升高和GSH水平降低均明显减弱,与DMSO组比较差异无显著性(P>0.05)。结论PN可能通过减少HepG2细胞内GSH产生,诱导细胞内ROS水平升高,进而诱导细胞凋亡与自噬。
[关键词]小白菊内酯;癌,肝细胞;活性氧;细胞凋亡
[中图分类号]R285.5[文献标志码]A[文章编号]2096-5532(2021)01-0025-05
[ABSTRACT]ObjectiveTo investigate the anti-tumor effect and mechanism of parthenolide (PN) on human hepatoma HepG2 cells. MethodsHepG2 cells in the logarithmic growth phase were divided into DMSO group (treated with DMEM high-glucose medium containing 1/1 000 DMSO) and PN group (treated with DMEM high-glucose medium containing PN at doses of 15.0, 17.5, 20.0, 22.5, 25.0, and 27.5 μmol/L), and WST-8 assay was used to observe the effect of PN on the viability of HepG2 cells after 24, 48, and 72 h of treatment. HepG2 cells in the logarithmic growth phase were randomly divided into DMSO group and PN treatment group (treated with PN at a dose of 25.0 μmol/L for 6, 12, and 24 h); flow cytometry was used to evaluate the effect of PN on Ca2+ level, mitochondrial membrane potential, and proportion of apoptotic cells; Western blot was used to observe the effect of PN on levels of cell death-related proteins (Caspase-3, Caspase-9, FLIPL, FLIPS, LC3-Ⅱ, Beclin-1, and P62); DCFH-DA probe flow cytometry was used to measure the level of reactive oxygen species (ROS); colorimetry was used to assess the effect of PN on the production of glutathione (GSH) in cells and the effect of co-treatment with PN and N-acetyl-L-cysteine (NAC,1 mmol/L) for 24 h on the above indices. ResultsCompared with the DMSO group, the PN treatment group had a significant reduction in cell viability with the increases in the concentration and duration of PN treatment (Fconcentration=1 778.0,Ftime=439.4,Finteraction=44.3,P<0.01). After PN treatment for 24 h, there was a significant increase in Ca2+ level in cells (t=31.58,P<0.01); with the increase in the duration of PN treatment, the PN treatment group had a significant reduction in mitochondrial membrane potential (F=971.1,P<0.01) and a significant increase in the proportion of apoptotic cells (F=211.3,P<0.01); Caspase-3 and Caspase-9 were activated (F=430.9,866.0;P<0.01); there were significant reductions in the expression of FLIPL and FLIPS (F=57.8,83.3;P<0.01), significant increases in the protein expression of LC3-Ⅱ and Beclin-1 (F=2 219.0,527.7,P<0.01), a significant reduction in the protein expression of P62 (F=1 533.0,P<0.01), a significant increase in ROS level in HepG2 cells (t=18.06,P<0.01), and a significant reduction in the level of GSH level (F=263.4,P<0.01). Co-treatment with NAC for 24 h significantly attenuated cell death, increased ROS level, and reduced GSH level induced by PN, with no significant difference from the DMSO group (P>0.05). ConclusionPN may induce cell apoptosis and autophagy by reducing the production of GSH and increasing the level of ROS in HepG2 cells.
[KEY WORDS]parthenolide; carcinoma, hepatocellular; reactive oxygen species; apoptosis
肝癌在全球范围内发病率逐年升高,并且病人呈现出年轻化的趋势。肝癌治愈率低、死亡率高,其发病机制仍不清楚[1]。小白菊内酯(PN)是从小白菊中提取的一种倍半萜烯内酯类天然产物,欧美地区人们将其作为一种解热镇痛药使用[2],研究证实其具有抗肿瘤活性[3]。已有研究显示,PN具有抗肿瘤作用,其机制可能与特异性抑制核转录因子NF-κB和诱导DNA烷基化有关[4-5]。但PN对肝癌细胞作用及其机制尚不清楚。活性氧(ROS)在人类各种疾病的发病机制中发挥重要的作用。低水平ROS通过调节内环境平衡发挥保护细胞的作用,而高水平ROS在蛋白质、脂质和DNA损伤中发挥关键作用。ROS也参与癌细胞凋亡[6-7]。本文研究旨在探讨PN是否通过影响ROS水平对人肝癌细胞HepG2产生抗肿瘤作用。
1材料与方法
1.1实验材料
人源肝癌细胞株HepG2(购于美国ATCC细胞库),加入含体积分数0.10胎牛血清(BI)的DMEM高糖培养基(Hyclone),置于37.0 ℃、含体积分数0.05 CO2的细胞培养箱中培养。PN购于MCE公司(美国),以DMSO为溶剂配制成200 mmol/L储存液,分装后并冻存于-80 ℃冰箱备用。实验用一抗p62、caspase-3、caspase-9、FLIP、PARP1、LC3-Ⅱ和Beclin-1均购自于Cell Signaling Technology公司,β-actin购自于AB Clonal公司。
1.2WST-8细胞毒力实验
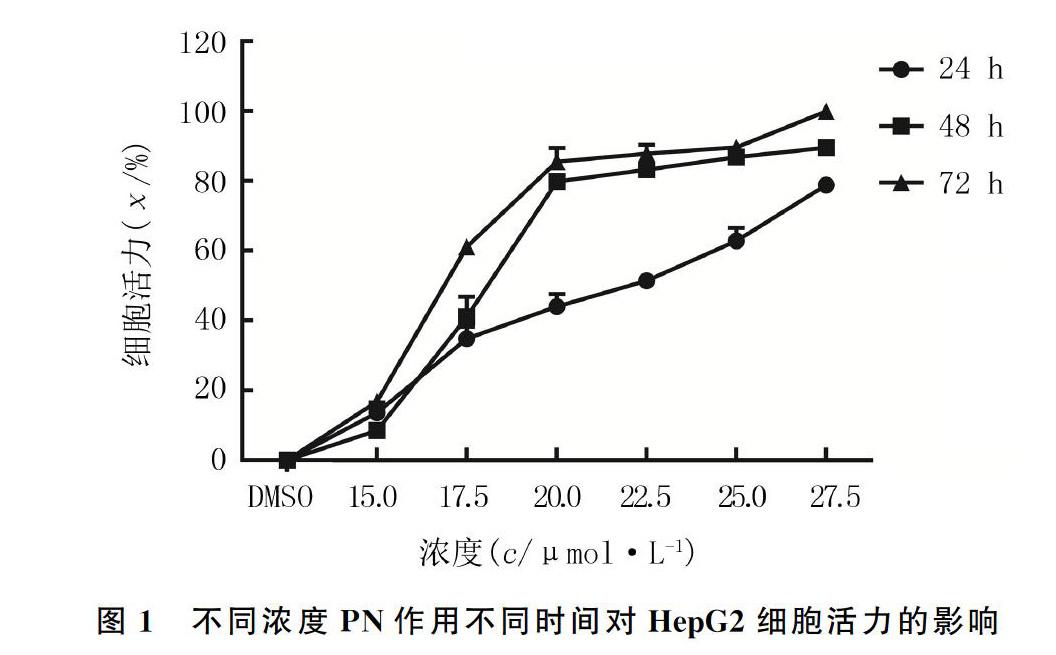
取对数生长期的HepG2细胞,以1∶3比例接种于96孔板中,每孔1×104个细胞,设置3个复孔,置于37 ℃、含体积分数0.05 CO2细胞培养箱中,加入DMEM高糖培养,待细胞贴壁生长至75%时,随机分为两组。DMSO组加入含1/1 000 DMSO的DMEM高糖培养基,PN处理组分别加入PN浓度为15.0、17.5、20.0、22.5、25.0、27.5 μmol/L的DMEM高糖培养基。各组细胞分别于培养24、48、72 h时,每孔以换液形式加入含10 μL CCK-8溶液的细胞培养基100 μL(另设一个空白孔以去除背景值),于细胞培养箱中孵育50 min,用酶标仪测定450 nm处的吸光度(A)。计算细胞抑制率,绘制细胞毒力图,计算PN作用于HepG2的IC50值,取适宜浓度用于后续实验。
1.3检测指标及方法
1.3.1细胞分组及处理HepG2细胞用2.5 g/L胰蛋白酶消化重悬后均匀地接种于6 cm平皿(每皿1.5×106个细胞),随机分为DMSO组与PN组,培养12 h,待细胞处于对数生长期、融合度为75%左右时,DMSO组细胞不作处理,PN组细胞加入含25 μmol/L PN的培养液,置于培养箱分别孵育6、12、24 h。
1.3.2细胞内Ca2+水平检测各组细胞处理后,使用Fluo-3AM钙离子探针试剂盒(S1056,碧云天,上海)和流式细胞仪检测细胞内Ca2+水平。
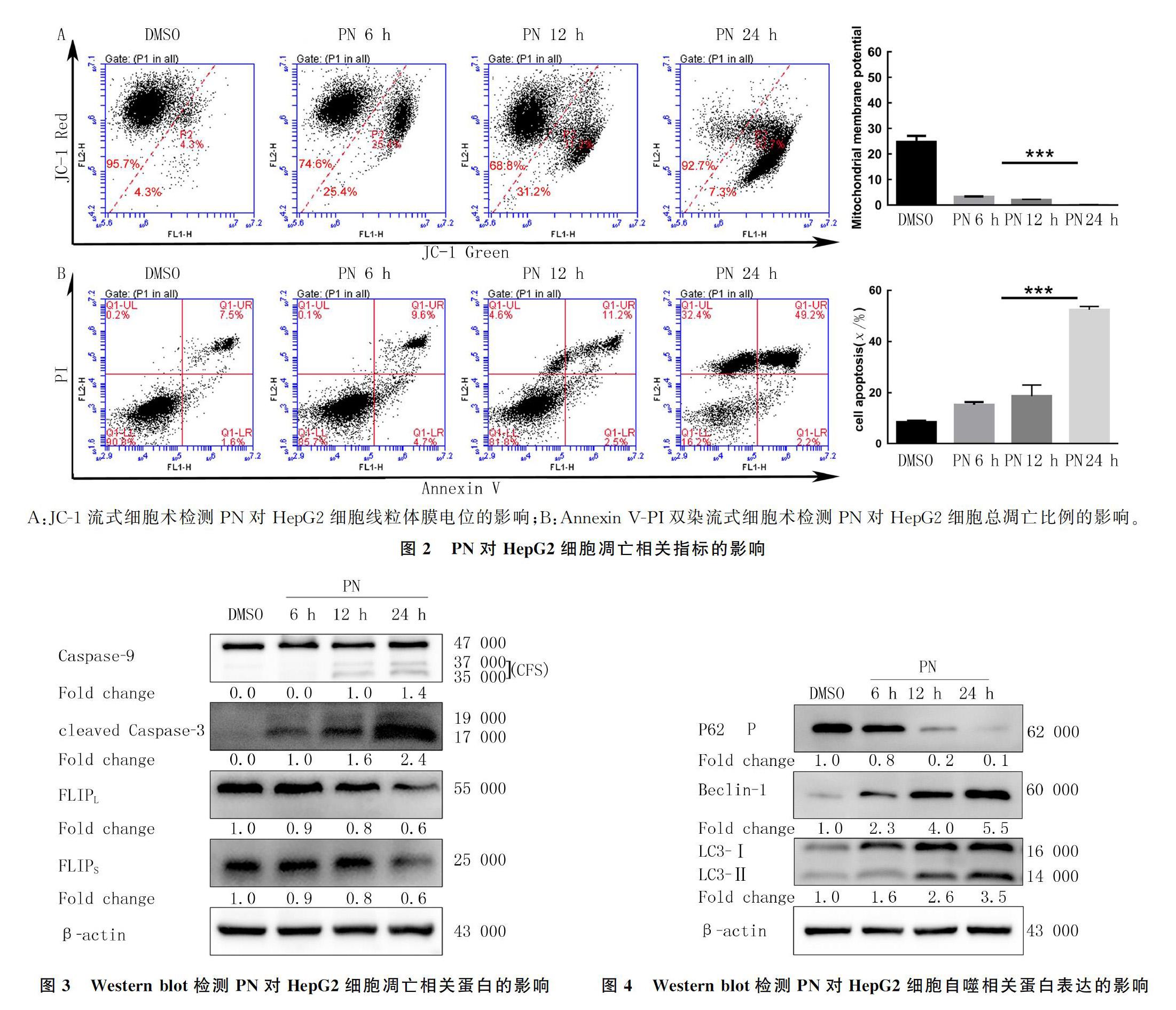
1.3.3线粒体膜电位检测用2.5 g/L胰蛋白酶消化细胞约1 min,收集细胞,使用JC-1线粒体膜电位试剂盒(碧云天,上海)检测线粒体膜电位,根据说明书进行操作,上流式细胞仪检测。
1.3.4细胞凋亡检测各组细胞处理后,使用Annexin V-Alexa Fluor 488/PI细胞凋亡检测试剂盒(40305ES60,上海翊圣生物)、流式细胞仪检测细胞凋亡。
1.3.5Western blot检测蛋白表达水平各组细胞处理后,用RIPA裂解液(P0013C,碧云天,上海)裂解细胞,采用BCA方法测定蛋白浓度,SDS-PAGE电泳和抗体孵育,最后将膜置于ECL化学发光显影液中,充分反应后置于化学发光仪中进行曝光显影。观察Caspase-3、Caspase-9、FLIPL、FLIPS、LC3-Ⅱ、Beclin-1、P62和Beclin-1蛋白表达条带,并使用Image J软件分析各条带灰度值。
1.3.6ROS水平检测各组细胞处理之后,使用DCFH-DA探针试剂盒(S0033,碧云天,上海)和流式细胞仪检测ROS水平。
1.3.7谷胱甘肽(GSH)水平检测各组细胞处理后,使用GSH检测试剂盒(S0053,碧云天,上海)和
1期徐伟华,等. 小白菊内酯对肝癌HepG2细胞凋亡作用及其机制27
流式细胞仪检测GSH水平。
以上所有实验每个样本均设3个复孔,每个实验均重复3次。
1.4统计学方法
采用SPSS 24.0软件进行统计分析。计量资料结果以±s表示,两组数据比较采用t檢验,多组数据的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2结果
2.1不同浓度PN对HepG2细胞活力的影响
WST-8细胞毒力实验结果显示,随着PN浓度及处理时间的增加,HepG2的细胞活力逐渐下降(F浓度=1 778.0,F时间=439.4,F交互=44.3,P<0.01)。见图1。
2.2PN对HepG2细胞Ca2+以及线粒体膜电位水平影响
与DMSO组Ca2+浓度(3.83±0.35)相比,PN处理24 h HepG2细胞中Ca2+浓度(49.33±1.40)明显升高,差异有显著性(t=31.584,P<0.01)。JC-1流式细胞术检测显示,随着PN处理时间的延长,HepG2细胞线粒体膜电位逐渐下降,在PN处理24 h后,HepG2细胞线粒体膜电位几乎完全丧失,差异有显著性(F=971.1,P<0.01)。见图2A。
2.3PN对HepG2细胞凋亡相关指标影响
DMSO组和PN处理6、12、24 h组HepG2细胞总凋亡比例比较差异有显著性(F=211.3,P<0.01)。见图2B。PN处理后,HepG2细胞中凋亡相关蛋白Caspase-9和Caspase-3明显被活化(F=430.9、866.0,P<0.01),而两个外源性凋亡相关的蛋白FLIPL(长型)和FLIPs(短型)表达均下降(F=57.8、83.3,P<0.01)。见图3、表1。
2.4PN对HepG2细胞自噬的影响
PN处理后,HepG2细胞中LC3-Ⅱ、Beclin-1蛋白表达均升高,P62蛋白表达下降,差异有显著性(F=527.7~2 219.0,P<0.01)。见图4、表1。
2.5PN及其联合应用N-乙酰-L-半胱氨酸(NAC)对相关指标的影响
与DMSO组(2.43±0.33)相比,PN处理24 h后,HepG2细胞内ROS水平(29.33±1.45)明显升高,差异有显著性(t=18.06,P<0.01)。PN联合应用NAC后细胞内ROS水平(5.63±0.59)较PN组明显下降,NAC组(2.17±0.09)与DMSO组比较差异无显著性(P>0.05)。联合应用NAC后,PN诱导的HepG2细胞活力下降消失,且联合应用NAC后PN对凋亡蛋白PARP-1、Caspase-9和Caspase-3的活化作用消失。PN处理后HepG2细胞内GSH水平(12 h为8.64±0.28,24 h为4.41±0.26)较DMSO组(13.13±0.27)明显下降,而联合NAC作用24 h后HepG2细胞内GSH水平(12.80±0.43)较PN组(4.22±0.17)明显升高,差异有统计学意义(F=263.4,P<0.01)。见图5。
3讨论
PN是从小白菊中提取的天然倍半萜内酯类化合物,具有优异的抗癌活性,且对正常细胞无毒副作用[8]。本文研究结果显示,PN对HepG2细胞具有细胞毒作用,且呈浓度与时间依赖性。细胞线粒体膜电位的下降是线粒体依赖性凋亡早期的一个标志性事件[9]。本实验结果显示,PN处理HepG2细胞后Ca2+内流增加、线粒体膜电位下降,细胞外Ca2+内流导致细胞内Ca2+水平增加并超载,线粒体通透性增加,细胞色素C释放,从而启动相关的凋亡信号[10]。说明PN在HepG2细胞中可诱导线粒体外膜通透(MOMP)。细胞凋亡是一种程序性细胞死亡,属于细胞的自然死亡。而正常细胞增殖、分化失控,不能正常发生凋亡,则会诱导肿瘤发生。既往研究结果表明,PN可诱导多种肿瘤细胞凋亡[11]。本文实验结果显示,PN处理可使HepG2细胞总凋亡比例明显增高,随着PN处理时间延长,凋亡细胞比例升高。内源性凋亡是一种由多种微环境改变引起的包括(但不限于)生长因子耗竭、DNA损伤、内质网应激、ROS超载、复制应激、微管改变或有丝分裂缺陷等引起的调节性细胞死亡(RCD),其启动阶段会出现MOMP[12],由Caspase执行蛋白(主要是Caspase-3)来执行[13]。本文结果显示,PN作用后HepG2细胞内源性凋亡启动蛋白Caspase-9、凋亡执行蛋白Caspase-3活化,PARP1剪切型蛋白活化,提示PN可能在HepG2细胞内诱导内源性凋亡;随着PN作用时间的延长,两个外源性凋亡相关的蛋白FLIPL(长型)和FLIPs(短型)表达均呈下降趋势,提示PN可能通过下调FLIP诱导HepG2细胞发生外源性凋亡。
有研究结果表明,PN可在多种肿瘤细胞中诱导细胞自噬[14]。细胞自噬是细胞程序性死亡的另外一种方式。LC3是目前公认的自噬标记物,LC3蛋白在自噬过程中形成LC3-Ⅱ并定位于自噬体膜上[15]。Beclin-1是自噬体形成过程中所必需的自噬相关蛋白质,其除了促进自噬体的形成,还能诱导细胞凋亡的发生,被认为是调控细胞自噬和凋亡的分子开关蛋白[16]。P62蛋白是自噬激活的标记物,可通過与LC3的相互作用定位于自体吞噬体,不断被自噬-溶酶体系统降解。因此,可溶性P62蛋白减少,同时LC3-Ⅱ增加则表明自噬流活化[17]。本文研究结果显示,PN处理后HepG2细胞可溶性P62蛋白水平明显下降,Beclin-1蛋白水平明显升高,LC3-Ⅱ明显增加,说明自噬可能参与了PN诱导的细胞死亡。
越来越多的证据表明,细胞内ROS水平升高后,氧化还原平衡状态被打破引起的氧化应激(OS)不仅可抑制线粒体中ATP合成,还会对细胞器和细胞膜造成损伤[18]。本文研究结果显示,PN诱导的HepG2细胞凋亡过程中产生了大量的ROS,且呈时间依赖性增加,而NAC可以完全阻断PN诱导的细胞凋亡以及ROS水平的升高,提示ROS的积累导致细胞产生氧化损伤,激活一系列死亡信号通路,导致了细胞凋亡。进一步的研究结果显示,PN处理后HepG2细胞中GSH明显减少,说明PN可能通过下调GSH水平,从而诱导ROS水平升高,导致HepG2细胞凋亡。
综上所述,PN可诱导HepG2细胞凋亡和自噬,该作用可能与PN通过抑制GSH诱导ROS水平升高密切相关。
[参考文献]
[1]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2018,68(6):394-424.
[2]KNIGHT D W. Feverfew: chemistry and biological activity[J]. Nat Prod Rep, 1995,12(3):271-276.
[3]SUZUKI T, SAITO Y, ISOZAKI S, et al. Simple method for portal vein infusion in the rat[J]. J Pharm Sci, 1973,62(2):345-347.
[4]GHANTOUS A, SINJAB A, HERCEG Z, et al. Partheno-lide: from plant shoots to cancer roots[J]. Drug Discovery Today, 2013,18(17-18):894-905.
[5]WANG M T, LI Q Y. Parthenolide could become a promising and stable drug with anti-inflammatory effects[J]. Nat Prod Res, 2015,29(12):1092-1101.
[6]BROOKES P S, YOON Y, ROBOTHAM J L, et al. Cal-cium, ATP, and ROS: a mitochondrial love-hate triangle[J]. Am J Physiol Cell Physiol, 2004,287(4):C817-C833.
[7]LI R, JIA Z Q, TRUSH M A. Defining ROS in biology and medicine[J]. React Oxyg Species Apex N C, 2016,1(1):9-21.
[8]MATHEMA V B, KOH Y, THAKURI B C, SILLANP M. Parthenolide, a sesquiterpene lactone, expresses multiple anti-cancer and anti-inflammatory activities[J]. Inflammation, 2012,35(2):560-565.
[9]GALLUZZI L, KEPP O, KROEMER G. Mitochondrial regulation of cell death: a phylogenetically conserved control[J]. Microbial Cell, 2016,3(3):101-108.
[10]ERMAK G, DAVIES K J A. Calcium and oxidative stress: from cell signaling to cell death[J]. Molecular Immunology, 2002,38(10):713-721.
[11]MARIA-REGINA O K, GROOTJANS S, BIAVATTI M W, et al. Sesquiterpene lactones as drugs with multiple targets in cancer treatment[J]. Anti-Cancer Drugs, 2012:1.
[12]STEPHEN W G, GREEN D R. Mitochondria and cell death: outer membrane permeabilization and beyond[J]. Nature Reviews Molecular Cell Biology, 2010,11(9):621-632.
[13]JULIEN O, WELLS J A. Caspases and their substrates[J]. Cell Death Differ, 2017,24(8):1380-1389.
[14]SUN Jing, ZHANG Chan, BAO Yongli, et al. Parthenolide-induced apoptosis, autophagy and suppression of proliferation in HepG2 cells[J]. Asian Pacific Journal of Cancer Prevention, 2014,15(12):4897-4902.
[15]TANIDA I, UENO T, KOMINAMI E. LC3 and autophagy[J]. Methods Mol Biol, 2008,445:77-88.
[16]XU H D, QIN Z H. Beclin 1, bcl-2 and autophagy[J]. Advances in Experimental Medicine and Biology, 2019,1206:109-126.
[17]LAMARK T, SVENNING S, JOHANSEN T. Regulation of selective autophagy: the p62/SQSTM1 paradigm[J]. Essays Biochem, 2017,61(6):609-624.
[18]GALLUZZI L, BRAVO-SAN PEDRO J M, VITALE I, et al. Essential versus accessory aspects of cell death:recommendations of the NCCD 2015[J]. Cell Death and Differentiation, 2015,22(1):58-73.
(本文編辑 黄建乡)
