不同溶栓药的分子结构差异及药理学特性比较
2021-05-08袁世加
袁世加
(秀山土家族苗族自治县人民医院药学科,重庆 409900)
0 引言
随着生活水平改变及老龄化社会加快,血栓性疾病越来越成为严重威胁人类生命的健康问题。常见的有肺血栓栓塞症、深静脉血栓栓塞症等静脉血栓栓塞症及急性心肌梗死、脑卒中等动脉血栓栓塞症。及时的血管再灌注治疗可以挽救相应器官,也直接影响患者预后[1]。近年来随着新型溶栓药的出现,供临床医生应用的药物选择性更多,但他们可能并不对每一种药物有深入的了解。
1 溶栓药的发展历程
溶栓治疗历史最早要追溯到1933年,Tillet和Garner处理血液标本时偶然发现溶血型链球菌产生一种可以降解纤维蛋白的物质,后来研究者将这种来源于链球菌的物质称为链激酶,但真正大规模用于临床是在20世纪70年代以后[2-3]。按其发展过程可大致分为3代:
1.1 第一代溶栓药
无纤维蛋白特异性,始于20世纪60年代,典型代表为SK(链激酶)、UK(尿激酶),作用机制不完全相同,SK不直接激活激活Pg(纤溶酶原),而UK可以直接使Pg之转变为具有Pm(纤溶酶)从而溶解纤维蛋白[4]。
1.2 第二代溶栓药
为解决第一代溶栓药无纤维蛋白特异性问题而产生,始于20世纪70年代后期,现以重组组织型纤溶酶原激活剂(rt-PA)为代表,如阿替普酶[5]。
1.3 第三代溶栓药
始于20世纪90年代,是利用现代分子生物学和生物工程技术对t-PA分子进行结构改造,通过敲出某些特定的氨基酸,达到增强纤维蛋白选择性、延长半衰期及增强溶栓的目的[6]。
2 溶栓药的溶栓机制
通常情况下,血栓溶解需Pg在激活物的作用下生成Pm,Pm继而将纤维蛋白分解为可溶性产物,达到溶栓目的。人体有两种内源性纤溶酶原激活物,即组织型纤溶酶原激活剂(t-PA)和单链尿激酶纤溶酶原激活剂(scu-PA)[7-8],溶栓药是模拟生理性PA发挥溶栓作用。
3 溶栓药的溶栓特性
(1)溶栓药对纤维蛋白的特异性是决定溶栓治疗最重要的药理学特性。溶栓药对纤维蛋白选择性越高,溶栓的特异性就越高,全身出血风险就越低。
(2)溶栓药第二个特性就是半衰期,半衰期偏长增加出血风险,偏短需持续给药,合理的半衰期既保证疗效又带来使用的方便性。
(3)溶栓药第三个特性是对I型纤溶酶原激活物抑制剂(PAI-1)的抗性,PAI-1是纤溶系统的主要生理抑制剂,可与t-PA和scu-pA特异性结合,使二者迅速失活,从而发挥抗纤溶作用。溶栓药对PAI-1抗性低,会导致药物到达血栓部位出现对溶栓效果的中和作用,而降低溶栓效果。
4 溶栓药的代表
如前所述,除依据研发时间先后将溶栓制剂分为三代外,还根据是否对纤维蛋白有选择性,将溶栓药分为非特异性和特异性纤溶酶原激活剂两大类。
4.1 第一代溶栓药:尿激酶(UK,非特异性纤溶酶原激活剂)
1951 年Willams从尿中发现尿激酶,由人肾细胞合成并可从尿液中提取的一种蛋白水解酶,所以称之为尿激酶,现多采用基因工程技术合成,由两条肽链组成,分子量54000。以前有人认为尿激酶有不同分子量形式,其实低分子量(32000)的尿激酶实际上是高分子量54000尿激酶的酶解产物。尿激酶通过水解纤溶酶原中的Arg560-Val561肽腱,将血液循环中的纤溶酶原激活为纤溶酶[9]。
注射用尿激酶:410个氨基酸组成的双链丝氨酸蛋白酶。
特点:①对纤维蛋白无特异性,由于溶栓时不需纤维蛋白作辅因子,而是直接将Pg转变成Pm。可使无论循环中的还是已结合的Pg都被转变成Pm,从而产生过量的Pm,过量的Pm不加区别地消化所有纤维蛋白原,形成全身性纤溶状态,增加病人的出血。②作用半衰期短,血浆半衰期≤20分钟。③血管开通率较低[10]。
应用:价格低廉,在基层医疗机构应用较多。
注意:溶解新鲜血栓,对已机化的陈旧血栓无效。
因此,以特异性纤溶酶原激活剂为重点的第二代溶栓药应运而生。
4.2 第二代溶栓药:阿替普酶、尿激酶原(特异性纤溶酶原激活剂)
4.2.1 组织型纤溶酶原激活剂(t-PA)
1983 年,Collen解释了t-PA对纤维蛋白特异性的分子基础:纤维蛋白血栓形成是由纤维蛋白赖氨酸侧链相互连接而成,而Pg对于赖氨酸侧链连接结构具有很强的亲和力,因此在血栓周围聚集有大量的Pg,t-PA激活Pg过程中需通过纤维蛋白表面的环状纤维桥作为辅助,也就是说t-PA溶栓需纤维蛋白参与,游离的Pg不会被激活。同时,从血栓表面脱落进入循环中的Pm,因暴露出赖氨酸结合部位而被α2-抗纤溶酶迅速结合而失活。所以理论上t-PA只引起局部溶栓而不产生全身性纤溶状态[11]。
阿替普酶(rt-PA):是用基因工程技术制备的重组t-PA,由527个氨基酸组成的单链丝氨酸蛋白酶,见图1。
4.2.2 单链尿激酶型纤溶酶原激活剂(scu-PA)
尿激酶原是Berink[13]首次在组织培养中发现,随后又被Husain[14]等人从尿中纯化出,但直到1981年才被Wun[15]等证明它是尿激酶的前体。
1973 年首先在组织培养液中发现了尿激酶原,接着1979年从尿中纯化出一种新的高分子的单链尿激酶,1981年,所以称它为尿激酶原( prourokinase,pro-UK )。国际血栓形成和止血委员会将其称为单链尿激酶型纤溶酶原激活剂。
同t-PA一样,作为生理性纤溶酶原激活剂,仅作用于与血栓结合的Pg。但在纤维蛋白选择性和溶栓机制上,两者略有不同,pro-UK本身对纤维蛋白的结合力较弱,结合钱无活力,而一旦与血栓中纤维蛋白结合后,其激活纤溶蛋白酶原的能力增加500倍以上;另外,纤维蛋白原降解后才能暴露羧基端的赖氨酸残基,与其结合的Pg才会被pro-UK活化,因此两者是结合不同位点的Pg[16-17]。
注射用重组尿激酶原(rhPro-UK):是用基因工程技术制备的重组尿激酶原,由411个氨基酸组成的单链丝氨酸蛋白酶[16],见图2。
在Lys158-Ile159间(下图箭头所示处),该肽链可被纤溶酶、胰蛋白酶、激肽释放酶等水解成A、B两条链,水解后接着将A链羧基端158位点的赖氨酸残基除去,最终A链由第1~157位氨基酸残基组成,B链由第159~411残基组成,A、B两条链间由Cys148和Cys279之间的二硫键相连组成双链UK,由此pro-UK就被转变成为具有高催化活性的尿激酶。

图1 阿替普酶[12]
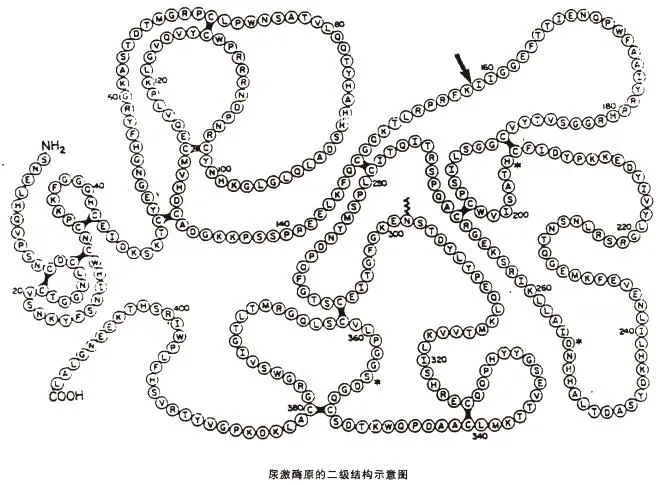
图2 尿激酶原[16]
总的来说第二代溶栓药虽然在特异性得到提高,但溶栓药另外两个特性仍旧不能令人满意,于是注重安全、有效、与更为简便的给药操作的第三代溶栓药诞生了。
4.3 第三代溶栓药
替奈普酶(TNK-tPA):TNK-tPA平面结构图如图3[12],是t-PA 的三倍体变异,分别是T、N、K三个位点的改变(图4)[18]。
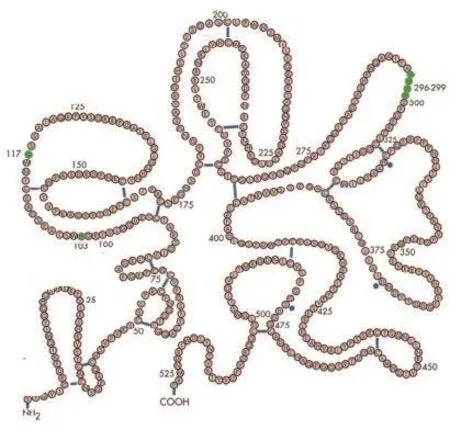
图3 替奈普酶[12]
TNK-tPA是t-PA的多点变异产物,即103位点天冬酰胺替代苏氨酸,半衰期延长到20min以上,可实现5-10单次静脉推注;117位点的谷氨酰胺取代天冬酰胺,特异性增强10-14倍,极少消耗纤维蛋白原;296-299位点4个丙氨酸分别取代赖氨酸、组氨酸、和2个精氨酸,抗PAI-1能力增强80 倍[19-20]。
5 总结
总之理想的溶栓药应该具有溶栓高效、再通率高、安全无免疫原性、纤维蛋白原选择性强、半衰期长、用药次数少、价格合理等优点,近年随着分子生物学和生物工程技术的应用,新型溶栓药在逐步改善传统溶栓药的缺点,但仍然面临部分患者用药后出现颅内出血的严重并发症,以及仍未突破溶栓时间窗窄的缺点。尤其meta分析[26-27]并未发现二三代溶栓药之间有显著性差异,因此,未来的研究仍需以设计出更加完美的溶栓药为目标。
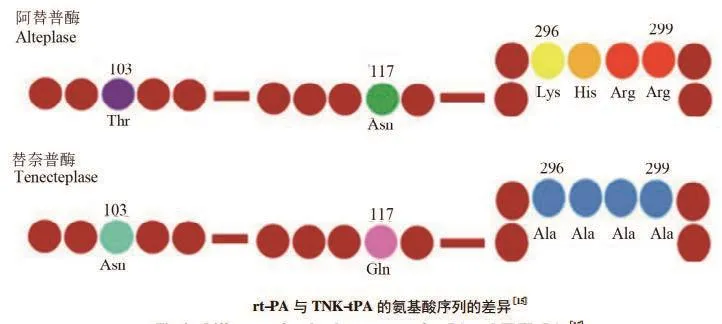
图4 阿替普酶与替奈普酶的氨基酸序列差异[18]

表1 四种溶栓药的各种特性总结[20-25]
