离子色谱法测定口服电解质颗粒中阴、阳离子的含量
2021-05-08张建茹昝艳楠丁逸梅
张建茹,昝艳楠,2,丁逸梅,2*
1 南京工业大学 药学院,南京 211800;2 江苏省药物研究所,南京 211800
人体的电解质大部分存在于细胞内外,保持着人体的平衡,电解质参与体内许多重要的功能和代谢活动,对维持正常生命活动起着重要的作用。本文中的口服电解质颗粒原研厂家为日本味之素株式会社,目前国内没有上市。本品为氯化钠、氯化钾、无水磷酸二氢钠、柠檬酸钠水合物、碳酸镁、水合柠檬酸、香料、乙基香草醛、香兰素、丙二醇等组成的颗粒,用于补充身体所需的离子。
氯离子、磷酸根离子及柠檬酸根离子的常规含量测定方法有电位滴定法[1]、高效液相色谱法[2]、气相色谱法[3]、离子色谱[4,5]等。电位滴定法每次只能测定一种离子,消耗时间长且测定要求较高(需要相应的专用电极);而柠檬酸根在高效液相中保留较弱,检测器灵敏度低;而用气相色谱法测定需衍生化等过程,操作复杂。使用离子色谱法可同时测定多种离子,且制备样品简单。有报道采用离子色谱法进行柠檬酸测定[6],由于柠檬酸是弱有机酸,在离子色谱柱上保留较强,常用梯度洗脱方式与其他常见阴离子进行分离,但分析时间较长,对设备配置要求高。
目前钠、钾、镁的测定方法主要有原子吸收法[3,4]、电感耦合等离子体发射光谱法(ICP-MS)[5]、滴定法[6]、电极法[7]、离子色谱法等。原子吸收法测定金属时要进行预处理,加入消电离剂、释放剂等,且每次只能分析一种元素。滴定法和电位法操作较为繁琐,灵敏度不高,会造成二次污染,且当多种元素同时存在时,滴定法无法同时区分。ICP-MS 虽然灵敏度高,分析速度快,但其使用和维护成本比较高,仪器不够普及,并且不能直接进样进行分析[8]。
本文建立了同时快速测定氯离子、磷酸根离子、柠檬酸根离子、钠离子、钾离子、镁离子含量的等度洗脱离子色谱法,具有操作简便,直接进样,灵敏度高等优点,是目前最常用的阴阳离子分析方法。
1 仪器与药品、试剂
1.1 仪器
930 Compact IC Flex 离子色谱仪(瑞士万通,配自动淋洗液发生器,CO2抑制器MCS,MagIC Net 3.2 色谱工作站);阴离子色谱柱:Metrosep A SUPP 5 column(50 mm×4 mm),阴离子保护柱:Metrosep A SUPP 5 Guard/4.0;阳离子色谱柱:Metrosep C4column(250 mm×4 mm),阳离子保护柱:Metrosep C4Guard/4.0;On-GuardH 柱及C18预处理小柱(美国戴安公司);万分之一天平(Sartorius,BT25S);十万分之一天平(Sartorius,BT25S)。
1.2 药品与试剂
氯化钾对照品(纯度99.8%,批号:20190414)、六水合氯化镁(纯度99.8%,批号:20180804),均为国药集团化学试剂有限公司;氯化钠对照品(纯度99.8%,批号:20180619)、一水合柠檬酸(纯度99.8%,批号:20180313)、氯化钠(纯度99.8%,批号:20180619),均为南京化学试剂公司;磷酸二氢钠(纯度99.8%,批号:20180804,永华化学科技公司);口服电解质:商品名Solita-T®granules No.3(批号:4F371、4F373、4F375、4F377、4F379,日本味之素制药);硝酸(纯度100.0%)、碳酸钠(纯度100.0%)分析纯,市售;超纯水和二次去离子水(用超声波脱气)。
2 方法和结果
2.1 阴离子(氯、磷酸根、柠檬酸根离子)测定
2.1.1 供试品溶液的制备取本品5 包称定,研细,精密称取细粉适量,置50 mL 量瓶中,加水适量超声使电解质颗粒溶解,用水稀释至刻度,摇匀,作为储备液(约每毫升含氯离子1065 μg、磷酸根475 μg、柠檬酸根2160 μg)。取储备液2.0 mL 置50 mL 量瓶中,用水稀释至刻度,作为供试品溶液。
2.1.2 对照品的制备精密称取一水合柠檬酸、氯化钠、磷酸二氢钠对照品适量,加水适量使溶解并稀释成每毫升约含氯离子1065 μg,磷酸根475 μg和柠檬酸根2160 μg 的混合对照品储备溶液,取该储备液2.0 mL,置50 mL 量瓶中,加水稀释至刻度,作为混合对照品溶液。
2.1.3 色谱条件与系统适用性试验取一水合柠檬酸、氯化钠、磷酸二氢钠对照品适量,加水适量使溶解并稀释成每毫升约含氯离子42.60 μg、磷酸根19 μg 和柠檬酸根86.4 μg 的溶液作为系统适用性溶液,采用Metrosep A Supp-5 column(150 mm×4 mm)色谱柱;流动相:碳酸钠溶液(12.8 mmol·L-1)、等度洗脱;柱温:30 ℃;流速:0.7 mL·min-1;进样量:20 μL;电导检测器。在上述条件下,各峰之间的分离度良好(Rs>1.5),出峰顺序依次为氯离子、磷酸根、柠檬酸根。色谱图见图1。

图1 系统适用性色谱图
2.1.4 专属性取处方中不含3 种阴离子的其他成分,稀释成与供试品、对照品相同倍数的空白溶液,与混合对照品、供试品一并分析。结果显示,本方法测定处方中3 种阴离子的专属性良好,不受溶液中其他成分(阳离子、香料、乙基香草醛、香兰素、丙二醇等)的干扰,且空白辅料和溶剂中没有干扰峰,各阴离子之间分离度良好。色谱图见图2。
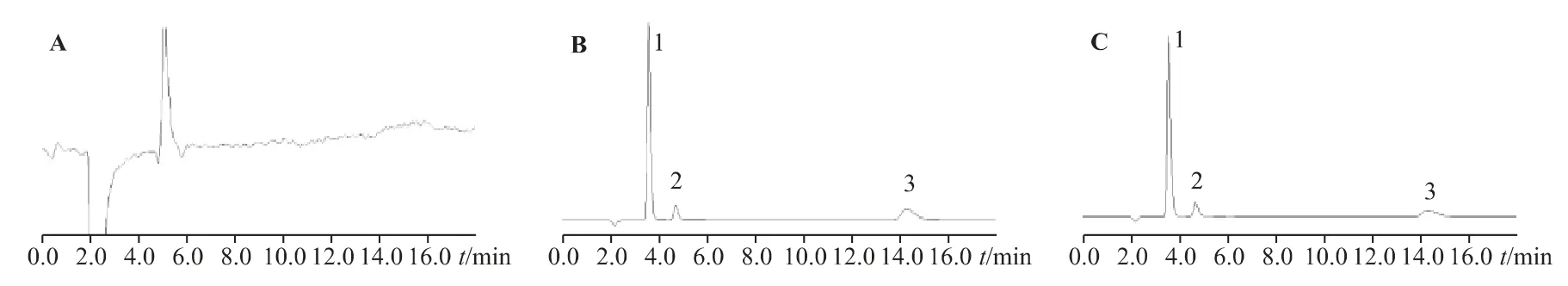
图2 空白溶液离子(A)、标准溶液阴离子(B)、供试品溶液阴离子(C)色谱图
2.1.5 线性关系考察精密量取对照品储备液1、1.4、2.0、2.6、3 mL 分别置于50 mL 量瓶中,用水稀释至刻度,得相当于氯离子浓度分别为21.30、29.82、42.60、55.38、63.90 μg·mL-1,磷酸根浓度分别为9.500、13.30、19.00、24.70、28.50 μg·mL-1,柠酸根浓度分别为43.20、60.48、86.40、112.3、129.6 μg·mL-1的系列对照品溶液。按“2.1.3”项下色谱条件进样,以样品浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,拟合回归方程见表1。

表1 阴离子含量测定法的线性范围
2.1.6 检测限和定量限取“2.1.2”项下对照品适量,等倍逐步稀释,按“2.1.3”项下色谱条件连续进样6 次,记录峰面积。当信噪比为10∶1 时,得定量限;当信噪比为3∶1 时,得检测限。结果LOD 和LOQ氯离子分别为2.130 ng·mL-1和6.390 ng·mL-1;磷酸根分别为3.160 ng·mL-1和9.500ng·mL-1;柠檬酸根分别为54ng·mL-1和162 ng·mL-1。
2.1.7 进样精密度试验取“2.1.2”项下对照品溶液20 μL,按“2.1.3”项下色谱条件进样测定,记录色谱图。结果氯离子、磷酸根、柠檬酸根的RSD 分别为0.14%、0.30%、0.52%(n=6),表明仪器精密度良好。
2.1.8 稳定性试验取“2.1.1”项下供试品溶液,在室温下放置0、2、4、6、8、12、24 h,分别进样测定,记录色谱图。结果氯离子、磷酸根、柠檬酸的峰面积RSD 分别为0.23%、1.6%、0.37%,表明供试品溶液在室温24h 内稳定。取“2.1.2”项下对照品溶液,以下操作同上。结果氯离子、磷酸根、柠檬酸的峰面积RSD 分别为0.55%、1.8%、0.29%,表明对照品溶液在室温下24 h 内稳定。
2.1.9 重复性试验取“2.1.1”项下供试品6 份,再按“2.1.3”项下色谱条件连续进样,记录色谱图。结果,6 份供试品溶液中氯离子、磷酸根、柠檬酸的平均含量分别为42.11、18.48、84.98 μg·mL-1,它们的RSD分别为1.3%、0.8%、1.6%,表明本方法重现性良好。
2.1.10 加样回收率试验精密称定本品0.04 g,置50 mL 量瓶中,共9 份,精密加入氯离子、磷酸根、柠檬酸根质量浓度分别为1065、475、2160 μg·mL-1的混合对照品溶液7.0、8.0、10.0 mL 各3 份,按照“2.2.1”项下方法制备供试品溶液,得低、中、高(70%、100%、130%)3 个浓度,注入离子色谱仪进行测定,计算回收率,本方法的准确度良好。见表2。

表2 加样回收率试验结果
2.2 阳离子(钠离子、钾离子、镁离子)测定
2.2.1 供试品溶液的制备取本品5 包,称定,研细,精密称取细粉适量,置100 mL 量瓶中,加水适量超声振荡使电解质颗粒溶解,用水稀释至刻度,摇匀,作为储备液(约每毫升含钠离子805μg、钾离子780 μg、镁离子36 μg)。取储备液2.0 mL 置50 mL量瓶中,用水稀释至刻度,作为供试品溶液。
2.2.2 对照品的制备精密称取氯化钠、氯化钾、六水合氯化镁对照品,置于100 mL 量瓶,加水适量溶解并稀释成每毫升约含钠离子805 μg、钾离子780 μg 和镁离子36 μg 的混合对照品储备液,取储备液2.0 mL,置50 mL 量瓶中,加水稀释至刻度,作为混合对照品溶液。
2.2.3 色谱条件与系统适用性试验精密称取氯化钠、氯化钾、六水合氯化镁对照品置于100 mL 量瓶,加水适量使溶解并稀释成每毫升约含钠离子32.20 μg、钾离子31.20 μg 和镁离子1.44 μg 的混合对照品储备液,采用Metrosep A Supp-5 column(250mm×4mm)色谱柱;流动相为硝酸溶液(12.8mmol·L-1),等度洗脱;柱温:30 ℃;流速:0.7 mL·min-1;进样量:20 μL;电导检测器。在上述条件下,各峰之间的分离度良好(Rs>1.5),出峰顺序依次为钠离子、钾离子、镁离子,且分离度良好。色谱图见图3。

图3 系统适用性色谱图
2.2.4 专属性取处方中不含3 种阳离子的其他成分,稀释成与供试品、对照品相同倍数的空白溶液,与混合对照品、供试品一并分析。结果显示,本方法测定处方中3 种阳离子的专属性良好,不受溶液中其他成分(阴离子、香料、乙基香草醛、香兰素、丙二醇等辅料)的干扰,因此空白溶液中没有干扰峰,各阳离子之间分离度良好。色谱图见图4。
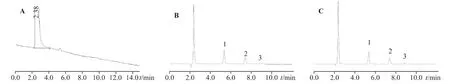
图4 空白溶液离子(A)、标准阳离子溶液(B)、供试品溶液阳离子(C)色谱图
2.2.5 线性关系考察精密量取“2.2.2”项下对照品储备液1、1.4、2.0、2.6、3 mL 分别置于50 mL 量瓶中,用水稀释至刻度,得相当于钠离子浓度分别为16.07、22.50、32.15、41.79、48.22 μg·mL-1,钾离子浓度分别为15.69、21.97、31.39、40.80、47.08 μg·mL-1,镁离子浓度分别为0.7290、1.021、1.458、1.896、2.187 μg·mL-1的系列对照品溶液。按“2.2.3”项下色谱条件进样,以样品浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,拟合回归方程见表3。
2.2.6 检测限和定量限取“2.2.2”项下对照品溶液适量,等倍逐步稀释,按“2.2.3”项下色谱条件连续进样测定6 次,记录峰面积。当信噪比为10∶1 时,得定量限;当信噪比为3∶1 时,得检测限。结果LOD 和LOQ 钠离子分别为0.0321μg·mL-1和0.107μg·mL-1;钾离子分别为0.03138 μg·mL-1和9.500 μg·mL-1;镁离子分别为0.001458 μg·mL-1和0.00486 μg·mL-1。

表3 阳离子含量测定法的线性范围
2.2.7 精密度试验取“2.2.2”项下对照品溶液20μL,按“2.2.3”项下色谱条件连续进样测定,记录色谱图。结果RSD 钠离子为0.56%、钾离子为0.65%、镁离子为0.97%(n=6),表明仪器精密度良好。
2.2.8 稳定性试验取“2.2.1”项下供试品溶液,在室温下放置0、2、4、6、8、12、24 h,分别进样测定,记录色谱图。结果钠离子、钾离子、镁离子的峰面积RSD分别为0.32%、0.31%、1.27%,表明供试品溶液在室温24 h 内稳定;取“2.2.2”项下对照品溶液,以下同上操作。结果钠、钾、镁离子的峰面积RSD 分别为0.39%、0.32%、1.66%,表明对照品在室温24h 内稳定。
2.2.9 重复性试验取“2.2.1”项下供试品6 份,按“2.2.3”项下色谱条件进样测定,记录色谱图,以外标法计算钠、钾、镁离子的含量,其含量的RSD 分别为0.2%、0.25%、0.08%,表明本方法重现性良好。
2.2.10 加样回收率试验精密称定本品0.04 g,置50 mL 量瓶中,共9 份,精密加入钠、钾、镁离子质量浓度分别为805、780、36 μg·mL-1的混合对照品溶液0.4、1.0、1.6 mL,各3 份,按照“2.2.1”项下方法制备供试品溶液,得低、中、高(70%、100%、130%)3 个浓度,注入离子色谱仪进行测定,计算回收率,本方法的准确度良好。见表4。
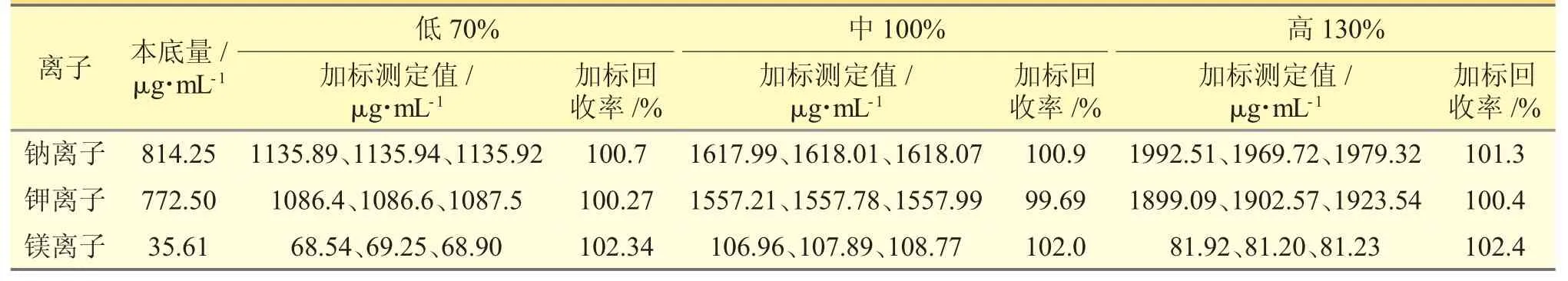
表4 加样回收率试验结果
2.3 样品测定
对5 批样品照上述方法测定,按外标法计算各离子的含量,结果见表5。

表5 样品含量测定结果(μg·mL-1)
3 讨论
3.1 淋洗液条件的选择
分离效果一方面取决于待测离子的浓度,另一方面取决于淋洗液的浓度,即淋洗液的浓度影响着分离时间和分离度。对于阴离子分析,本实验比较了7 mmol·L-1Na2CO3+3 mmol·L-1NaHCO3+5%丙酮(图5A)、7 mmol·L-1Na2CO3+3 mmol·L-1NaHCO3+25%丙酮(图5B)及不用丙酮,改为12.8 mmol·L-1Na2CO33 种淋洗液对分离效果的影响。

图5 不同淋洗条件下的色谱图
图5A 与图6B 相比,随着丙酮浓度增加,柠檬酸保留时间缩短,峰形变得尖锐。但因加入高浓度的丙酮后,基线漂移严重,且随着进样次数增加,保留时间越来越延后,还会出现抑制器饱和的现象,故不加入丙酮,逐渐改变Na2CO3的浓度,最后确定12.8 mmol·L-1Na2CO3作为淋洗液进行阴离子分子最为合适,经济适用且环保。
在使用离子色谱测定阳离子时,大部分文献所采用的的流动相是20 mmol·L-1甲基磺酸,本实验采用5 mmol·L-1硝酸便可使各个离子得到很好的分离。实验过程中考察了1、5、10、15 mmol·L-1硝酸对钠、钾、镁的分离效果。结果显示,5 mmol·L-1硝酸即可实现钠钾镁的有效分离,且分离度>1.5。见表6。

表6 标准淋洗液流速下各阳离子色谱峰分离度
3.2 抑制器转换
过高浓度的淋洗液会使抑制器容量饱和,实验使用了在采集时间内对抑制器进行命令,使其8 分钟切换一次,避免抑制器饱和致使基线抬高,背景增大,且切换时间在磷酸根与柠檬酸根出峰时间之间,避免了对离子出峰的干扰。
3.3 柠檬酸根离子与等度洗脱
柠檬酸是弱有机酸,在离子色谱柱上保留较强,常用梯度洗脱方式与其他常见阴离子进行分离,但分析时间较长,对设备配置要求高。本实验采用简单的等度洗脱进行柠檬酸根测定,其离子能快速出峰,且峰型平稳,有效避免了梯度洗脱使基线不平稳,对仪器的配置要求高(通常需要配置四元泵或者二元泵)的麻烦。
