UPLC-MS 法测定艾滋合并结核患者血浆中替诺福韦浓度*
2021-05-08邢亚茹张丽军乐晓琴卢洪洲李迎迎
邢亚茹,张丽军,乐晓琴,陈 军,尹 林,卢洪洲,李迎迎
1 桂林医学院,桂林 541004;2 上海市公共卫生临床中心,复旦大学,上海 201508
目前,艾滋病(AIDS)仍然是全球主要公共卫生问题。艾滋病患者合并感染结核(TB)的风险比未感染HIV 者高26 倍[1]。富马酸替诺福韦酯(tenofovir disoproxil fumarate,TDF)为替诺福韦(tenofovir,TFV)的口服前体药物,是目前治疗艾滋病的一线药物,但是TFV 与肾脏损伤、特别是近端小管病变有关[2]。因此,对于艾滋合并结核的患者,测定TFV 的浓度可以协助临床优化个体用药,降低药物毒副作用,还能为抗艾滋药物-抗结核药物相互作用的研究提供基础数据。
目前文献[3-5]报道的关于测定人血浆中TFV 浓度的方法主要有高效液相色谱法(HPLC),紫外二极管阵列高效液相色谱法(UV-DAD-HPLC),高效液相-荧光法和高效液相色谱串联质谱法(LC-MS)等。但是在一些方法中,样品制备操作较繁琐,且费用较高[4,5]。本文建立了一种UPLC-MS 法测定人血浆中TFV 的浓度,该方法简单、快速,且已成功用于艾滋合并结核患者血浆中TFV 浓度的检测。
1 仪器与药品、试剂
超高效液相色谱仪(UPLC,美国Waters 公司);质谱分析仪(SCIEX 5500 QTRAP,美国AB 公司);百万分之一电子天平(瑞士Mettler Toledo XPE26,Mettler Toledo 公司)。
TFV 对照品(纯度99.7%)、内标TFV-d7(纯度99.6%)为TLC pharmaceutical standards 公司产品;甲醇为色谱纯;甲酸铵为分析纯;水为超纯水。
2 方法与结果
2.1 色谱、质谱条件
2.1.1 色谱条件色谱柱:Kinetex Phenyl-Hexyl(50 mm×3.0 mm,2.6 μm);流动相:5 mmol·L-1甲酸铵溶液(A)-甲醇溶液(B);柱温:40 ℃,每个样品分析时间为3.5 min;进样量:10 μL。流速为:0.0~0.5 min,0.2 mL·min-1;1.0~2.0 min,0.4 mL·min-1;2.5~3.5 min,0.35 mL·min-1。
2.1.2 质谱条件离子源:ESI(电喷雾电离源);正离子模式扫描;喷雾电压:5.0 kV;脱溶剂气温度:550 ℃;雾化气:414 kPa;辅助加热气:414 kPa;气帘气:138 kPa;碰撞气:中等流速(200~600 μL·min-1)。
扫描方式:多反应监测模式(MRM),TFV 和TFV-d7 的质谱检测参数见表1。

表1 TFV、TFV-d7 检测的质谱参数
在选定的质谱条件下,TFV 和TFV-d7 的离子对分别是288.0→176.1、295.3→183.2。见图1。

图1 TFV(A)和TFV-d7(B)的质谱图
2.2 溶液的配制
精密称取TFV 对照品2.992 mg,置于4 mL 安瓿瓶中,用10%甲醇溶解,得到1 mg·mL-1的储备液。然后用50%甲醇(1∶1,v∶v)稀释得到质量浓度为2000、1000、400、160、50、20、10 ng·mL-1的系列对照品溶液和1600、800、160、30、10 ng·mL-1的系列质控溶液。然后用空白血浆将对照品溶液和质控溶液稀释10 倍,得到对照品血浆样品溶液和质控血浆样品溶液。TFV-d7 标准品同样溶于10%甲醇中,得到浓度为1 mg·mL-1的内标溶液。
2.3 血浆样品预处理
取血浆样品50 μL 至1.5 mL 离心管中,加入甲醇150 μL(含TFV-d7 50 ng·mL-1),混匀,4 ℃、12000 r·min-1离心10 min,取上清液50 μL 置入EP管中,用100 μL 超纯水稀释,混匀后取100 μL 加入进样瓶内,进样10 μL。
2.4 选择性
按照“2.3”项下方法处理6 份不同来源的空白血浆,且不加内标。观察内源性物质是否干扰TFV和TFV-d7 的检测。
进样标准血浆对照品(定量下限,LLOQ)和临床样品,均在1.5min 附近检测到了单一的TFV 和TFVd7 色谱峰,而空白血浆在1.5 min 时无色谱峰,因此空白血浆不影响TFV 和TFV-d7 的检测。见图2。
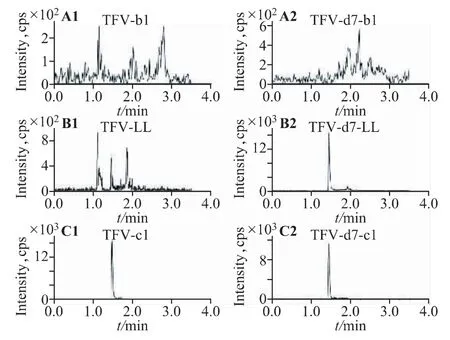
图2 分析物及其内标的色谱图
2.5 标准曲线制备
取“2.2”项下系列标准血浆样品,按照“2.3”项下方法预处理后进样分析,以TFV 与内标峰面积的比值(Y)为纵坐标、TFV 浓度(X)为横坐标,用加权最小二乘法(权重因子1/χ2)线性回归得到标准曲线(Y=3.65×10-2X-2.03×10-3,r=0.9983),线性范围为1~200 ng·mL-1,LLOQ 为1 ng·mL-1。
2.6 精密度和准确度试验
取空白血浆,将质控溶液稀释10 倍,配制浓度为160、80、16、3、1 ng·mL-1的质控品各6 份,按照“2.3”项下方法预处理后进样分析。连续测定3 个分析批。日内准确度在93.65%~103.45%,精密度(RSD)在2.42%~9.50%;日间准确度在96.42%~102.35%,精密度(RSD)在4.93%~12.54%。
2.7 提取回收率试验
配制低、高浓度的血浆质控样品各6 份,按照“2.3”项下方法预处理后进行分析,记录TFV 峰面积(A1)和内标峰面积。另取50μL 空白血浆,按照“2.3”项下方法预处理,加入等量质控溶液和内标溶液,进样分析,记录TFV 峰面积(A2)和内标峰面积。用A1与内标峰面积比值的平均值同A2与内标峰面积比值的平均值进行比值计算,得TFV 低、高质控样品提取回收率平均值,分别为114.36%、112.96%。RSD 均<15%。
2.8 基质效应
用超纯水将质控溶液稀释10 倍,配制低、高2 个浓度的质控品各6 份,按照“2.3”项下方法处理后进样分析,记录TFV 峰面积(A3)和内标峰面积。用A2与内标峰面积比值的平均值同A3与内标峰面积比值的平均值进行比值计算,得TFV 低、高质控样品基质效应平均值分别为89.49%、89.60%,RSD 均<15%。
2.9 稀释质控样品考察
配制血浆浓度为400 ng·mL-1的质控样品,加入4 倍(稀释因子=5)或者3 倍(稀释因子=4)体积的空白血浆,稀释制备成80、100ng·mL-1的2 种质控样品,按照“2.3”项下方法处理后进样分析,测得上述质控样品和血浆样品被不同比例稀释后的精密度,分别为5.81%和13.09%,准确度分别为89.39%和100.9%。
2.10 稳定性试验
配制低、高2 个浓度的质控样品各6 份,进行表2 内5 种条件的实验。按照“2.3”项下方法预处理进样分析,与新配制的标准曲线同时分析。稳定性试验表明,TFV 在不同条件下的稳定性良好,准确度在85%~115%,精密度<15%。

表2 不同储存条件下血浆中TFV 的稳定性(n=6)
2.11 UPLC-MS 法的应用
本研究建立的UPLC-MS 法成功用于艾滋合并结核患者血浆中TFV 浓度的测定。入组21 例艾滋合并结核患者(男性19 例),平均年龄46.56 岁(22~72 岁)。19 例用药方案为TDF+3TC+DTG,2 例用药方案为ETV/TDF+DTG。结核用药有:利福平、乙胺丁醇、吡嗪酰胺、异烟肼、阿米卡星、左氧氟沙星、莫西沙星等。每例采集了不同时间点的2 份样本,谷浓度和给药后(3±1)h 各1 分。每次采集2 mL 血液至K2EDTA 抗凝管,离心后吸取50 μL 血浆用于TFV 血药浓度检测。该项目经上海公共卫生临床中心伦理委员会批准(批件号:2017-Y037),所有患者均签署了知情同意书。TFV 血药浓度平均为108.54±87.94(2.02~413)ng·mL-1,谷浓度平均为82.26±58.29(2.02~276)ng·mL-1。其中6 份样品超出了定量上限(200 ng·mL-1),采用稀释后复测的结果。患者临床信息与药物浓度情况见表3。
3 讨论
3.1 方法的选择
建立的UPLC-MS 法测定人血浆中TFV 浓度,样品采用甲醇沉淀蛋白质法,方法简单易操作,样品用量少。TFV 浓度测定采用正离子多反应监测(MRM)模式,信号强度高,峰形良好,提取回收率、精密度和准确度均满足《中国药典》(2015 版)的要求。

表3 艾滋合并结核患者的临床信息及药物浓度
3.2 方法的应用
本方法测得21 例艾滋合并结核患者的TFV 血药浓度平均为(108.54±87.94)ng·mL-1。这与以往研究结果基本一致[3,6,7],例如,Rungtivasuwan K 等[3]对150 名泰国艾滋病患者的TFV 血药浓度进行测定,平均浓度为(100.3±52.7)ng·mL-1;Manosuthi W 等[6]测定了117 例以替诺福韦/拉米夫定/依非韦伦治疗的HIV-1 感染患者TFV 血药浓度,其24 周后血浆TFV 平均浓度为(105±46)ng·mL-1。可能为所选人群的差异。Wiriyakosol N 等[8]测得80 例感染HIV-1泰国患者的平均血浆TFV 浓度为(78.1±46.6)ng·mL-1(12.5~229.4 ng·mL-1),中值为62.4 ng·mL-1。本研究的艾滋合并结核患者与文献报道的单纯艾滋感染人群的TFV 浓度基本一致[3,6,7],未发现结核药物对TFV 的明显影响。
