急性脑梗死患者核心梗死可逆性改变影响因素及与溶栓时间窗的关系研究
2021-05-06冀书娟邓文静
冀书娟 康 康 邓文静 李 浩
1)信阳市中心医院,河南 信阳464000 2)郑州大学第一附属医院,河南 郑州 450052
急性缺血性脑卒中(acute cerebral infarction,ACI)是一种由椎动脉或颈动脉闭塞、狭窄所引起的脑部供血不足症状,在患者发病早期采取有效措施以实现阻塞动脉的再通,改善脑部供血是减轻脑部组织损伤程度、改善其预后的重要手段[1-2]。受到人口老龄化、饮食结构变化、生活习惯等多种因素的影响,近年来ACI发生率均呈逐年上升趋势。ACI已成为致死、致残率最高的脑血管疾病之一,给家庭及社会带来极大负担[3]。近年来以rt-PA 为代表静脉溶栓治疗已被广泛用于ACI 患者急救治疗,在增加近远期临床获益方面显现出良好优势,但相当一部分因错过溶栓时间窗而丧失治疗机会[4]。研究证实多模式CT 或MRI 能够筛选出部分入院治疗时间延迟但接受再灌注治疗仍可获益人群。以上筛选方法基于组织窗,关键在于可挽救缺血半暗带范围评估[5-6]。
颅脑MRI-DWI 检查被认为是核心梗死区域评估主要影像学手段之一,但急诊下MRI 检查存在操作繁琐、检查难度大的问题,导致其在ACI患者治疗决策中应用受限[7]。而CT成像相较于MRI则更为简便快捷,但CT灌注成像评估核心梗死区因检查参数仅能反映血流灌注缺损程度,其准确性较易受发病时间及血流再灌注状态影响[8]。目前认为CT灌注成像众参数中评价核心梗死最为可靠标准为rCBF<30%,但以往主要被用于评估超时间窗ACI患者再灌注治疗可能[9]。已有研究显示部分AIS 患者即便在溶栓时间窗内行静脉溶栓预后仍然较差,甚至出现出血转化;同时基线核心梗死区域体积可用于预测ACI患者远期预后及出血转化风险[10]。
本研究回顾性分析信阳市中心医院2014-01—2020-05 行静脉溶栓的194 例ACI 患者的临床资料,分析溶栓时间窗与核心梗死可逆性改变间相关性,评价ACI 患者核心梗死可逆性改变影响因素,旨在探讨ACI患者核心梗死可逆性改变影响因素及与溶栓时间窗的关系,为后续临床诊疗工作提供更多参考。
1 资料与方法
1.1 一般资料 选取信阳市中心医院2014-01—2020-05 收治行静脉溶栓ACI 患者194 例。纳入标准:(1)临床确诊前循环ACI;(2)顺利完成静脉溶栓;(3)发病至接受溶栓治疗在9 h 内;(4)年龄18~80岁;(5)明确局灶性神经功能缺损症状体征;(6)完成静脉溶栓后24 h 内颅脑CT 检查及48 h 内完成多模MRI检查;(7)基线核心梗死体积≥5 mL;(7)颈内动脉、大脑中动脉M1/M2 段或大脑前动脉闭塞。排除标准:(1)静脉溶栓禁忌证;(2)巨大血肿或水肿影响体积测量;(3)mRS评分>2分;(4)临床资料不全。研究方案设计符合《赫尔辛基宣言》要求,且患者或家属签署知情同意书。
1.2 方法
1.2.1 静脉溶栓:静脉溶栓rt-PA标准剂量为0.9 mg/kg,1 min 内给予10%剂量静脉推注,剩余剂量在60 min内静脉泵注完成;总剂量不超过90 mg。
1.2.2 资料收集:查阅病例记录患者年龄、性别、既往史及实验室检查指标;采用NIHSS 评分评估神经功能缺损程度,随访记录90 d mRS评分。
1.2.3 影像学检查:CT 检查采用Toshiba Aqulilion One 320 排CT,对比剂选择碘帕醇(370 mgI/mL),总剂量45 mL,注射速度5 mL/s。经前臂静脉将对比剂注入并开启灌注扫描,80 kV 和300 mA 条件下于第7 秒采集首个数据包,在80 kV 和150 mA 条件下第11~17 秒,第19~27 秒每隔2 s 采集1 个数据包;采用在80 kV 和300 mA 条件下第30~36 秒每隔2 s,第40~60 秒每隔5 s 采集1 个数据包。扫描范围自颅底至颅顶,总扫描时间60 s。
MRI 检查采用美国GE 公司Discovery750 型3.0T超导扫描仪,平行前联合至后联合连线完成轴向扫描,SWI 参数设置:TR/TE=60/4.2 ms,FOV=24 cm×24 cm,矩阵=256 mm×256 mm,层厚=2 mm,无层距;T2-FLAIR 参数设置:TR/TE=8 400/150 ms,TI=2 100 ms,FOV=24 cm×24 cm,矩阵=256 mm×256 mm,层厚=4 mm,无层距;DWI 参数设置:TR/TE=4 000/69.3 ms,b 值=1 000 s/mm2,FOV=24 cm×24 cm,矩阵=160 mm×160 mm,层厚=5 mm,层距=1 mm。MRA检查横断位采集自原始层,采用最大密度投影法完成旋转成像重建。
1.2.4 影像学处理:①核心梗死区判定采用MIStar软件,根据CT 灌注原始影像进行重建,其中rCBF<30%脑组织判定为基线核心梗死区;治疗后24~48 h行DWI 复查高信号区域判定为最终核心梗死区[11];②核心梗死可逆性改变判定标准为基线与最终核心梗死区体积差值≥5 mL[12];③血管再通判定根据AOL量表分级,即AOL≥2级判定为血管再通[12]。
1.3 统计学处理 应用SPSS 22.0软件处理数据;正态性评估采用Kolmogorov-Smirnov检验,其中符合正态分布计量资料以均数±标准差(±s)表示,比较采用t 检验;计数资料以率(%)表示,比较采用χ2检验;多因素分析采用二元Logistic 回归模型分析;相关性分析采用Spearman 法;以P<0.05 为差异有统计学意义。
2 结果
2.1 伴和未伴核心梗死可逆患者基线临床资料比较 伴核心梗死可逆患者原发性高血压比例、基线DBP 水平、发病至接受溶栓治疗时间及复查核心梗死体积均显著少于未伴核心梗死可逆患者(P<0.05);伴核心梗死可逆患者血管再通率和90 d预后良好率均显著多于未伴核心梗死可逆患者(P<0.05)。见表1。
表1 伴和未伴核心梗死可逆患者基线临床资料比较 (±s)Table 1 Comparison of baseline clinical data of patients with and without core infarction reversible (±s)
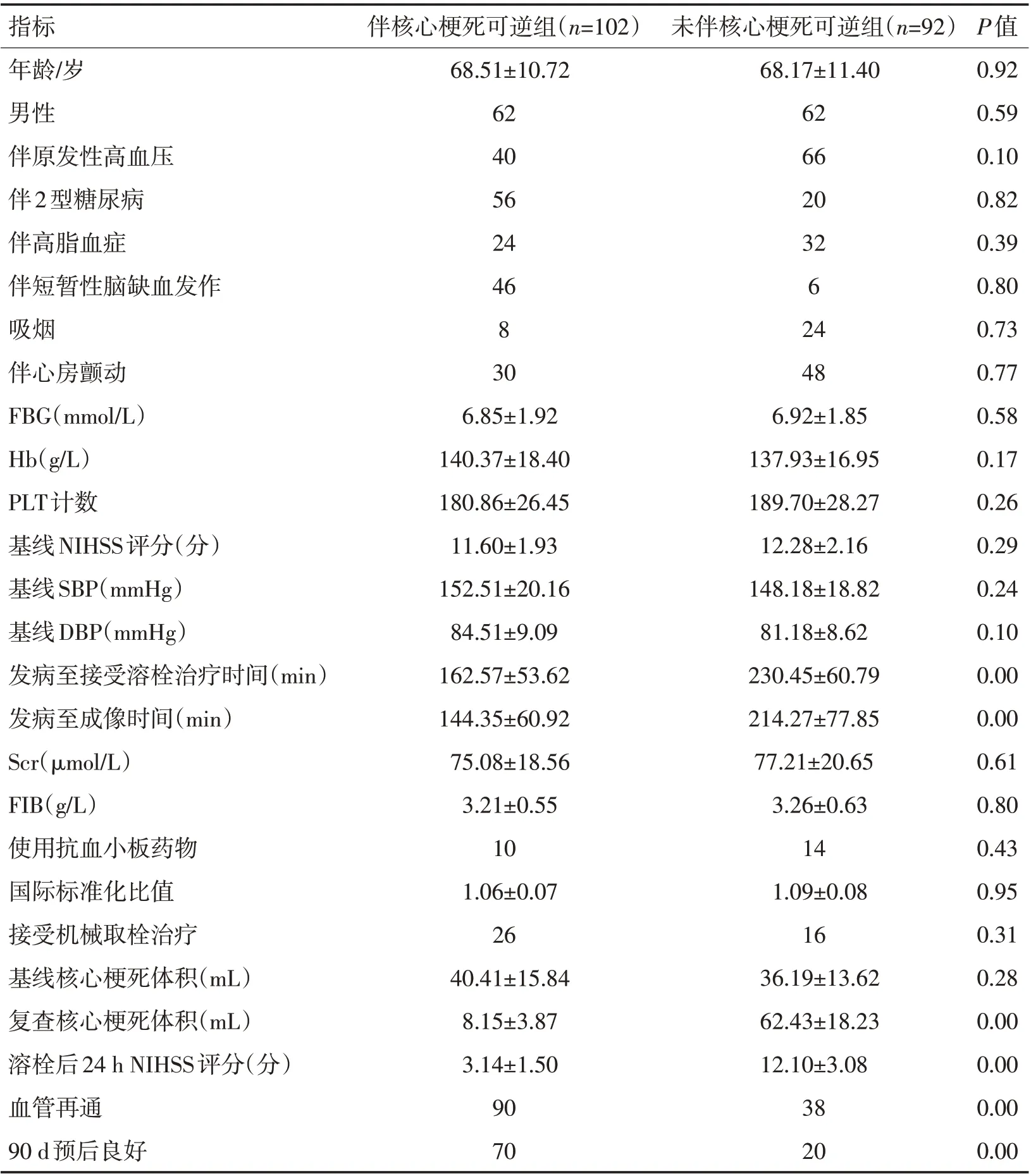
表1 伴和未伴核心梗死可逆患者基线临床资料比较 (±s)Table 1 Comparison of baseline clinical data of patients with and without core infarction reversible (±s)
指标伴核心梗死可逆组(n=102)未伴核心梗死可逆组(n=92)P值年龄/岁男性伴原发性高血压伴2型糖尿病伴高脂血症伴短暂性脑缺血发作吸烟伴心房颤动FBG(mmol/L)Hb(g/L)PLT计数基线NIHSS评分(分)基线SBP(mmHg)基线DBP(mmHg)发病至接受溶栓治疗时间(min)发病至成像时间(min)Scr(μmol/L)FIB(g/L)使用抗血小板药物国际标准化比值接受机械取栓治疗基线核心梗死体积(mL)复查核心梗死体积(mL)溶栓后24 h NIHSS评分(分)血管再通90 d预后良好68.51±10.72 62 40 56 24 46 8 30 6.85±1.92 140.37±18.40 180.86±26.45 11.60±1.93 152.51±20.16 84.51±9.09 162.57±53.62 144.35±60.92 75.08±18.56 3.21±0.55 10 1.06±0.07 26 40.41±15.84 8.15±3.87 3.14±1.50 90 70 68.17±11.40 62 66 20 32 6 24 48 6.92±1.85 137.93±16.95 189.70±28.27 12.28±2.16 148.18±18.82 81.18±8.62 230.45±60.79 214.27±77.85 77.21±20.65 3.26±0.63 14 1.09±0.08 16 36.19±13.62 62.43±18.23 12.10±3.08 38 20 0.92 0.59 0.10 0.82 0.39 0.80 0.73 0.77 0.58 0.17 0.26 0.29 0.24 0.10 0.00 0.00 0.61 0.80 0.43 0.95 0.31 0.28 0.00 0.00 0.00 0.00
2.2 溶栓时间窗与核心梗死可逆性改变间相关性分析 选择血管再通作为分层变量,统计学分析提示,溶栓治疗时间窗与ACI患者核心梗死可逆发生有关(P<0.05),见表2。Spearman相关性分析显示,ACI患者可逆性核心梗死体积与基线核心梗死体积呈正相关(r=0.85,P=0.00)。
2.3 ACI 患者核心梗死可逆性改变影响因素分析多因素分析显示,伴原发性高血压、发病至接受溶栓治疗时间及伴血管再通是ACI患者核心梗死可逆性改变独立影响因素(P<0.05)。见表3。

表2 静脉溶栓血管再通与非血管再通患者核心梗死可逆比例比较Table 2 Comparison of reversible proportion of core infarction in patients with recanalization and non recanalization by intravenous thrombolysis
3 讨论
CT 灌注成像近年来已被多个ACI 相关诊疗指南推荐指导溶栓时间窗以外人群再灌注治疗[13-14]。核心梗死区域体积≥70 mL 以往被作为再灌注治疗禁忌证,此类患者即便顺利完成血流再灌注,但临床预后往往较差,更易发生出血转化[15-16]。CT灌注成像这种基于组织窗评估方法是否适用于各个溶栓时间窗行静脉溶栓患者尚无明确定论。
本研究证实,ACI患者中发病至接受溶栓治疗时间<6.0 h 人群如实现责任血管再通,40%患者可能发生核心梗死区域可逆性改变,且这一可逆性改变体积与基线核心梗死体积呈正相关。一项研究分析基于CT灌注成像所评估核心梗死区域在接受静脉溶栓和机械取栓ACI患者中的准确性,结果显示静脉溶栓治疗患者中rCBF<30%所判定核心梗死区域与24 h复查DWI下确定梗死体积较为接近,但接受机械取栓治疗患者这一标准评估体积明显高于实际体积;导致这一差异形成原因可能为接受机械取栓治疗患者更早实现血流再灌注,推测判定标准设为rCBF<20%可能更为合适[17-19]。以上研究中并未明确入院至接受静脉溶栓治疗或血流再灌注时间,同时血管闭塞部位分布亦与本次研究存在较大差异,故两项研究无法直接比较,但研究结论基本一致,即ACI患者越早实现再灌注,则rCBF<30%所判定核心梗死可逆性改变发生率越高。本研究在以往报道基础上进一步分析不同溶栓时间窗下再灌注治疗患者核心梗死出现可逆性改变可能,Spearman 相关性分析显示,ACI 患者可逆性核心梗死体积与基线核心梗死体积呈正相关。在责任血管未再通患者中亦观察到核心梗死可逆性改变,以上患者发病至接受静脉溶栓治疗时间均<4.5 h,可能因侧支循环早期开放使得部分缺血较严重脑组织被挽救,静脉溶栓治疗尽管未能实现责任血管再通,但仍可在一定程度上将下游微栓子进行彻底清除,从而有效改善微循环灌注[20-22]。

表3 ACI患者核心梗死可逆性改变发生影响因素Logistic回归模型多因素分析Table 3 Logistic regression model multivariate analysis of influencing factors of reversible change of core infarction in patients with ACI
本研究证实,伴原发性高血压亦是影响ACI 患者静脉溶栓后核心梗死可逆性独立危险因素,可能与原发性高血压病患者基础血管条件较差有关[23-24]。以往观点认为基线血压水平高可改善侧支循环灌注状态,但亦有研究认为ACI 患者如早期实现血流再灌注,则基线血压水平高者预后更佳,反之则可能导致梗死体积扩大及结局恶化[25-27]。
既往研究认为,对于溶栓时间窗不同ACI患者,基线CT 灌注成像需采用不同判定标准方可准确评估不可逆核心梗死范围[28-29],但在实际临床治疗过程中往往无法准确预测患者获得溶栓治疗时间,故无法通过特定参数阈值评估基线核心梗死体积并指导治疗方案制定[30]。本研究证实采用rCBF<30%这一固定阈值评估基线核心梗死区域,同时结合溶栓时间窗能够准确判定基线核心梗死可逆性改变发生率及范围。
本研究亦存在一定局限:(1)因不同成像模式下图像直接匹配存在较大误差,本研究并未严格匹配基线CT灌注和复查DWI图像,如患者在2次CT检查间出现部分核心梗死区可逆性改变,或缺血半暗带发生梗死进展,可能导致难以真实反映核心梗死可逆性改变区域;(2)本次研究将核心梗死区域可逆性改变阈值设置为5 mL,可能导致真实出现可逆性改变比例被低估。
伴原发性高血压、发病至接受溶栓治疗时间及伴血管再通与ACI患者核心梗死可逆性改变发生独立相关;溶栓时间窗<6 h内患者实现闭塞血管再通后大部分可出现核心梗死可逆性改变。
