Spastin 基因突变对斑马鱼脊髓运动神经元的作用研究*
2021-05-03赖晓娜李媛媛巫荣华董张及
赖晓娜,李媛媛,陈 旭,巫荣华,董张及*,刘 梅*
(南通大学教育部/江苏省神经再生重点实验室/神经再生协同创新中心,南通 226001)
遗传性痉挛性截瘫(hereditary spastic paraplegia,HSP)是一类遗传性的神经系统退行性疾病,主要累及上运动神经元,表现为脊髓双侧皮质脊髓束的轴索变性和(或)脱髓鞘。在HSP 病程中,上神经元渐进性退化,导致出现下肢进行性痉挛、无力、行走困难等症状。目前HSP 已经发现超过70 种类型,其遗传方式包括常染色体显性、常染色体隐性和X 连锁隐性遗传[1],其中编码AAA(ATPase associated with various cellular activities)家族成员Spastin 的spast 基因的突变是导致常染色体显性HSP 的主要原因[2]。
Spastin 与Katanin 蛋白同属于一个蛋白家族,均具有ATP 酶活性,能利用ATP 水解产生能量切断和解聚微管,是一个微管切割蛋白[3]。spast 基因拥有两个起始密码子:第1 个起始密码子的Kozak 序列为tgaATGa,与典型的一致序列(g/a)ccATGg 序列的偏差较大,常被核糖体漏扫描,翻译效率较低;而其第2 个起始密码子周围序列是ctcATGg,更符合Kozak一致序列,其翻译效率较高[4-5]。因此可在不同水平上同时合成两种Spastin 同源异型体蛋白:全长同源异型体(称为M1)和较短同源异型体(根据第2 个起始密码子在不同物种中的位置命名,人类中为M87,啮齿动物中为M85,斑马鱼中为M61)[4]。
在啮齿动物中,M85 是所有发育阶段组织中的主要同源异型体,M1 型仅表达于成体脊髓[6]。在成人中枢神经系统中,M87 在脊髓和大脑皮层均有表达,而M1 优势表达于脊髓,却在脑中未能检出[7]。两种同源异型体都具有微管相互作用和运输结构域(MIT)、微管结合域(MTBD)和ATPase AAA 结构域。M1 则独有一个包含疏水结构域的N 末端区域,因此是一个完整的膜蛋白,可定位于多种细胞内膜性细胞器,包括内质网[8]、内体[9]和脂滴[10]等,参与内质网塑形和脂质代谢等非微管切割功能。两种同源异型体蛋白的差异定位提示它们的功能存在歧化,Spastin 蛋白的微管切割被认为是较短的同源异型体的主要功能,而不是M1 的主要功能。然而,关于两种同源异型体的功能研究大多在体外细胞水平进行,M1 在体内的独特作用尚未阐明。
斑马鱼是低等脊椎动物,但与高等脊椎动物在结构和功能上具有较高的同源性,其神经系统在发育、结构和功能上具有与哺乳动物神经系统保守性较强的特点[11-13],且其发育早期透明,又拥有众多组织特异性表达特征的品系,可直接观察特定神经元的发育情况。本研究通过对spast 基因敲除斑马鱼的运动行为进行观察和分析,并与特殊品系的斑马鱼杂交,观察其后代脊髓运动神经元表型变化,以阐明Spastin M1 在体内的作用,为阐释HSP 的发病机制探索新的研究视角。
1 材料与方法
1.1 斑马鱼饲养及繁育 spast 基因突变体斑马鱼(ZKO988a 品系),购于中国斑马鱼资源中心。转基因斑马鱼Tg(hb9:eGFP),该品系斑马鱼的脊髓运动神经元CaP 神经元表达绿色荧光蛋白,又名Tg(mnx1:eGFP),由南通大学神经再生重点实验室斑马鱼平台提供。斑马鱼按14 h 光照:10 h 黑暗周期进行饲养。第2 代斑马鱼卵在自然交配后采集:当天晚上将雌雄spast 杂合突变斑马鱼spast+/ZKO988a按照1∶1 的比例放入杂交缸中,用隔板分开雌雄斑马鱼,第2 天早上9 时取下隔板。将斑马鱼胚胎收集于90 mm 的培养皿中(每个培养皿50 个卵),用斑马鱼培养液E3 buffer培养,每天更换新鲜培养液,28.5 ℃培养箱中培养至受精后5 d(5 dpf)。接着将幼鱼放入杂交缸中饲养2 周后移至循环水系统中饲养,并进行基因型鉴定。严格按南通大学动物实验伦理审查规范进行实验。
将spast 纯合突变斑马鱼spastZKO988a/ZKO988a与转基因斑马鱼Tg(hb9:eGFP)按照1∶1 的比例进行交配,通过荧光筛选和测序鉴定基因型得到带绿色荧光标记运动神经元的spast 杂合突变体斑马鱼Tg(hb9:eGFP);spast+/ZKO988a,用于后续实验。
1.2 spast 基因突变体斑马鱼的基因型鉴定 将斑马鱼胚胎或者剪下的成鱼尾鳍放入0.2 mL EP 管中,加入10 μL YSY buffer,离心使样本浸入液体中,置于56 ℃1 h,使样本充分裂解、释放基因组DNA。取1 μL 基因组DNA 样品作为模板,使用spast 特异性的引物spast-F(5′-atgaattctgggcacaaagc-3′)和spast-R(5′-cctcgtcgatctgcagag-3′)对基因组DNA 进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,得到斑马鱼spast 基因组DNA 片段;将PCR 产物进行DNA 测序,测序引物为spast-SF(5′-gcttgcggtccggtgtctga-3′),分析确定spast 基因型。
1.3 斑马鱼的运动行为分析 收集雌雄spast 杂合突变斑马鱼交配所产的胚胎,待其发育至特定时间,将斑马鱼幼鱼转移至48 孔板(每孔放入1 条鱼并加入500 μL 系统水)。将48 孔板放入斑马鱼专用动物行为分析仪的观察箱/室中适应0.5 h,观察箱中的实时录影功能记录斑马鱼幼鱼在无刺激和不同刺激状态下的活动情况:待斑马鱼幼鱼适应0.5 h 后,进行时长为1 h、全程光照无刺激运动行为学检测;让斑马鱼幼鱼在光照下适应0.5 h 后,光照10 min 黑暗10 min 的节律重复4 次给予光刺激,进行光刺激下运动行为学检测;让斑马鱼幼鱼在光照下适应0.5 h,开始拍摄后10 min 敲击1 次(强度为8),后续每15 min 敲击1 次(强度为8)重复4 次给予声音刺激,进行声音刺激下运动行为学检测;用动物运动跟踪系统(EthoVision XT)对不同实验的48 条斑马鱼幼鱼游泳速度进行统计。
1.4 共聚焦成像观察斑马鱼脊髓运动神经元表型收集雌雄Tg(hb9:eGFP);spast 斑马鱼交配所产的胚胎,置于E3 缓冲液中培养,24 h 后更换含0.003%苯硫脲(1-Phenyl-2-thiourea,PTU)的E3 缓冲液培养,待斑马鱼发育至受精后72 h(72 hpf),在荧光显微镜下挑选脊髓运动神经元有绿色荧光标记的鱼放入皿中,低熔点琼脂糖固定,共聚焦拍摄斑马鱼脊髓神经元。拍摄结束后,将斑马鱼从琼脂糖中轻轻取出,提取斑马鱼幼鱼基因组DNA,进行基因型鉴定。
1.5 统计学方法 使用ImageJ 软件对斑马鱼神经元的轴突长度进行测量,用GraphPad Prism5 进行数据分析与统计,数据用表示。使用two-tail t 检验进行单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 spast 基因突变体斑马鱼的鉴定 从中国斑马鱼资源中心引种的spast 基因敲除的杂合子突变体斑马鱼(ZKO988a)由CRISPR/Cas9 技术建立,基因型为spast+/ZKO988a。通过斑马鱼资源中心给出的CRISPR/Cas9 靶位点与斑马鱼spast 基因序列进行比对,发现靶位点位于N 端(图1A)。将突变体spast+/ZKO988a斑马鱼相互交配并测序鉴定得到spast+/+野生型、spast+/ZKO988a杂合突变体、spastZKO988a/ZKO988a纯合突变体斑马鱼(图1B)。
2.2 spast 基因突变对斑马鱼在无刺激下运动行为的影响 为评估spast 基因敲除后是否对斑马鱼运动有影响,将突变体spast+/ZKO988a斑马鱼相互交配得到胚胎,待其发育至5、6、7 dpf,分别记录幼鱼在无刺激下自由游泳的情况,发现5、6、7 dpf 的spast 杂合突变体、纯合突变体的游泳速率与野生型均无显著差异(图2)。
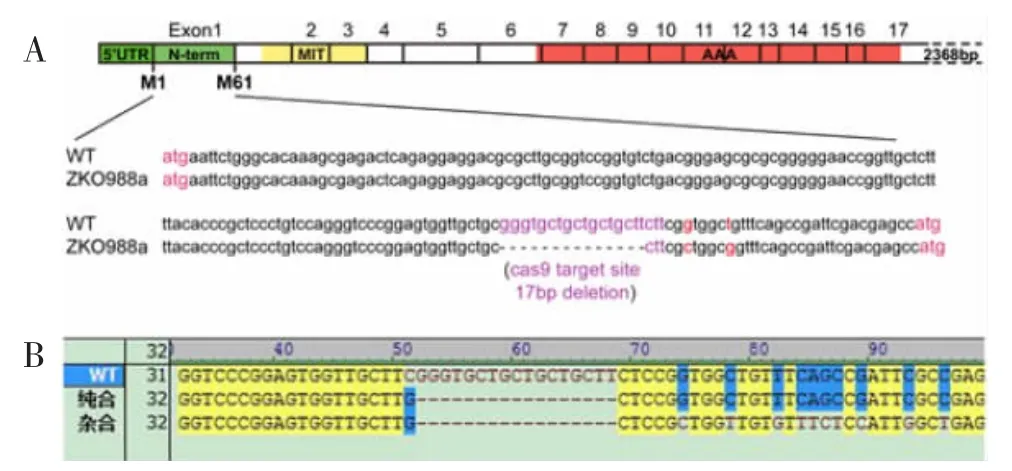
图1 spast 基因突变体斑马鱼的鉴定
2.3 spast 基因突变对斑马鱼在光刺激下运动行为的影响 为进一步确认spast 基因敲除对斑马鱼运动行为的影响,通过给予光刺激,观察5、6、7、8、9、10 dpf 的3 种基因型spast 突变体受到明暗变化刺激后的运动速度。均未发现5、6、7、8、9、10 dpf 的spast 杂合突变体、纯合突变体斑马鱼的运动速度与野生型之间存在显著差异(图3)。

图2 spast 基因突变体幼鱼在无刺激下自由游泳的运动行为分析

图3 spast 基因突变体幼鱼在光刺激下自由游泳的运动行为分析
2.4 spast 基因突变对斑马鱼在声音刺激下运动行为的影响 通过给予声音刺激观察5、6、7、8、9、10 dpf 的3 种spast 突变体受到惊吓后的运动速度。结果表明,虽然spast 纯合突变体在6 dpf 的运动速率比杂合突变体和野生型增加,但其在5、6、7、8、9、10 dpf 的运动速率与野生型无显著差异(图4)。

图4 spast 基因突变体幼鱼在声音刺激下自由游泳的运动行为分析
2.5 spast 基因突变对脊髓运动神经元表型的影响为研究spast 突变是否会影响脊髓运动神经元的发育,将Tg(hb9:eGFP);spast+/ZKO988a斑马鱼雌雄杂交,随机挑取72 hpf 且带绿色荧光的幼鱼,使用共聚焦显微镜拍摄脊髓运动神经元。结果表明spast 突变影响了神经元轴突长度和分支(图5A)。分别统计3 种基因型的神经元轴突长度和分支数,每种基因型各3 个个体,选取相近部位(16~18 体节)的脊髓运动神经元朝向腹侧的轴突,测量每根轴突的长度,与野生型相比,杂合突变体轴突长度缩短了14%,纯合突变体轴突长度缩短了19%,差异均有统计学意义(图5B)。通过测量每根轴突两侧的单位面积荧光强度来表示轴突分支的复杂度(图5C),杂合突变体和纯合突变体的轴突分支的复杂度与野生型比较差异无统计学意义。表明spast 突变影响脊髓运动神经元轴突的生长。
3 讨论
微管动力学对于维持运动神经元的轴突发育和(或)稳态至关重要,缺乏Spastin 微管切割活性导致微管动力学失调,影响神经系统功能[14-18]。近年来,随着对遗传性HSP 重要致病基因Spastin 的研究,发现其在多种细胞中具有多样性的功能作用,使得对spast 引起的HSP 发病机制的理解变得更为复杂。已有的研究表明Spastin 的两种亚型参与了多种细胞功能,如其中M1 型参与内质网重塑[8]、脂质滴稳态[10],而内质网的小管分裂过程中M1 和M87 型均有作用[19-20]。这些研究提示,两种亚型的Spastin 蛋白在细胞内的功能既有冗余,也有特异性,故而对不同亚型独特性作用的研究显得更有价值。
本研究中使用的斑马鱼的spast 敲除突变位点在该基因的N 端结构域,位于第2 个起始密码子之前,因此,可认为本研究中所得到的结果为Spastin M1 功能缺失所致。之前有研究使用CRISPR/Cas9 技术敲除spast 基因的突变体斑马鱼模型,其敲除位点位于第2 个起始密码子之后,即Spastin M1 和M61功能均缺少,结果发现spast 基因敲除后都出现明显的运动缺陷[21]。本研究显示Spastin M1 敲除后对斑马鱼运动行为无显著影响,提示运动神经系统的行为可能主要由Spastin M61 参与,或两者功能有冗余,在单纯缺失M1 的情况下未能显示出显著缺陷。spast 基因敲除后,斑马鱼的次级运动神经元(secondary motor neurons,sMN)的背神经轴突缺失且吻神经相关的sMN 轴突转向相反的方向[21]。在研究中也观察到相似的表型,但分析发现与野生型相比差异并无统计学意义。然而,本研究发现一个新的神经元轴突表型,即spast 杂合突变体和纯合突变体朝腹侧的CaP神经元的轴突长度较野生型的显著变短。据此推测Spastin M1 的功能缺失,虽未显著影响斑马鱼运动神经系统功能,却导致脊髓运动神经元表型缺陷。
本研究提示,仅缺失Spastin M1 功能的突变体,其神经系统出现缺陷的表型较轻、发病进程较慢。而Spastin M1 缺失对于HSP 疾病的功能障碍的贡献度及与HSP 致病率之间的关系有待进一步研究。
