VPS4B 在克罗恩病发病中的作用机制研究*
2021-05-03刘玉峰徐伟松顾新红刘肇修倪润洲肖明兵
刘玉峰,徐伟松,范 辉,顾新红,刘肇修,倪润洲,肖明兵***
(1 江苏省南通市第二人民医院消化内科,南通 226002;2 南通大学附属医院消化内科)
克罗恩病(Crohn′s disease,CD)是一种病因不明的慢性非特异性胃肠道肉芽肿性炎症性疾病,主要影响胃肠道的黏膜层及黏膜下层,以炎症的缓解和复发交替为特征[1]。临床表现为腹痛、腹泻、腹块、瘘管形成和肠梗阻,可伴有发热、贫血、营养障碍及关节、皮肤、眼、口腔黏膜、肝脏等肠外损害。近年来,CD 在我国的发病率明显上升,多见于18~35 岁人群[1]。研究[2-3]表明,遗传易感基因、环境和免疫系统之间复杂的一系列相互作用参与了CD 的发生发展,而肠上皮屏障破坏是以上这些因素发生作用的前提。肠上皮细胞的增殖和凋亡的平衡维持着肠上皮屏障完整,肠道屏障的破坏引发了强烈的炎症反应。研究[4]显示,凋亡的肠上皮细胞数目在CD 患者的炎症部位明显多于其非炎症部位,因此研究CD 肠上皮细胞凋亡的作用机制将为CD 的治疗提供潜在的分子药物靶点,具有显著的临床意义。
1 资料与方法
1.1 一般资料 收集南通市第二人民医院2014 年1 月—2019 年12 月CD 患者肠黏膜及健康人群肠黏膜石蜡标本各10 例,由南通市第二人民医院病理科提供。有完整的临床病理资料。选取8~10 周大小、体质量约20 g 的健康雌性BALB/C 小鼠,由南通大学实验动物中心提供。所有动物的试验处理过程,均按照南通大学实验动物规则严格执行,得到南通大学实验动物伦理委员会批准。
1.2 实验方法 取CD 患者炎症部位及正常对照人群的肠黏膜活检组织,进行免疫组化检测VPS4B 的表达和定位。建立三硝基苯磺酸(trinitrobenzenesulphonic acid,TNBS)诱导的结肠炎动物模型,模型建立参照E.Hollenbach 等[5]的方法。选用健康雌性BALB/C 小鼠,体质量18~20 g,将小鼠随机分为TNBS组和乙醇对照组,每组25 只,禁食24 h 后,称重。TNBS 组灌肠注入10 mL 的TNBS 灌肠液5% w/v TNBS 试剂与无水乙醇1∶1 配制),乙醇对照组注入10 mL 的50%乙醇溶液。造模后将小鼠常规饲养。每日观察并记录小鼠疾病活动性状(大便性状、大便潜血及体质量变化),若3 d 内小鼠体质量未持续下降,未出现血便则造模不成功,予以排除。分别在灌肠后的第1、2、3、4、5 天,每组用颈脱臼的方法随机处死5 只小鼠。另取5 只小鼠作为正常对照,不予灌肠,在禁食24 h 后处死。取小鼠直肠至回盲部的肠组织,参照结肠组织病理学评分标准[6],留取部分组织保存于-80 ℃冰箱以备提取蛋白,另一部分组织经4%多聚甲醛、20%蔗糖脱水、30%蔗糖脱水以备行切片用。
确定TNBS 诱导的结肠炎达高峰的时间,后续研究都选取这个时间点。将选取的小鼠肠组织标本一部分提取组织蛋白进行Western Blot 分析,检测TNBS结肠炎模型中VPS4B 蛋白及active caspase-3、裂解多聚(ADP-核糖)聚合酶[cleaved poly(ADP-ribose)polymerase,cleaved PARP](两种细胞凋亡指标)的表达水平。另一部分小鼠肠组织切片进行免疫组化及免疫荧光分析。
2 结果
2.1 VPS4B在CD 患者肠黏膜中的表达及定位 取CD 患者炎症部位及正常对照人群的肠黏膜活检组织,检测VPS4B 的表达和定位。免疫组化结果显示,VPS4B 在CD 患者炎症部位肠组织中高表达,主要定位于肠上皮细胞的胞浆(图1A)。Western Blot 结果也证实,VPS4B 在炎症组织的表达高于正常组织;同时,磷酸化的p38(phosphorylated p38,p-p38)表达在炎症组织中也升高(图1B~C)。这结果提示VPS4B在CD 的作用可能与p38 有丝分裂原活化的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号通路相关。
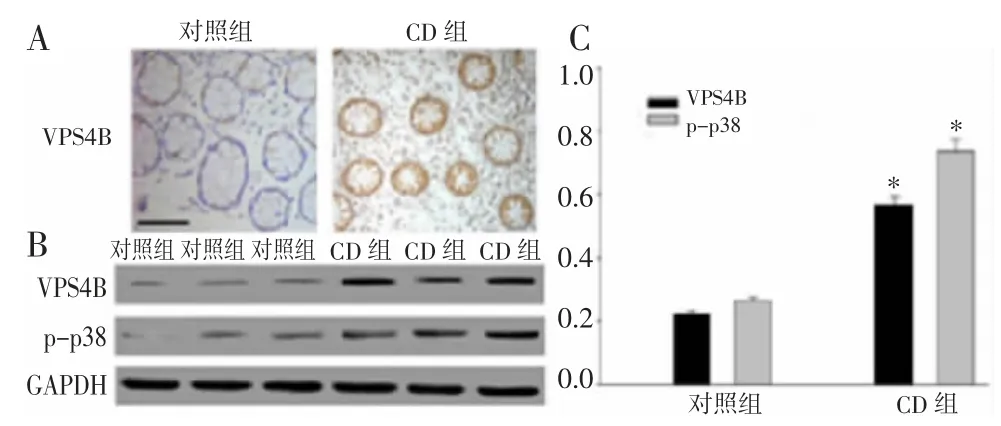
图1 VPS4B 在CD 患者和正常对照人群肠黏膜中的表达及定位
2.2 TNBS 诱导的小鼠结肠炎模型 TNBS 诱导的小鼠结肠炎模型的临床表现和形态改变类似人类CD,是CD 的经典动物模型[7]。体质量变化、病理改变、组织学评分是该模型是否成功的重要评价指标。结果显示,与乙醇对照组相比,TNBS 灌肠的小鼠在第2 天开始出现体质量下降,在第3 天达高峰。炎症细胞浸润、溃疡形成、上皮细胞缺失、水肿、增厚结肠壁,组织学评分在第3 天高峰,共10 分(P<0.05),在灌肠后第5 天开始缓解,表明TNBS 诱导的结肠炎模型构建成功,并在第3 天达到最高峰。
2.3 VPS4B 在TNBS 诱导的结肠炎模型中的表达及定位 TNBS 诱导的结肠炎在第3 天达高峰,因此在后续的研究均选取这个时间点。Western Blot 检测TNBS 结肠炎模型中VPS4B 的蛋白表达水平,结果显示,VPS4B 在TNBS 灌肠小鼠中的表达明显高于乙醇灌肠小鼠(图2A,P<0.05)。为进一步证实Western Blot 的结果,使用免疫组化检测TNBS 结肠炎模型VPS4B表达和分布,结果显示,与乙醇对照组相比,VPS4B 在TNBS 造模组中表达增加,主要定位于肠上皮细胞的胞浆(图2B),这与前述Western Blot及CD 患者肠组织免疫组化的结果相似。进一步利用免疫荧光将VPS4B 与肠上皮细胞标志物(E-cadherin)进行共定位分析,VPS4B 在TNBS 结肠炎模型中和E-cadherin 的共定位增加(图2C)。表明VPS4B在TNBS 诱导的结肠炎模型中表达增加,主要定位在肠上皮细胞。

图2 VPS4B 在TNBS 诱导的结肠炎模型中的表达
2.4 VPS4B 在TNBS 诱导的结肠炎模型中与肠上皮细胞的凋亡相关 研究[8]提示肠上皮细胞凋亡破坏了肠黏膜的完整性,并促进结肠炎发展。使用Western Blot 法分别检测active caspase-3、cleaved PARP(两种细胞凋亡指标)的表达变化,结果表明:active caspase-3、cleaved PARP 在TNBS 灌肠后的表达都显著增加(图3A,P<0.05),与VPS4B 的表达趋势一致。p-p38 在TNBS 诱导的结肠炎表达升高(图3B,P<0.05),p38 MAPK 信号通路参与CD的发病进程。免疫荧光双标分析显示在TNBS 结肠炎肠组织中,VPS4B 与active caspase-3 存在共定位(图3C),表明VPS4B 与肠上皮细胞的凋亡相关,可能通过p38 MAPK 信号通路发挥作用。

图3 VPS4B 与TNBS 诱导的结肠炎模型中的肠上皮细胞凋亡表达
3 讨论
CD 是一种原因不明的慢性复发性胃肠道炎症性疾病,好发于末段回肠和右半结肠,但全消化道均可累及,患者需长期服用药物治疗,甚至手术治疗,严重危害身心健康,影响生活质量。近年来,CD 在我国的发病率明显上升,但CD 的病因仍未明确,肠上皮细胞的凋亡和增殖的平衡失调导致上皮屏障功能的破坏,在该病的发病机制中有着重要作用。本研究发现在CD 中,VPS4B 参与肠上皮细胞的凋亡调节,其通过活化的p38 MAPK 信号通路发挥作用。
VPS4B 是与ATP 酶相关的、具有多种细胞活性AAA 类蛋白家族成员之一。VPS4B 是转运必需内吞体分选复合物机制组成部分之一[9],是多囊泡体的形成以及多种膜受体的降解所必须的,包括表皮生长因子受体和胰岛素受体。VPS4B 参与溶酶体降解途径、细胞内蛋白质运输、病毒出芽、胞质脱落以及调控有丝分裂和细胞分裂的不同阶段。但VPS4B 在CD 中的表达和可能的作用机制尚不清楚。
大量研究[10]证实,p38 MAPK 信号通路在肠道炎症中有重要作用。p38 有4 个亚型,p38α、p38β、p38γ和p38δ。p38 基因位于炎症性肠病易感区域3,p38是炎症性肠病炎症发生的重要激酶之一。p38 MAPK的活性在CD 活动期增高,p38 的活化可抑制肠上皮细胞增殖,促进肠上皮细胞凋亡[11]。p38α 在肠上皮细胞中缺失促进结肠炎发展,破坏了肠上皮细胞增殖与凋亡的动态平衡。然而,p38 调节CD 中肠上皮细胞凋亡具体的分子机制仍不清楚。
本研究发现在CD 患者中,VPS4B 表达在炎症部位明显高于非炎症区域,且主要定位在胞浆。在TNBS 灌肠诱导的小鼠结肠炎模型中,VPS4B 的表达与主要凋亡指标active caspase-3、cleaved PARP在肠上皮中的表达同步增高。免疫组化和免疫荧光双标分析均提示VPS4B 主要表达在肠上皮细胞中,免疫荧光还发现VPS4B 与active caspase-3 在肠上皮细胞中存在共定位,提示VPS4B 参与肠上皮细胞的凋亡过程。
但VPS4B 在CD 中是如何促进肠上皮细胞凋亡仍不清楚。与其他MAPK 相比,p38 MAPK 在炎症性肠病患者的炎症黏膜中活性最强。p38 MAPK 可以调控一些促炎因子的释放,如肿瘤坏死因子-α 及白细胞介素[12]。p38α 在肠上皮细胞特异性缺失破坏肠道上皮的内稳态,加速小鼠结肠炎的进程。研究[13]表明,p38 活性抑制肠上皮细胞的增殖,促进其凋亡。表皮生长因子受体的活化引起肠上皮细胞的内源性细胞凋亡是经由p38α 依赖性Bax 的激活[14]。
本研究发现VPS4B 在CD 患者的肠组织中表达增高,p-p38 也同样增高。同时在小鼠模型中也得到证实,提示VPS4B 参与肠上皮细胞的凋亡,主要是通过p38 MAPK 信号通路。因此,推测VPS4B 在CD 的病理机制中发挥了重要作用。然而需进一步研究以阐明VPS4B 在这些生物学病变中的作用及机制,为CD临床诊断和治疗提供更深入更全面的理论依据。
