肾去交感神经术调节PI3K/AKT/GSK-3β 通路改善糖尿病性心肌病大鼠心功能及心肌重构*
2021-05-03陆袁洲许智惠
陆袁洲,龚 伟,许智惠,陈 楚,陆 齐
(1 南通大学附属通州医院心血管内科,南通 226300;2 江苏省人民医院心血管内科;3 南通大学附属医院心血管内科)
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者最常见的并发症,是在异常糖代谢的基础上出现的一系列心脏损伤[1]。早期主要表现为心脏舒张功能异常,晚期则会出现心脏结构异常并伴胶原纤维沉积,极大影响了心脏射血功能,且易发展为充血性心力衰竭,是糖尿病患者发生猝死的重要原因之一[2]。相关流行病学研究[3]也显示,死于这种心血管疾病的糖尿病患者逐年增加,但目前尚无针对性的治疗策略。因此,如能有效缓解这种心血管相关并发症,延缓甚至逆转DCM 进程,可成为改善糖尿病患者预后的重要方法。
尽管目前DCM 的具体发病机制尚不明确,但相关研究[4]提示DCM 的发生发展可能涉及多个方面,如代谢障碍、氧化应激损伤、钙调节异常等。而近期研究[5-8]发现,神经体液系统的异常与影响DCM 发展的多个方面均有关,可能是促进DCM 的发展与恶化的重要原因。一方面,DCM 患者往往表现为交感神经主导优势[5],增加的儿茶酚胺水平与过量活性氧的释放密切相关[6],并会诱导纤维化的发展;另一方面,DCM 患者伴有的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的异常激活又会降低细胞对葡萄糖的敏感性[7],并促进水钠潴留进一步加重心功能障碍进展[8]。因此针对这种异常的神经体液进行持久有效的调节,可能成为改善DCM 的新策略。
肾去交感神经术(renal denervation,RDN)是心血管领域的一项新型神经体液调节技术。临床研究[9]已证实RDN 可通过消融肾脏交感神经长期有效地降低血压。而近期基础研究[10-11]还发现,RDN 在调节交感神经活性的同时还可有效抑制RAAS 系统活性,并可在此基础上有效改善心功能与心肌重构。因此RDN 在DCM 方面可能具有潜在治疗价值。但目前RDN 在DCM 方面的治疗效果与相关机制尚不明确。因此,本研究旨在通过构建DCM 模型大鼠,探讨RDN 对DCM 的影响并进一步探索其潜在机制。
1 材料与方法
1.1 实验动物 28 只清洁级雄性Sprague-Dawley(SD)大鼠购自南通大学实验动物中心,体质量180~200 g,于南通大学心内科实验室大鼠饲养室分笼饲养,每4 只大鼠一笼,室温18~22 ℃,相对湿度45%~65%。自由摄取标准水和食物,适应性喂养7 d 后开始造模。
1.2 主要试剂 戊巴比妥钠,20%苯酚,青霉素钠,磷酸缓冲盐溶液(phosphate buffered saline,PBS),液氮,4%多聚甲醛,链尿佐霉素(streptozotocin,STZ)(索来宝生物技术有限公司,北京)。去甲肾上腺素(noradrenaline,NA)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(华美生物工程有限公司,武汉)。SDS-PAGE 凝胶试剂盒(碧云天生物技术有限公司,上海)。TUNEL 凋亡检测试剂盒(赛维尔生物科技有限公司,武汉)。半胱天冬酶-3(caspase 3,C3)抗体,活性半胱天冬酶-3(cleaved caspase-3,CC3)抗体(Proteintech 公司,美国)。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体,丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)抗体,磷酸化丝氨酸/苏氨酸激酶(phospho-serine/threonine kinase,pAKT)抗体,糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)抗体,磷酸化糖原合成酶激酶-3β(phospho-glycogen synthase kinase-3β,pGSK-3β)抗体(Cell Signaling Technology 公司,美国)。
1.3 主要仪器 Vevo2100 彩色多普勒超声(Visual Sonics 公司,加拿大);罗氏活力型血糖仪(罗氏诊断公司,德国)。
1.4 实验方法
1.4.1 实验分组及DCM 造模 28 只SD 大鼠随机分为对照组(8 只),DCM 模型组(10 只)和RDN 治疗组(10 只)。对照组给予标准大鼠饲料喂养,DCM 组及RDN 组给予高脂高热量饲料喂养,4 周后3 组大鼠均行腹腔葡萄糖耐量及腹腔胰岛素耐量试验。DCM组及RDN 组出现胰岛素抵抗的大鼠给予30 mg/kg STZ 的柠檬酸缓冲液(pH4.5)腹腔注射;对照组给予同等体积的柠檬酸缓冲液腹腔注射。1 周后,检测大鼠空腹血糖,连续2 次空腹血糖≥11.1 mmol/L 的大鼠于STZ 注射后8 周行心超检测,左室收缩功能减退提示DCM 造模成功。本实验方案通过南通大学动物实验伦理委员会审查。
1.4.2 RDN 手术 DCM 造模成功后,RDN 组大鼠行RDN 手术。手术大鼠予2%戊巴比妥钠50 mg/kg腹腔注射麻醉后,俯卧位固定于手术台上。在一侧肋脊角下方2 横指处钝性分离筋膜及肌肉,直至暴露肾脏及肾周结缔组织,再进一步分离肾血管周围的疏松结缔组织和脂肪组织,以充分暴露肾血管及肾门。通过玻璃分针离断可视肾神经后,予苯酚沿着肾动脉走形反复涂抹1 min,充分破坏肾神经,再予生理盐水擦拭。同样的操作去除另一侧肾交感神经,逐层缝合肌肉及皮肤,肌肉注射青霉素预防感染。其余两组大鼠行假手术,暴露肾血管后不破坏肾神经。
1.4.3 心脏超声检测 STZ 注射后12 周,行超声心动图检测大鼠心功能。通过异氟烷诱导大鼠麻醉并维持,将大鼠仰卧位置于操作台上,固定四肢,心前区备皮、涂抹耦合剂,通过超高分辨率小动物超声影像系统(Vevo2100)记录大鼠瞬时心率并测量以下指标:左室舒张末期内径(left ventricular end diastolic diameter,LVDd)、左室收缩末期内径(left ventricular end systolic diameter,LVDs)、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室射血分数(left ventricular ejection fraction,LVEF)等。
1.4.4 心脏组织病理检测 完成心超检测后,通过腹腔注射过量戊巴比妥钠处死所有大鼠。完整取下心脏、肾脏组织。将每只大鼠的一半心脏及肾脏置于-80 ℃冰箱保存,另一部分心脏在4%多聚甲醛中浸泡48 h 后经脱水及石蜡包埋制成切片,进行Masson 染色。将病理切片置于普通光学显微镜下观察并摄片,并通过Image-Pro Plus 6.0 软件计算胶原容积分数(collagen volume fraction,CVF)。
1.4.5 心脏组织凋亡检测 通过TUNEL 免疫荧光法检测心肌细胞凋亡。将大鼠心肌组织固定脱水后制备冰冻切片,进行TUNEL 染色后用荧光猝灭封片液封片,再置于荧光倒置显微镜下观察并分析,每张切片数5 个视野并计算凋亡细胞的个数,计算心肌细胞凋亡率(cardiac myocyte apoptosis rate,CMAR)。
1.4.6 肾脏组织NA 水平检测 通过ELISA 检测肾脏组织NA 水平。取大鼠心肌组织称重后剪碎,用9倍匀浆介质研磨,再将研磨液3 000~4 000 r/min 离心10 min,取上清制备成10%的组织匀浆,放4 ℃冰箱,待测。按照ELISA 试剂盒说明书,加样、孵育及显色后,在酶标仪上于450 nm 处测各孔OD 值。根据标准品的浓度和OD 值做标准曲线,然后根据标准曲线方程计算出样本NA 浓度。
1.4.7 心脏组织蛋白水平检测 通过Western Blot法检测心脏组织中C3、CC3、PI3K、AKT、pAKT、GSK-3β及pGSK-3β 的蛋白表达水平。取大鼠心肌组织提取蛋白,BCA 法测定蛋白浓度后,经聚丙烯酰胺凝胶分离,并转至PVDF 膜上。封闭后分别孵育相应抗体(C3、CC3、PI3K、AKT、pAKT、GSK-3β 及pGSK-3β)过夜。洗膜后室温加入二抗孵育1 h,显色、曝光。通过ImageJ 软件分析灰度值,并计算蛋白相对表达量。
1.4.8 统计学方法 采用SPSS 21.0 软件处理分析数据,采用GraphPad Prism 5 软件作图,连续变量采用表示。使用单因素方差分析进行多组间的比较,使用Newman-Keuls 检验进一步进行组间两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 RDN 有效性评估 STZ 注射后12 周,RDN 组大鼠肾脏NA 水平显著低于对照组及DCM 组(均P<0.05,图1),提示RDN 手术有效降低肾脏交感神经活性,RDN 术有效。
2.2 RDN 改善DCM 大鼠心脏收缩功能 STZ 注射后12 周,与对照组大鼠相比,DCM 组大鼠的收缩功能减退,LVEF 及LVFS 均显著下降,LVDs 及LVDd均显著升高(均P<0.05,表1);而RDN 组的收缩功能改善(图2),LVEF 及LVFS 显著高于DCM 组,LVDs及LVDd 均显著低于DCM 组(均P<0.05,表1)。
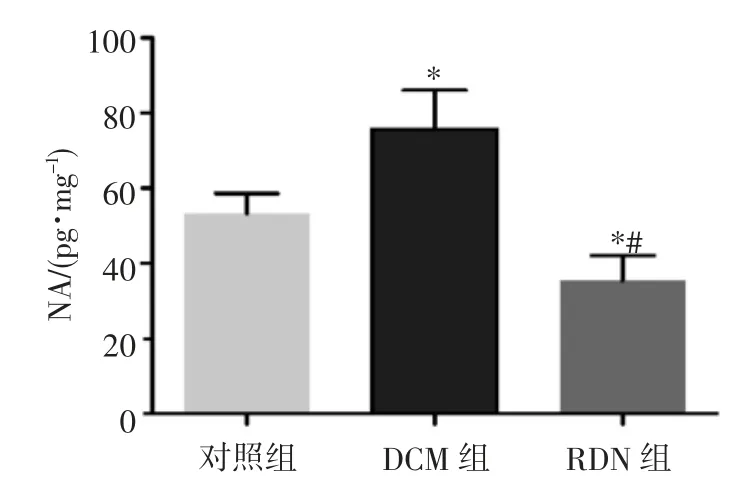
图1 3 组大鼠肾脏NA 水平统计图
表1 RDN 改善DCM 大鼠心功能()

表1 RDN 改善DCM 大鼠心功能()
注:与对照组相比,*P<0.05;与DCM 组相比,#P<0.05。

图2 3 组大鼠二维超声心动图
2.3 RDN 改善DCM 大鼠心肌纤维化 与对照组(图3A)相比,心脏Masson 染色可见DCM 组大鼠纤维化区域(蓝色)明显增加(图3B),RDN 组大鼠较DCM 大鼠纤维化区域有所减少(图3C)。且与DCM组相比,RDN 组大鼠左心室CVF 显著下降[(13.94±2.02)% vs (21.44±3.14)%,P<0.05,图3D]。
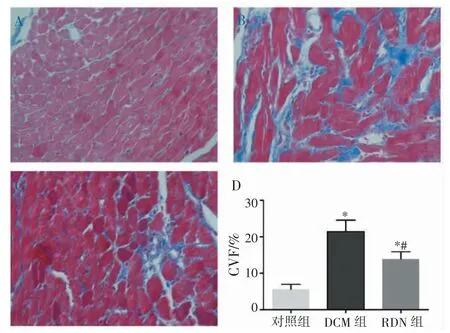
图3 3 组大鼠心脏组织的Masson 染色图
2.4 RDN 改善DCM 大鼠心肌细胞凋亡 心脏TUNEL 免疫荧光检测可见DCM 组大鼠的心肌细胞凋亡率显著高于对照组[(14.28±2.41)% vs (4.12±1.13)%,P<0.05],而RDN 组大鼠心肌细胞凋亡率则显著低于DCM 组[(8.62±1.63)% vs (14.28±2.41)%,P<0.05,图4A~D]。同时,与DCM 组相比,RDN 组大鼠心脏组织中凋亡相关蛋白CC3 的相对表达量也显著降低(P<0.05,图4E~F)。
2.5 RDN 调节DCM 大鼠心脏PI3K/AKT/GSK-3β通路 Western Blot 结果显示,与对照组大鼠相比,DCM 组大鼠心脏组织中PI3K、pAKT 及pGSK-3β的表达水平显著降低(P<0.05);而RDN 组大鼠的心脏组织中PI3K、pAKT 及pGSK-3β 的表达水平则显著高于DCM 大鼠(P<0.05,图5)。
3 讨论
本研究通过构建DCM 大鼠模型,发现RDN 有效改善了DCM 大鼠的心功能与心室重构,缓解了DCM 引起的心肌纤维化与心肌细胞凋亡,同时上调了DCM 大鼠心脏组织PI3K/AKT/GSK-3β 通路的蛋白表达。

图4 3 组大鼠心脏组织凋亡情况

图5 3 组大鼠心脏组织PI3K/AKT/GSK-3β 通路蛋白表达水平
DCM 是糖尿病时长期代谢异常引起的心肌细胞凋亡增多及一系列病理生理改变,尽管目前临床上尚无明确的诊断标准,但普遍表现为心肌重塑引起的心脏结构改变以及收缩功能下降引起的心功能改变[12]。本研究观察到,STZ 注射后12 周,DCM 组大鼠心脏组织凋亡水平明显升高,并出现明显的心肌间质纤维化,同时宏观上表现为心室内径增加以及射血分数的显著下降,与其他相关研究结果[13-14]一致,提示大鼠出现心脏损伤,DCM 造模有效。而在此基础上,进一步观察到RDN 治疗在调节交感神经活性的同时,有效缓解了DCM 大鼠心功能下降的趋势,显著改善了DCM 引起的心肌纤维化与心肌细胞凋亡,改善了心室结构的异常。共同提示RDN 可有效延缓DCM 的进展,可能成为改善DCM 预后的潜在治疗策略。
PI3K/AKT 信号通路参与人类的肿瘤形成、代谢疾病等多种病理生理过程。相关研究[15]发现,PI3K/AKT 信号通路可以通过促进糖原合成、刺激葡萄糖转运来调节胰岛素的代谢与功能,在糖尿病的发生发展中起到重要作用。而近年来的研究[16]发现,该通路的异常还会影响心肌细胞的代谢以及凋亡等活动,被证实与心力衰竭关系密切。因此,PI3K/AKT 通路的异常可能是促进DCM 的发展的重要原因。本研究发现,DCM 大鼠心肌组织中PI3K/AKT 水平显著下降,而RDN 有效改善DCM 心功能的同时也提高了PI3K/AKT 的表达水平,提示PI3K/AKT 可能是RDN 发挥抗DCM 作用的潜在信号途径。GSK-3β 是PI3K/AKT 下游的重要激酶,其活性升高会促进线粒体通透性转换孔(mitochondrial permeablility transition pore,mPTP)开放,发挥促凋亡的作用。而PI3K/AKT途径的激活可磷酸化GSK-3β,抑制其活性,减少凋亡水平[17]。与之一致,本研究发现RDN 在激活PI3K/AKT 通路的同时,有效提高了pGSK-3β 的水平,并在此基础上显著降低了DCM 引起的心肌细胞凋亡。因此,RDN 可能通过PI3K/AKT/GSK-3β 途径发挥抗凋亡及心脏保护作用。
综上所述,RDN 可有效改善DCM 模型大鼠的心功能及心脏重构,其机制可能与调节PI3K/AKT/GSK-3β 通路抑制心肌细胞凋亡有关。
