两种小鼠生精细胞染色体制备方法的探讨与评价*
2021-04-28卢文亮孟卫京薛春梅宁伟霞毛国丽郭兴萍
卢文亮 孟卫京 薛春梅 杨 静 宁伟霞 毛国丽 郭兴萍
(山西省生殖科学研究所,太原 030006)
生精细胞减数分裂期染色体分析是遗传学、组织学胚胎学、细胞生物学和生殖生物学研究的重要手段[1-2]。染色体是基因的载体,真核细胞染色体的数目和结构是重要的遗传指标之一[3-4],优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。目前,常规的减数分裂期染色体制备方法大体分为两类:体内注射秋水仙素法[5-6]和空气干燥直接制备法[7]。常规方法制作的小鼠生殖细胞减数分裂玻片标本,分裂的大部分细胞处于第一次减数分裂前期I的部分时期,如细线期、偶线期和粗线期。中期分裂相细胞少,染色体短而不清晰,背景模糊,不易观察且重复性差、不稳定。笔者参考Evans 等[2,7-12]的方法,优化了部分实验条件,采用改良的体内注射秋水仙素法和空气干燥直接制备法制备小鼠生精细胞减数分裂染色体,均获得理想的效果,现报告如下。
1 材料和方法
1.1 动物与试剂
Balb/c小白鼠,雄性,8~12周龄,25~30 g,山西医科大学实验动物中心提供。秋水仙素购自广州白云山拜迪生物医药有限公司;Giemsa 染液购自北京易世盛达科技发展有限公司,0.4%KCl、甲醇∶冰乙酸固定液(3∶1)、2.2%柠檬酸钠、1%柠檬酸钠、0.9%NaCl 等为常规分析纯配制。
1.2 改良的体内注射秋水仙素制备法
改良的体内注射秋水仙素制备法在王彬和陈晓东等[2,10]方法基础上进行。雄性小鼠以4 mg/kg腹腔注射秋水仙素,经6 h后,颈椎脱臼法处死小鼠,取出睾丸,去除白膜,用0.9% NaCl液洗去血污,放入装有2 mL 0.4% KC1液的5 cm培养皿中剪碎(呈乳白色),并轻轻吹打,使生精小管中的各级生精细胞释放出来。用70 μm 过滤器过滤到15 mL 刻度离心管中,再加0.4% KC1液至10 mL,37℃静置30 min,进行低渗处理。800~1 000 r/min离心8 min,弃上清;加入10 mL 甲醇冰乙酸固定液(3∶1)轻轻混匀,37℃固定10 min;重复2次。留少许上清液,制成细胞混悬液,取洁净的低温预冷载片,梯度滴片、染色并镜检,寻找分散良好、染色适中的分裂相,高倍镜下观察染色体形态,并计数。
1.3 改良的空气干燥直接制备法
改良的空气干燥直接制备法在Evans等[7-9,13]方法基础上进行。脱臼法处死小鼠,取出睾丸,去除被膜和附着的脂肪,并用等渗室温的2.2%柠檬酸钠溶液洗去血污。将睾丸转移到新鲜的2.2%柠檬酸钠溶液中,将生精小管拉出来,用剪刀剪碎,并用合适的尖锐的弯镊子彻底撕扯生精小管,直到管不透明和平坦为止。将上清液转移到15 mL离心管中,1 000 r/min离心10 min,弃上清液。将沉淀细胞用3 mL 1%柠檬酸钠重悬,室温条件下低渗处理12 min。1 000 r/min离心5 min,弃上清液。用拇指或示指轻弹来重悬细胞,以便在管壁上形成薄膜,快速加入0.25 mL甲醇冰乙酸固定液,轻弹混匀,然后逐滴缓缓加固定液到2 mL。室温下固定3次,每次10 min。用移液管吸取少许悬液,将悬液在室温下进行不同浓度梯度滴片。用PBS(pH 7.4)配制的10%Giemsa染色10~20 min,并镜检。
1.4 M期、MⅠ期和MⅡ期细胞分裂相计数及检出率计算
体内注射法每个秋水仙素浓度(4、6、8 mg/kg)用3只小鼠制片,直接制备法用3只小鼠制片。每只小鼠制片6张,3个细胞浓度梯度,选取其中最适浓度梯度的2 张可供分析的标本片进行观察,并计数分析。标准为:染色体分散良好,长度适中,背景清晰,精原细胞有丝分裂中期(M期)染色体数目40个,初级精母细胞减数第1次分裂中期(MⅠ期)二价体数目20个,次级精母细胞减数第2次分裂中期(MⅡ期)染色体数目20个。在每只小鼠的2 张玻片上计数1 000个分裂相(每张玻片500个,2张),分别统计减数分裂过程中M期、MⅠ期和MⅡ期分裂相的数目,并计算检出率。
1.5 统计学处理
采用SPSS 19.0 软件对数据进行统计学分析,计量资料以±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 生精细胞中期染色体比较
体内注射秋水仙素法获得的生精细胞染色体多为第1次减数分裂前期,呈细长形,并且边缘发毛,不需显带处理即可显示带纹,其次为精原细胞有丝分裂中期(M期),减数第1次分裂中期(MⅠ期)和减数第2次分裂中期(MⅡ期)的细胞较少(图1)。经空气干燥直接制备法获得的生精细胞染色体主要为初级和次级精母细胞分裂相,精原细胞分裂相少见,染色体明显呈粗短形,形态清晰,共40条,初级精母细胞MⅠ期染色体为二价体,多进行联会配对,呈“+”或环状,共有40条染色体,形成19个常染色体和1个X/Y 配对的性染色体二价体,性染色体二价体呈不对称,这与李建民等[14]报道一致。次级精母细胞MⅡ期染色体稍细长,姐妹染色单体未分离,边缘不整齐,Giemsa染色均匀,共20条。空气干燥直接制备法制备时间较短(图1)。
2.2 M期、MⅠ期MⅡ期细胞分裂相比例分析
用2种方法制备生精细胞染色体较常规制片方法均显著增加,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。在1 张标本片中,可供实验分析的3种不同阶段的睾丸生殖细胞染色体分裂相,体内注射秋水仙素法可观察到200~300个,直接制备法为140~200个。秋水仙素的最佳剂量是4 mg/kg,随着秋水仙素浓度的升高,减数分裂各期的分裂相减少,8 mg/kg 秋水仙素处理只能得到少数的M期分裂相,减数分裂前期分裂相骤减,空气干燥直接制备法制得的减数分裂中期分裂相数目比4 mg/kg 秋水仙素处理后减少,差异有统计学意义(P<0.05)(表1)。
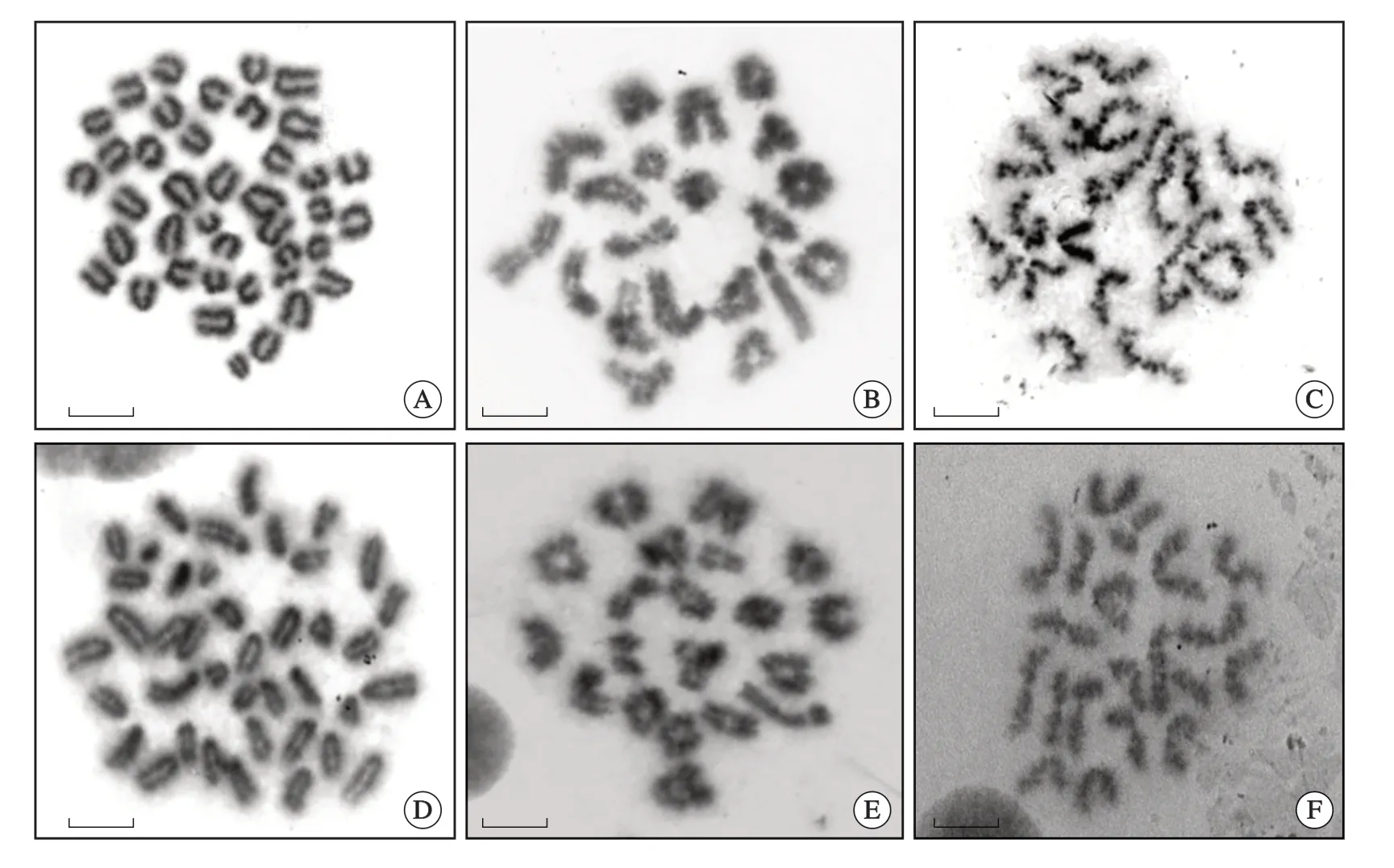
图1 不同发育阶段的小鼠睾丸生精细胞中期染色体,Giemsa染色,×1 000,标尺=2 μm
表1 两种方法计数1 000个分裂相中各中期细胞比例(n=3,±s)
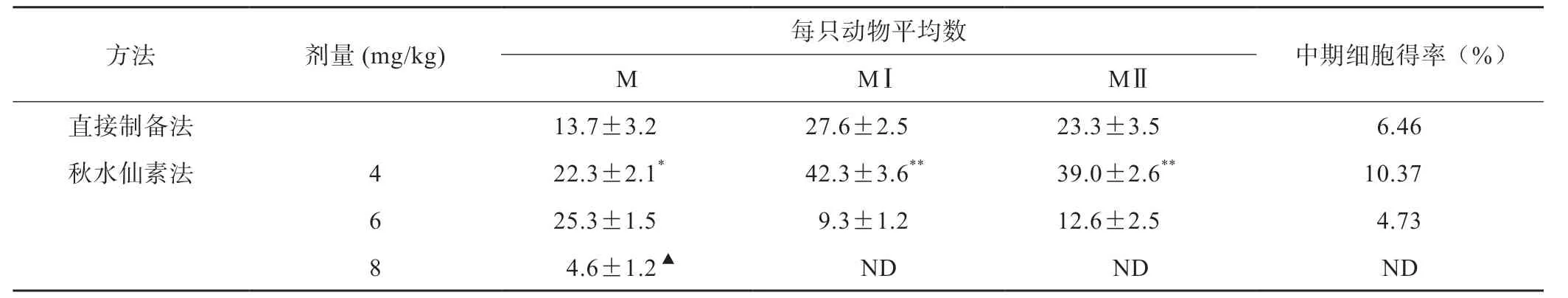
表1 两种方法计数1 000个分裂相中各中期细胞比例(n=3,±s)
▲分裂相较少,计数总数为100个分裂相;ND:无检出。*P<0.05,**P<0.01 vs 空气干燥法
方法 剂量(mg/kg) 每只动物平均数 中期细胞得率(%)M MⅠ MⅡ直接制备法 13.7±3.2 27.6±2.5 23.3±3.5 6.46秋水仙素法 4 22.3±2.1*42.3±3.6** 39.0±2.6** 10.37 6 25.3±1.5 9.3±1.2 12.6±2.5 4.73 8 4.6±1.2▲ ND ND ND
3 讨论
染色体制备技术是遗传学领域的一项关键基础技术,其中应用最成熟的是人外周血染色体制备及分析,已应用于临床诊断与分析[15]。小鼠睾丸细胞染色体制备技术为人睾丸细胞染色体制备提供技术基础,具有潜在应用价值,但由于睾丸细胞染色体制备过程复杂,影响因素多,在实际操作过程中要同时获得理想的3种中期染色体成功率很低,因此需要进一步改进优化。
本研究比较了秋水仙素注射法和空气干燥直接制备法制备小鼠睾丸细胞染色体,并讨论了制备过程中的注意事项和改进方法。关于秋水仙素浓度,当低渗液为0.4%KCl溶液时,用不同浓度秋水仙素(4、6 mg/kg 和8 mg/kg)处理,结果显示秋水仙素的最适浓度为4 mg/kg,这与苏爱等[17]报道一致。随着浓度的增加,中期的细胞数量减少,这可能与高浓度秋水仙素法易破坏着丝点,导致细胞分裂相减少有关。当低渗液为1%柠檬酸钠时,秋水仙素为0,即直接制备的效果要好,而6 mg/kg 和8 mg/kg 秋水仙素用量时分裂相很少。
关于去被膜及剪碎过程中缓冲液的使用,本研究认为等渗溶液即2 %柠檬酸钠溶液最为合适,可避免在剪碎过程中损伤生精细胞,影响分裂相得率。关于撕碎方式,本研究先用剪刀剪碎,再用1 mL注射器撕碎,撕碎后静置,轻轻吹打100余次,以便使更多的单细胞从曲细精管中释放出来。关于消化处理,王治乔等[19]报道用1%胰酶消化可以得到更多的中期细胞数,Hoo 等[8]报道用60%乙酸软化曲细精管可获得更多的中期细胞,但胰酶和乙酸均可使染色体边缘发毛,不整齐。本研究为得到边缘轮廓清晰的染色体而未采用此方法,同样获得了足够量的各级生精细胞,且边缘轮廓清晰。
本研究利用70 μm 细胞滤器过滤,可去除大块组织,增加制片效果。关于低渗及固定条件,本研究结果显示低渗条件为37℃30 min,固定条件为卡诺固定液(甲醇∶冰乙酸3∶1)固定2次,每次10 min,且加入固定液后迅速混匀,实验结果最佳。关于离心速度,本研究结果显示离心转速1 000~1 500 r/min为宜,>2 000 r/min时,未成熟的精子细胞就会沉淀下来,影响实验观察。梯度滴片法(将悬液进行不同浓度梯度的滴片)可以很好提高可供分析的分裂相的数量,成功率比单一的浓缩液滴片效果要好,值得推广。
综上所述,通过对2种染色体制备方法进行改进及比较表明,体内注射秋水仙素法可以得到较多的分裂相,而在制备的质量上,空气干燥直接制备法更容易得到轮廓清晰和便于分析的染色体核型,在今后应用中可根据实验需求进行灵活选用。
