体外骨形态发生蛋白4抑制乳腺癌细胞的增殖和迁移*
2021-04-28李海云杨东光洪秀丽李金波
李海云 杨东光 洪秀丽 李金波 王 辉
(涿州市医院普外科,涿州 072750)
远处转移是乳腺癌患者死亡的主要原因,而骨是乳腺癌最常见的远处转移部位,有65%~75%的乳腺癌可发生骨转移[1],其严重影响患者的生活质量和预后生存期。因此研究乳腺癌转移的发生机制,寻找新的治疗方式在临床治疗中具有非常重要的意义。骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)是在乳腺癌组织中表达最为广泛的BMP家族成员之一,其可能参与乳腺癌发生发展及骨转移进程,但具体作用机制尚不清楚。本研究以乳腺癌MCF-7细胞为模型,通过改变BMP4基因的表达变化,观察BMP4对乳腺癌细胞生物学行为的影响,并对可能的机制进行初步探讨。
1 材料和方法
1.1 主要材料和试剂
DMEM 高糖培养基、细胞培养胰蛋白酶(0.25%Tryopsin-EDTA)、PBS缓冲液、青链霉素溶液购自美国HyClone公司;胎牛血清(FBS)购自美国GibcoBRL公司;Ⅰ型胶原酶购自美国Gibco公司;二甲基亚砜(DMSO)、TRIzol 试剂购自美国 Invitrogen公司;CCK-8 购自日本同仁化学研究所;Transwell 小室购自美国Millipore公司;BMP4 和β-actin 引物由金唯智生物技术有限公司合成;Matrigel胶购自美国BD公司;PrimeScriptTMRT Master Mix、SYBR Premix Ex Taq II(TliRNaseH Plus)购自日本TaKaRa公司;MCF-7和293-T细胞购自北京协和细胞库
1.2 细胞培养及分组
采用添加有10%FBS的DMEM 高糖培养基,37℃、饱和湿度5%CO2条件下常规培养,MCF-7细胞2~3 d 换液,4~6 d传代;293T细胞2~3 d 传代一次。当细胞生长融合至90%时,弃去原培养基,PBS 轻轻洗涤细胞1遍,加入0.25%Tryopsin-EDTA 消化,显微镜下观察细胞回缩变圆、细胞间隙増大时,弃去胰酶,加入含有10%FBS的DMEM 高糖培养基终止消化,轻轻吹打至单细胞悬液,MCF-7按1∶6传代,293T按1:20传代。将MCF-7细胞慢病毒感染后分为以下几组:(1)空白组(Blank),慢病毒不感染MCF-7细胞;(2)慢病毒空载对照组(Lv-NC组),慢病毒空载体Lv-EGFP感染MCF-7细胞;(3)过表达实验组(Lv-BMP4组),重组慢病毒Lv-BMP4 感染MCF-7细胞;(4)干扰实验组(Lv-shBMP4组),重组慢病毒Lv-shBMP4 感染MCF-7细胞。
1.4 慢病毒包装、浓缩及滴度检测
转染前24 h,将生长状态良好处于对数期的293T细胞用胰酶消化制成细胞悬液,接种于10 cm细胞培养皿中;待细胞密度达到70%左右,将重组慢病毒质粒和psPAX2、pMD2.G 经PEI 共转染到293T细胞中,用无血清DMEM培养液培养4~6 h后,更换新鲜含10%FBS的DMEM培养液。48 h 收集病毒上清液,并添加新鲜培养基继续培养,转染72 h后继续收集病毒上清;4℃ 3 000 r/min离心15 min,离心收取的上清用0.45 μm 滤器进行过滤,4℃ 20 000r/min 超速离心2 h,1 mL 新鲜培养液重悬病毒沉淀,置于-80℃保存。
取对数生长期293T细胞,胰酶消化制成悬液,于96孔板加入293T细胞1×104/孔,体积100 μL,培养过夜;取10 μL 慢病毒原液,用含10%FBS的DMEM 完全培养液10倍稀释3~5个梯度,吸弃96孔板中原培养液,每孔加入100 μL 稀释的慢病毒液,同时设立空白对照组,37℃ 5%CO2培养24 h;吸弃稀释病毒培养液,更换新鲜培养液,37℃5%CO2培养72 h。通过倒置荧光显微镜计数荧光细胞数,并结合病毒稀释倍数计算病毒滴度。
1.5 慢病毒感染MCF-7细胞
取对数生长期的MCF-7细胞,胰酶消化制成单细胞悬液,细胞计数,3×105/孔接种于6孔板,添加培养基至每孔1.5 mL,37℃培养箱中培养。待细胞长至60%~70%汇合度时,更换新鲜培养基并添加适量慢病毒感染细胞。感染第2天,吸弃含病毒的培养液,更换新鲜的完全培养液继续培养。感染后72 h,荧光显微镜下观察感染效率。并收集感染后的细胞样本,用于Real-time PCR 和ELISA检测。
1.6 RT-PCR检测
感染72 h的MCF-7用PBS洗2次,然后加入适量的TRIzol,于室温下静置5min,加入氯仿100 μL,静置5min,置于4℃低温离心机中,12 000 r/min离心15min,小心吸取上清至新的EP管(不含RNA酶)中,加入和上清等体积的异丙醇,轻微振荡,在室温下静置10 min后,置于4℃低温离心机中,12 000 g离心10 min,弃上清留沉淀,并加入预先配好的75%乙醇,洗涤白色沉淀2次,动作要轻,避免将沉淀吹散,置于4℃低温离心机中,7 500 g离心5 min,弃掉乙醇,加入适量DEPC 水以溶解管底沉淀。测定总RNA的浓度:用核酸浓度测定仪监测提取的RNA 浓度。RNA的浓度用OD260/280 比值来表示。
按照PrimeScriptTMRT Master Mix第一链cDNA合成试剂盒操作说明合成cDNA,以1 μL cDNA为模板,进行 PCR 反应。反应体系:SYBR Premix Ex Taq II(2×)10 μL,引物(10 μmol/L)1 μL,模板(cDNA)1 μL,最后ddH2O 补足至总体积20 μL;混匀后上机。反应条件:95℃ 10s预变性,95℃ 5s变性,60℃ 15 s退火,72℃ 15 s延伸,40个循环。引物序列:β-actin:5'-AGAGGGAAATCGTGCGTGAC-3'(上游),5'-CCATACCCAGGAAGGAAGGCT-3'(下游);BMP4:5'-GGCTACCAGGCCTTCTACTG-3('上游);5'-CAGGCCTTAGGGATGCTAGA-3'(下游)。以β-actin为内参计算BMP4 mRNA相对表达量。
1.7 ELISA法检测
收集各慢病毒感染组上清,根据ELISA试剂盒说明书对细胞培养上清中BMP4的蛋白水平进行测定。使用酶标仪在450 nm 波长下进行读数并分析,根据标准曲线,计算分泌蛋白BMP4的浓度。
1.8 CCK-8法检测
每组设4 各平行孔。慢病毒感染72 h后,取各感染组细胞胰酶消化制成单细胞悬液,4×103/孔,每孔100 μL/铺96孔板,设4个时间点(1、2、3、4 d),置于培养箱中培养。到相应时间点,在铺有MCF-7细胞的96孔板中每孔加入10 μL CCK8,轻微振荡混匀,置于培养箱中继续培养1 h,终止培养;将其放在酶标仪上进行检测,将波长调为450 nm,记录各孔的吸光度(OD)值。
1.9 划痕实验检测
各组慢病毒感染MCF-7细胞72 h后,胰酶消化各感染组细胞并制成单细胞悬液,5×105/孔接种于6孔板中并补足培养液到每孔1.5 mL,置于培养箱中培养。待细胞长满后吸去孔内培养基,用10 μL 小吸头进行孔内划痕,用PBS 清洗划下的细胞,洗3次,然后在6孔板中每孔加入2.5 mL 无血清无抗生素的培养液,在荧光倒置显微镜下对划痕的6孔板中乳腺癌细胞拍照,沿划痕边缘等距离取3个视野,测量每个视野的划痕宽度,然后取每个视野的平均值,记为0 h 划痕宽度。之后,分别在24、48 h时取出6孔板对划痕细胞进行拍照,并在同一观测点计算划痕宽度。划痕愈合率(%)=(0 h的划痕宽度-48 h的划痕宽度)/0 h的划痕宽度×100%。以此反映MCF-7细胞横向迁移能力的变化。
1.10 Transwell 检测
实验分组同1.3,采用Transwell 小室进行细胞迁移实验,将乳腺癌 MCF-7细胞经胰蛋白酶消化及离心后计数,在Transwell 小室下室加入600 μL 含10%胎牛血清的培养液作为趋化刺激物,用8 μm 孔径的聚碳微孔膜,50 μL的Matrigel 胶(0.2 mg/mL)包被Transwell 小室上层,于上室加入400 μL 1.25×105/mL MCF-7细胞悬液。将小室置于37℃ 5%CO2培养箱24 h后,取出Transwell 小室,吸去培养液,用PBS溶液洗2次,自然干燥,用棉签拭去未穿膜的细胞;用4%多聚甲醛在室温下固定20 min,风干;用结晶紫染色20 min,水洗5~6次,风干。在荧光显微镜下随机选5个视野,观察每个视野穿膜细胞数,并取平均值,以评价各组乳腺癌MCF-7细胞的侵袭能力。
1.11 统计学处理
采用SPSS 22.0 统计学软件进行数据分析。以表示,组间比较采用单因素方差分析,组内两两比较采用SNK 检验;检验水准α=0.05,即以P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒包装及感染MCF-7细胞效率
荧光显微镜观察显示,进行慢病毒包装72 h后可见绿色荧光蛋白(GFP)表达,且荧光阳性率均达90%以上,显示慢病毒成功包装(图1A)。将包装好的慢病毒颗粒梯度稀释后感染MCF-7细胞,72 h后荧光倒置显微镜下观察细胞荧光情况。结果显示,慢病毒感染复数(MOI)值为40时,荧光显微镜观察视野中90%以上的细胞均可见绿色荧光蛋白,表明此时慢病毒成功感染MCF-7细胞。因此,将MOI值40 作为感染实验用MOI(图1B、C、D)。
2.2 MCF-7细胞BMP4 基因 mRNA的表达
Real-time PCR检测结果显示,重组慢病毒体外转染效率高,Lv-BMP4组BMP4表达的数值为4.50 ng/mL,与对照组Lv-NC表达数值1.00 ng/mL和空白组Blank表达数值1.00 ng/mL相比,差异具有统计学意义(P<0.01),而Lv-NC对照组与空白组Blank之间相比差异无统计学意义(P>0.05);LvshBMP4组BMP4的mRNA表达数值为0.5 ng/mL,表达水平低于Lv-NC对照组,差异有统计学意义
(P<0.01)。
2.3 MCF-7细胞上清中BMP4 蛋白表达水平
慢病毒转染72 h后,ELISA检 测MCF-7细胞BMP4 蛋白水平表达的变化,结果显示Lv-BMP4组(3.051±0.072)ng/mL 蛋白表达水平上调,与对照组Lv-NC(1.695±0.061)ng/mL相比差异具有统计学意义(P<0.05),而Lv-NC对照组(1.695±0.061)ng/mL与空白组Blank(1.493±0.055)ng/mL之间相比差异无统计学意义(P>0.05);Lv-BMP4 shRNA组(0.956±0.057)ng/mL BMP4的蛋白水平低于Lv-NC组(1.695±0.061)ng/mL,差异有统计学意义(P<0.05)。
2.4 BMP4对MCF-7细胞增殖能力的影响
CCK8 法检测结果显示,慢病毒感染后第3天,Lv-BMP4组增殖能力明显低于Lv-NC组,差异具有统计学意义(P<0.05),而Lv-NC组与Blank组之间差异无统计学意义(P>0.05),说明Lv-BMP4感染后乳腺癌MCF-7细胞的增殖活力在第3天时受到明显抑制;Lv-shBMP4组的增殖能力明显高于Lv-NC组,差异有统计学意义(P<0.05)。第4天时,Lv-BMP4组的细胞增殖活力也显著低于对照组(P<0.05),说明增殖抑制作用依然明显;Lv-shBMP4组的细胞增殖活力亦显著高于对照组(P<0.05)。说明在重组慢病毒感染过表达BMP4后能够在第3天和第4天抑制乳腺癌MCF-7细胞的增殖活力,而将BMP4 干扰后,乳腺癌MCF-7细胞的增殖活力明显增高。
2.5 BMP4对MCF-7细胞迁移能力的影响
划痕愈合实验结果显示(图2),24 h时Lv-BMP4 划痕愈合率已有低于对照组Lv-NC组的趋势,而Lv-shBMP4组的划痕愈合率亦有高于Lv-NC组的趋势。在48 h,Lv-BMP4组划痕愈合能力更加显著,而Lv-shBMP4组的划痕愈合能力也明显减小(表1)。
表1 划痕愈合实验检测慢病毒感染MCF-7细胞划痕愈合率(±s,%)

表1 划痕愈合实验检测慢病毒感染MCF-7细胞划痕愈合率(±s,%)
组别 0 h 24 h 48 h Blank 0.00 25.32±1.10 51.87±5.89 Lv-NC 0.00 26.41±1.08 52.63±6.89 Lv-BMP4 0.00 17.83±0.72 27.16±2.63 Lv-shBMP4 0.00 33.21±2.65 65.39±9.72
2.6 BMP4对MCF-7细胞侵袭能力的影响
利用Transwell 基质胶体外侵袭模型观察BMP4对MCF-7细胞侵袭的作用。结果显示,与对照组Lv-NC 相比,Lv-BMP4组中穿过Transwell基质胶半透膜到达下表面的细胞数量明显降低,而Lv-NC与空白组Blank组没有明显区别;Lv-shBMP4组与对照组相比,MCF-7细胞穿过Transwell 小室的数目显著升高,说明BMP4 可削弱MCF-7细胞的体外侵袭能力(图3)。

图1 慢病毒293T细胞包装效率及感染MCF-7细胞后感染效率,倒置荧光显微镜,×200,标尺=20 μm。A:慢病毒包装后293T细胞,荧光视场;B:病毒上清感染MCF-7细胞,Lv-NC组;C:病毒上清感染MCF-7细胞,Lv-BMP4组;D:病毒上清感染MCF-7细胞,Lv-BMP4 shRNA组.

图2 划痕愈合实验检测慢病毒感染MCF-7细胞0 h (A1~D1)、24 h (A2~D2)、48 h (A3~D3)后对细胞迁移能力的影响,标尺=20 μm。A:Blank组;B:Lv-NC组;C:Lv-BMP4组;D:Lv-shBMP4组.
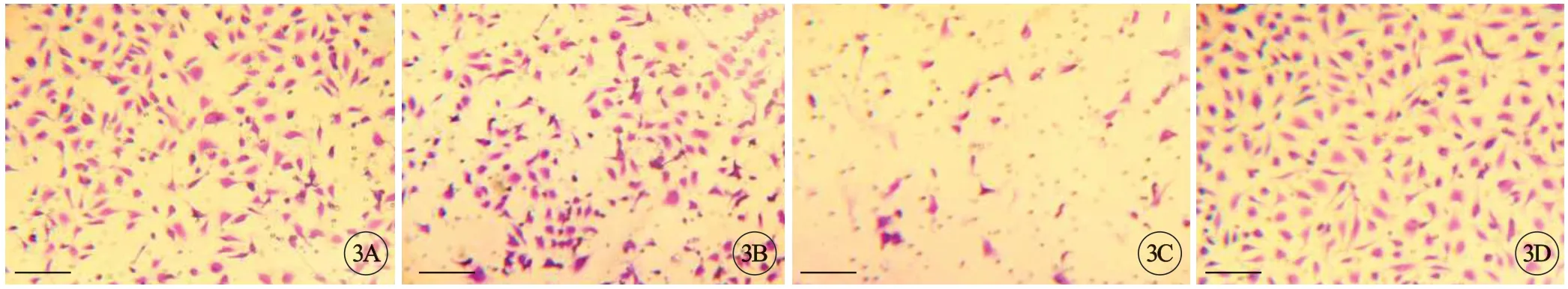
图3 Transwell 迁移实验(结晶紫染色),标尺=20 μm。A:Blank组;B:Lv-NC组;C:Lv-BMP4组;D:Lv-shBMP4组.
3 讨论
乳腺癌是女性最常见的恶性肿瘤,多发于40~60岁绝经前后的妇女[1]。近年来,乳腺癌发病率以每年3%的速度增长,且发病年龄也逐渐趋于年轻化[2-3]。已成为中国女性发病率最高的恶性肿瘤,严重威胁女性的身心健康。鉴于乳腺癌的恶性生物学特性,其最终多会出现局部复发与远处转移。骨转移为乳腺癌最常见的远端转移部位,在发生转移的乳腺癌患者中,占50%~70%[4]。发生乳腺癌骨转移的患者常出现顽固性骨痛、病理性骨折、高钙血症、功能障碍、脊髓压迫等一系列骨相关事件(skeletal related events,SREs),严重影响其生活质量,甚至导致死亡[5]。虽然近年来对乳腺癌的治疗有了显著的进步,但乳腺癌转移尤其是骨转移仍然是乳腺癌治疗的一大难题。目前骨转移的分子机制尚未完全明确,因此,深入研究乳腺癌骨转移的分子机制,进一步阐明其发病机制,寻找有效的治疗靶点显得尤为重要。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中最大的亚家族,由Urist于1965年发现,Wozney等从骨基质中分离出来,被鉴定出具有诱导软骨形成的能力。BMPs 作为分泌型糖蛋白,在胚胎发育和器官形成过程中发挥着重要作用,同时,还通过调节相关基因转录参与多种恶性肿瘤的发生发展[6]。BMP4 是BMPs家族中的成员,与多种癌症的发生发展密切相关。BMP4 在不同类型的癌症中所起的作用不尽相同,具有组织特异性。有文献报道,BMP4 可促进肝癌、黑色素瘤、结直肠癌的生长、转移和侵袭。而在促肾上腺皮质激素瘤中则表达明显降低,起抑癌作用[7]。BMP4 在乳腺癌组织中广泛表达,而其在乳腺癌中的作用也不同。BMP4 可通过阻止骨髓抑制细胞(MDSC)的累积来抑制乳腺癌的转移[8]。而研究报道[9]当miR-191表达量升高时,BMP4 可通过TGF-β 信号通路促进乳腺癌的转移。此外,研究发现[10],BMP4 在抑制乳腺癌细胞生长的同时,在体内外还能诱导上皮间质转化、侵袭和转移。鉴于BMP4 在乳腺癌中作用的双重性,对BMP4 在乳腺癌及其细胞系中进行相关研究,丰富BMP4 在乳腺癌中可能作用机制的理论依据,显得十分必要。我们目前的实验研究旨在探究不同表达水平的BMP4对乳腺癌细胞系生物学行为的影响,为BMP4 在乳腺癌尤其是乳腺癌骨转移的临床研究提供新思路。
血管内皮细胞生长因子(vascular growth factor,VEGF)作为一个强烈的促进血管发生和促进肿瘤生长的因子。在不同种类的肿瘤细胞中通过抑制肿瘤细胞分泌VEGF,均可起到抑制肿瘤生长的作用。而BMP4 介导的信号调节通路可通过减少VEGF的分泌,从而抑制肿瘤的生长。此外,研究显示[11],BMP4 还可通过Smad 信号通路,使MCF-7细胞的细胞周期停滞在G1期,加速癌细胞的凋亡,显著抑制癌细胞的生长、增殖。同时,BMP4 还可通过激活Smad 通路和p38MAPK信号通路促使癌细胞走向过早性衰老。本实验表明通过构建BMP4过表达慢病毒载体,使BMP4基因在MCF-7细胞中过表达,通过与正常MCF-7细胞增殖能力的比较,证实了BMP4对乳腺癌细胞系MCF-7细胞增殖能力的抑制作用,而将BMP4 干扰后,乳腺癌MCF-7细胞的增殖活力明显提高。
乳腺癌骨转移主要以溶骨性转移为主。乳腺癌细胞的侵袭与转移、骨微环境的特殊性以及两者间的相互作用构成了乳腺癌骨转移的主要因素。成骨与破骨细胞通过分泌一些细胞因子如基质金属蛋白酶(MMP)、血管细胞黏附因子1 等,为乳腺癌细胞的侵袭转移提供适宜的微环境,促进乳腺癌细胞的趋化、迁移和黏附,而乳腺癌细胞通过释放VEGF 等因子与骨基质中的受体结合,从而进一步打破成骨与破骨细胞维持的动态平衡,导致骨基质的损害与丢失,促使乳腺癌骨转移的发生。文献报道,BMP4 可通过抑制MMP-9的活性,抑制乳腺癌细胞MCF-7 和MDA-MB-231 细胞的转移潜能[12]。此外,BMP-4 可抑制VEGF-D 驱动转移淋巴结引起血管重塑,从而抑制VEGF-D 可能创建的适宜乳腺癌转移的微环境[13]。BMP4 可能通过抑制乳腺癌细胞以及成骨和破骨细胞分泌的相关细胞因子的活性,进而造成破骨和成骨的平衡紊乱,从而在乳腺癌骨转移发生进程中发挥作用。本实验为了进一步研究BMP4对乳腺癌的影响,通过细胞划痕和Transwell 侵袭实验检测不同表达水平的BMP4对MCF-7细胞迁移和侵袭能力的影响。细胞划痕实验发现24 h时Lv-BMP4 划痕愈合率已有低于对照组Lv-NC组的趋势,而Lv-shBMP4组的划痕愈合率亦有高于Lv-NC组的趋势。在48 h,Lv-BMP4组划痕愈合能力更加显著,而Lv-shBMP4组的划痕愈合能力也明显减小。细胞增殖实验发现,与对照组Lv-NC 相比,Lv-BMP4组中穿过Transwell 基质胶半透膜到达下表面的细胞数量明显降低,而Lv-NC与空白组Blank组没有明显区别;Lv-shBMP4组与对照组相比,MCF-7细胞穿过Transwell 小室的数目显著升高,说明BMP4 可削弱MCF-7细胞的体外侵袭能力。本实验结果表明,过表达BMP4后MCF-7细胞的细胞转移和侵袭能力减弱,将BMP4 干扰后,乳腺癌MCF-7细胞的迁徙和侵袭能力增强。
综上所述,本实验研究结果表明,BMP4过表达及干扰慢病毒载体构建成功,BMP4的表达水平与乳腺癌细胞系MCF-7细胞的增殖、迁移和侵袭能力呈负相关。本次实验仅就BMP4对MCF-7细胞生物学行为的改变进行了初步探讨。乳腺癌骨转移是一个复杂的、多种因素共同调节的过程,对于BMP4在乳腺癌细胞中的具体作用机制还需进行更深入的研究,需从多个通路综合研究BMP4的作用机制。
