蛋白激酶B2慢病毒载体的构建及其沉默效果的验证*
2021-04-28戴研平高晓勤
戴研平 高晓勤
(1 贵州医科大学基础医学院病理学与病理生理学教研室,贵阳 550004;2 遵义医药高等专科学校基础医学院,遵义 563006;3 岳阳市岳阳楼区人民医院,岳阳 414000)
蛋白激酶B(serine/threonine kinase B,AKT)属于丝/苏氨酸激酶,在肿瘤发生中起着重要作用。蛋白激酶B2(AKT2)是AKT家族的重要成员之一,它可以通过PI3K 途径被激活。PI3K/AKT途径能够影响肿瘤的恶性度和预后[1]。RNA 干扰(RNA interference,RNAi)技术能够对靶基因的mRNA 进行高效、特异降解,小干扰RNA 被导入细胞后进而促使靶基因的同源mRNA 被降解,达到高效和特异阻断目的基因的效果[2-4]。附睾功能的异常会影响精子的成熟,导致男性不育。但目前关于基因沉默大鼠附睾组织AKT2 及其与男性生殖系统疾病的研究报道少见。本实验通过大鼠附睾组织AKT2 慢病毒短发夹RNA(short hairpin RNA,shRNA)表达载体的构建和病毒的包装,然后将通过验证的高滴度病毒液干扰正常成年大鼠附睾组织后,免疫印迹检测转染后的效果,为后续研究AKT2 基因在男性生殖系统的具体分子机制提供实验基础。
1 材料和方法
1.1 试剂
PMAGic7.1载体(上海生物工程股份有限公司);Taq酶和dNTP TaKaRa(DR001B);T4 DNA ligase(Fermentas);5×Annealing Buffer for DNA Oligos(碧云天);AgeI-HF(NEB);EcoRI-HF NEB(R3101L);DH5a 感受态细胞;琼脂糖凝胶DNA 回收试剂盒;DL2,000 DNA Marker 均购买于TaKaRa公司;AKT2抗体(Gentex公司)。
引物合成、阳性克隆测序由生工生物工程(上海)股份有限公司合作完成。SPF级的健康清洁级成年雄性SD大鼠50只,由贵州医科大学实验动物中心提供,动物许可证号:SCK(贵州),2018-0001。
1.2 仪器
DNA 电泳槽DYCP-31DN、稳压电泳仪DYY-5(北京六一仪器厂);电热恒温水槽DK-8D(上海一恒科学仪器有限公司);凝胶成像仪Tanon-2500(上海天能科技有限公司);恒温培养箱GNP-9050(上海精宏实验设备有限公司);恒温摇床TH2-C(太仓市实验设备厂);PCR 仪cycler(Applied Biosystems);冷冻高速离心机CL17R(Thermo)。
1.3 AKT2干扰载体的构建
1.3.1 AKT2-shRNA 靶点设计 根据基因库报道的大鼠附睾特异AKT2 基因序列和RNAi靶点序列设计原则,筛选出3个AKT2的干扰靶点,同时设计一个阴性对照,引物合成由上海生物工程有限公司合作完成,DNA 合成片段如下(表1)。
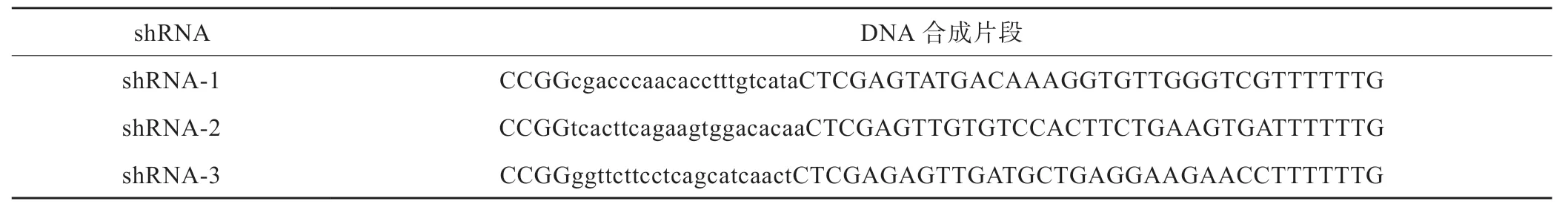
表1 AKT2干扰靶点的DNA 合成片段
1.3.2 引物退火形成带黏性末端的双链 将DNA oligo 分别用TE(pH8.0)溶解,浓度为100 µmol/L。取相应的正义链和反义链oligo溶液,按照如下配比配置退火反应体系:10×PCR Buffer 5 µL,sense strand(100 μmol/L)5 µL,antisense strand(100 µm)5 µL,ddH2O 35 µL,总体积为50 µL。在PCR 仪上按照如下程序进行退火处理:95ºC 5 min;85ºC 5 min;75ºC 5 min;70ºC 5 min;4ºC保存。退火处理后得到浓度为10 μmol/L的shRNA 模板。将所得模板溶液稀释50倍,终浓度为200 nm,用于连接反应。
1.3.3 PMAGic7.1载体的线性化 取10 µg PMAGic7.1载体,按照如下体系进行酶切处理:10×Buffer 15 µL;BpiI(BbsI)3 µL;HindⅢ 3 µL;PMAGic7.1 10 µg;加ddH2O至150 µL;总体积为150 µL。37ºC酶切2 h,琼脂糖电泳,使用SK8132-N回收,电泳检测估算浓度,稀释浓度至50 ng/µL。
1.3.4 PMAGic7.1-shRNA 载体的构建 将慢病毒载体PMAGic7.1的线性化片段与shRNA-AKT-2 退火片段采用T4 DNA 连接酶在Buffer 中连接,按照如下体系进行载体的连接反应:10×T4 Ligation Buffer 2 µL;PMAGic7.1 1 µL;shDNA template(100 nmol/L)1 µL;T4 DNA ligase(5 weiss U/µL)1 µL;ddH2O 15 µL;总体积为20 µL,于22℃连接过夜,连接后的产物进行转化试验。
1.3.5 转化 取1支感受态细胞(每管100 µL,-80℃保存)于冰上放置4 min,待溶解后加入10µL连接液,轻轻旋转以混匀内容物,在冰中放置30 min。将管放到预加温到42℃的恒温水浴锅中热激90 s。快速将管转移到冰浴中,使细胞冷却2~3 min。每管加900 µL LB培养液,然后将管转移到37℃摇床上,温育1 h 使细菌复苏。取200µL的转化菌液涂布于LB 琼脂平板上(含50 µg/mL Kanamycin)(含表达载体相应的抗生素)。倒置平皿,于恒温培养箱中37℃培养16 h。
1.3.6 阳性克隆鉴定与测序 从每块平板上挑取5个菌落,接种到含50 µg/mL Kanamycin的LB培养基中,37℃培养16 h,从平板生长的转化子中取1 µL进行菌落PCR 鉴定。Primer(+):HU6-F2 TACGATACAAGGCTGTTAGAGAG;Primer(-):PM-R CTATTAATAACTAATGCATGGC。阳性克隆得到350 bp条带,阴性克隆(空载体自连)得到300 bp条带。PCR 反应体系的配制如下:Rnasefree water 13.7 µL;10×Buffer(with Mg2+)2.0µL;dNTP 各2.5 mm 1.6 µL;Primer ID(+)(10µm)0.8 µL;Primer ID(-)(10 µm)0.8 µL;Template 1.0 µL;Taq酶0.1 µL;总体积为20 µL。PCR 反应条件如下:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,72℃ 5 min,10℃ 10 min,30个循环。使用天根质粒小提试剂盒(康为世纪公司)的操作方法进行质粒的抽提,所得质粒用于测序。PCR阳性克隆测序由上海生物工程有限公司合作完成,然后进行阳性克隆测序结果分析。
1.3.7 慢病毒的包装与滴度测定 首先制备编码慢病毒颗粒的重组病毒质粒及混合包装质粒载体,将4种质粒载体分别进行高纯度无内毒素抽提,按照Invitrogen的Lipofectamine 2000的使用说明进行HEK293T细胞转染,转染后 8 h 更换为完全培养基,培养48 h,收集慢病毒颗粒的细胞上清液,对其浓缩得到的高滴度的慢病毒浓缩液,最后在HER293T细胞中根据病毒的预期滴度,对其进行倍比稀释,测定和标定病毒滴度。
1.4 慢病毒载体感染大鼠附睾组织
雄性SD大鼠50只用水合氯醛麻醉后,常规消毒铺手术巾单,暴露双侧大鼠附睾处皮肤,仔细解剖暴露附睾,空白对照组不注射慢病毒,NCshRNA阴性感染和3个干扰组(PL-AKT2-shRNA-1感染组、PL-AKT2-shRNA-2 感染组、PL-AKT2-shRNA-3感染组)大鼠附睾分别被注射200 μL 含有NC-shRNA、PL-AKT2-shRNA-1、PL-AKT2-shRNA-2、PL-AKT2-shRNA-3的病毒液。每组随机选取5只大鼠进行处理,并在无菌动物房饲养14 d。14 d后麻醉大鼠,无菌剥离双侧附睾组织进行后续相关实验。
1.5 免疫印迹实验
提取附睾组织总蛋白,蛋白质上样量为(20 μg /样本),浓缩胶浓度为5 %,电泳时间为2.5 h。制作SDS-PAGE 凝胶用于分离,PVDF 膜转移条件为70 min 200 mA,将膜完全浸没于5 %的脱脂奶粉(37℃ 2 h)。孵育一抗AKT2 抗体(1:1 000 稀释)4℃过夜。第2天拿出膜,TBST洗膜。37℃孵育HRP 标记的山羊抗兔IgG 2 h,TBST 冲洗膜。根据ECL 化学发光试剂盒说明书进行显影定影。采用凝胶图像分析系统(NIH)进行分析。
2 结果
2.1 PL-AKT2-shRNA重组质粒的DNA测序结果
PL-AKT2-shRNA-1:ATGACTGTAAACAA AGATATTAGTACAAAATACGTGACGTAGAAA GTAATAATTTCTTGGGTAGTTTGCAGTTTTAA AATTATGTTTTAAAATGGACTATCATATGCTTA CCGTAACTTGAAAGTATTTCGATTTCTTGGCT TTATATATCTTGTGGAAAGGACGAAACACCG GCGACCCAACACCTTTGTCATACTCGAGTAT GACAAAGGTGTTGGGTCGTTTTTTGAATTCG GATCCATTAGGCGGCCGCGTGGATAACCGTA TTACCGCCATGCATTAGTTATTAATAGTAATC AATTACGGGGTCATTAGTTCATAGCCCATATA TGGAGTTCCGCGTTACATAACTTACGGTAAAT GGCCCGCCTGGCTGACCGCCCAACGACCCC CGCCCATTGACGTCAATAATGACGTATGTTCC CATAGTAACGCCAATAGGGACTTTCCATTGA CGTCAATGGGTGGAGTATTTACGGTAAACTG CCCACTTGGCAGTACATCAAGTGTATCATATG CCAAGTACGCCCCCTATTGACGTCAATGACG GTAAATGGCCCGCCTGGCATTATGCCCAGTAC ATGACCTTATGGGACTTTCCTACTTGGCAGTA CATCTACGTATTAGTCATCGCTATTACCATGGT GATGCGGTTTTGGCAGTACATCAATGGGCGT GGATAGCGGTTTGACTCACGGGGATTTCCAA GTCTCCACCCCATTGACGTCAATGGGAGTTT GTTTTGGCACCAAAATCAACGGGACTTTCCA AAATGTCGTAACAACTCCGCCCCATTGACGC AAATGGGCGGTAGGCGTGTACGGTGGGAGG TCTATATAAGCAGAGCTGGTTTAGTGAACCG TCAGATCCGCTAGCGCTACCGGACGCCACCA TGGTGAGCAAGGGCGAGGAGCTG
PL-AKT2-shRNA-2:GACTGTAACACAAA GATATTAGTACAAAATACGTGACGTAGAAAGT AATAATTTCTTGGGTAGTTTGCAGTTTTAAAA TTATGTTTTAAAATGGACTATCATATGCTTACC GTAACTTGAAAGTATTTCGATTTCTTGGCTTT ATATATCTTGTGGAAAGGACGAAACACCGGTC ACTTCAGAAGTGGACACAACTCGAGTTGTGT CCACTTCTGAAGTGATTTTTTGAATTCGGATC CATTAGGCGGCCGCGTGGATAACCGTATTACC GCCATGCATTAGTTATTAATAGTAATCAATTAC GGGGTCATTAGTTCATAGCCCATATATGGAGTT CCGCGTTACATAACTTACGGTAAATGGCCCGC CTGGCTGACCGCCCAACGACCCCCGCCCATTG ACGTCAATAATGACGTATGTTCCCATAGTAAC GCCAATAGGGACTTTCCATTGACGTCAATGGG TGGAGTATTTACGGTAAACTGCCCACTTGGCA GTACATCAAGTGTATCATATGCCAAGTACGCC CCCTATTGACGTCAATGACGGTAAATGGCCCG CCTGGCATTATGCCCAGTACATGACCTTATGGG ACTTTCCTACTTGGCAGTACATCTACGTATTAG TCATCGCTATTACCATGGTGATGCGGTTTTGGC AGTACATCAATGGGCGTGGATAGCGGTTTGAC TCACGGGGATTTCCAAGTCTCCACCCCATTGA CGTCAATGGGAGTTTGTTTTGGCACCAAAATC AACGGGACTTTCCAAAATGTCGTAACAACTCC GCCCCATTGACGCAAATGGGCGGTAGGCGTGT ACGGTGGGAGGTCTATATAAGCAGAGCTGGTT TAGTGAACCGTCAGATCCGCTAGCGCTACCGG ACGCCACCATGGTGAGCAAGGGCGAGGAGCT
PL-AKT2-shRNA-3:ATTTGACTGTAACAC AAAGATATTAGTACAAAATACGTGACGTAGA AAGTAATAATTTCTTGGGTAGTTTGCAGTTTT AAAATTATGTTTTAAAATGGACTATCATATGCT TACCGTAACTTGAAAGTATTTCGATTTCTTGG CTTTATATATCTTGTGGAAAGGACGAAACACC GGGGTTCTTCCTCAGCATCAACTCTCGAGAGT TGATGCTGAGGAAGAACCTTTTTTGAATTCGG ATCCATTAGGCGGCCGCGTGGATAACCGTATT ACCGCCATGCATTAGTTATTAATAGTAATCAAT TACGGGGTCATTAGTTCATAGCCCATATATGGA GTTCCGCGTTACATAACTTACGGTAAATGGCC CGCCTGGCTGACCGCCCAACGACCCCCGCCC ATTGACGTCAATAATGACGTATGTTCCCATAGT AACGCCAATAGGGACTTTCCATTGACGTCAAT GGGTGGAGTATTTACGGTAAACTGCCCACTTG GCAGTACATCAAGTGTATCATATGCCAAGTAC GCCCCCTATTGACGTCAATGACGGTAAATGGC CCGCCTGGCATTATGCCCAGTACATGACCTTA TGGGACTTTCCTACTTGGCAGTACATCTACGTA TTAGTCATCGCTATTACCATGGTGATGCGGTTT TGGCAGTACATCAATGGGCGTGGATAGCGGTT TGACTCACGGGGATTTCCAAGTCTCCACCCCA TTGACGTCAATGGGAGTTTGTTTTGGCACCAA AATCAACGGGACTTTCCAAAATGTCGTAACAA CTCCGCCCCATTGACGCAAATGGGCGGTAGGC GTGTACGGTGGGAGGTCTATATAAGCAGAGCT GGTTTAGTGAACCGTCAGATCCGCTAGCGCTA CCGGACGCCACCATGGTGAGCAAGGGCGAGG AGCTGTTCACCGGGGTG
将PCR阳性克隆质粒进行DNA测序,结果与预期序列一致,证明DNA重组成功,测序结果表明阳性克隆序列正确。
2.2 免疫印迹检测AKT2蛋白表达
各组大鼠附睾组织凝胶电泳结果显示(图1),重组慢病毒颗粒感染高龄大鼠附睾组织后,NCshRNA阴性感染组(1.12±0.23)的AKT2蛋白表达水平与对照组(1.18±0.10)比较差异无统计学意义(P>0.05),PL-AKT2-sh-RNA-1,2,3感染组(0.76±0.21,0.43±0.08,0.23±0.06)AKT2的蛋白表达水平均低于正常对照组及NC-shRNA阴性感染组(P<0.05)。

图1 PL-AKT2-shRNA 感染大鼠附睾组织对AKT2蛋白表达的影响
3 讨论
研究证明,AKT2 在信号转导通路中起着重要作用。AKT2与许多肿瘤的恶性度密切相关[5],目前已经成为肿瘤领域基因治疗的重要靶点之一[6]。
RNA 干扰技术已经在基因的功能分析、信号通路的转导以及基因治疗中被广泛应用。然而,质粒介导的RNAi 有很大的局限性,如在体内实验方面,转染效率太低,基因沉默效果差,维持时间短,而慢病毒载体稳定性强,RNAi的作用效果更持久[7-10]。RNA 干扰技术作为肿瘤基因治疗的新途径,具有稳定性和较高的特异性[11]。短发夹状RNA为通过使用慢病毒载体或质粒表达的siRNA。其中,慢病毒为载体的RNAi表达结构经过转染细胞进而整合到基因组,使得靶基因被稳定沉默[12-15]。RNAi的发现、发展已经成为国内外研究的热点,作为一种新兴的基因阻断技术,已经被广泛应用于基因功能、基因治疗等方面[16]。
本实验PCR阳性克隆质粒DNA测序,结果与预期序列一致,证明DNA重组成功,即成功构建了PL-AKT2-shRNA重组表达质粒。免疫印迹检测结果显示,与对照组比较,NC-shRNA阴性感染组的AKT2蛋白表达水平无明显差异,AKT2-shRNA-1,2,3感染组的蛋白表达水平均低于正常对照组及NC-shRNA阴性感染组,说明本实验设计包装的3种慢病毒载体均能明显抑制大鼠附睾组织中AKT2 基因的表达,其中以PL-AKT2-shRNA-3组干扰效果最明显。
总之,本研究成功建立了3种AKT2 基因的RNA 干扰靶点的慢病毒载体,通过阳性克隆质粒测序和免疫印迹方法证实AKT2 基因的沉默效果明显,为下一步研究AKT2 基因为靶点的RNAi 技术治疗男性不育奠定了实验基础。
