保和丸对溃疡性结肠炎模型小鼠肠道益生菌A.muciniphila 菌变化及肠黏膜屏障的影响
2021-04-27游丰锋杨光勇涂小华何亚敏喻良锦李雨彤田维毅何光志
游丰锋 杨光勇 涂小华 何亚敏 喻良锦 李雨彤 李 灿 田维毅 何光志
溃疡性结肠炎(ulcerative colitis,UC)多累及远端结肠,亦可遍及全部结肠[1]。肠黏膜屏障损伤及由此造成的肠壁通透性增高是UC 发病的始动因素和病情进展的核心环节[2],肠道微生物群—宿主之间的相互作用被破坏等因素与UC 发生发展密切相关[3-5]。肠道益生菌是组成肠道黏膜屏障的重要部分,而肠道菌群失调与免疫功能异常则直接影响UC 的演变[6]。丙酸为嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila,A.muciniphila)代谢产物之一,具有免疫调节作用,并能将黏蛋白进行分解和再促合成,从而维持肠道黏膜屏障稳定。本研究通过肠杆菌基因间重复共有序列(ERIC)-聚合酶链式反应(PCR)和半定量PCR 技术分析保和丸对UC 模型小鼠肠道菌群多样性和A.muciniphila 菌的含量变化,并通过观察肠道组织病理切片从形态学改变分析肠黏膜屏障损伤和炎症预后及转归。
1 实验材料
1.1 动物 SPF 级6 周龄KM 小鼠40 只,雌雄各半,体质量(20±2)g,购自长沙市天勤生物技术有限公司,动物使用许可证号:SCXK(湘)2019-0014。小鼠以小组单笼喂养,自由进食和饮水,环境:湿度60%、温度25°C、12h/12h 的光照/黑暗周期。所有实验操作符合3R 原则(减少、替代、优化)给予人道关怀。本研究通过贵州中医药大学伦理委员会审核。
1.2 试剂与药品 右旋葡聚糖硫酸钠(dextran sulphate sodium,DSS,Sigma-Aldrich 公司,批号H02J9 B62777);保和丸(北京同仁堂,批号18081639);美沙拉嗪(莎尔福公司,注册证号H20171358,批号17G27518L);粪便基因组DNA 提取试剂盒[天根生化科技(北京)有限公司,批号S8114];快捷型琼脂糖DNA 回收试剂盒Ⅱ型(北京百泰克生物公司,批号20170214);2×Taq PCR MasterMix(批号R6801)。
2 实验方法
2.1 药物制备及给药 参考徐叔云教授主编的《药理实验方法学》[7],按体表面积计算剂量,配制成浓度为6.5mg/mL 的美沙拉嗪药液,按0.1mL/10g 鼠重给药体积灌胃给药,每次0.2mL,1 天3 次;制备保和丸水溶剂,配制成浓度为78mg/mL 药液,按0.1mL/10g鼠重灌胃给药体积,每次0.2mL,1 天2 次。取0.3g DSS 溶于少量蒸馏水后再稀释至10mL,即为3%DSS 溶液。
2.2 分组及UC 模型制备 40 只小鼠按随机数字表法分为空白对照组、模型组、美沙拉嗪组(0.065g/kg,3 次/天)和保和丸组(0.78g/kg,2 次/天),每组10 只。空白对照组给予蒸馏水,参考文献[8-10]诱发小鼠UC 模型方法,用DSS 诱导制备UC 小鼠模型,除空白对照组外,其余各组采用灌胃3% DSS 溶液连续7天,诱导UC 模型,第8 天开始全部换成蒸馏水。造模成功后第1 天开始灌胃给药,空白对照组与模型组给予等体积的蒸馏水,其余各组按上述剂量给予相应的药物,连续给药7 天。
2.3 小鼠疾病活动指数(disease activity index,DAI)评分 自造模之日起,每天观察并记录小鼠精神状态、进食、饮水和活动度等一般情况,定时称量小鼠体质量,观察粪便情况及便血状态,参照文献[11]进行DAI 评分。评分依据为黏着在肛门的水样便为稀便,不黏着于肛门的糊状大便为半稀便,成型的粪便为正常便。计算方法为DAI=(体质量+大便性状分数+隐血分数)/3。
2.4 引物设计与合成 根据前期研究[12],设计引物序列:ERIC-1:5'-ATGTAAGCTCCTGGGGATTCAC-3',ERIC-2:5'-AAGTAAGTGACTGGGGTGAGCG-3';根据秦倩倩等[13]报道,合成A.muciniphila 细菌基因特异性引物,上游引物:5'-CAGCACGTGAAGGTGGGGAC-3',下游引物:5'-CCTTGCGGTTGGCTTCAGAT-3',基因全长:329bp;由上海生工生物工程有限公司合成。
2.5 各组粪便样品基因组模板制备 DNA 实验第18 天,收集小鼠新鲜粪便样本,按粪便基因组DNA试剂盒说明书严格进行操作,提取基因组DNA,用核酸浓度检测仪测定提取的DNA 模板的纯度及浓度,确保DNA 纯度A260/A280nm 比值在1.6~1.8,浓度在200ng/μL 左右,均置于-20℃保存备用。
2.6 ERIC-PCR 反应体系为:DNA 模板2μL,10μmol/L 上、下游引物各0.5μL,2×Taq PCR Master-Mix[0.1U Taq Polymerase/μL,500μmol dNTP each,20mmol Tris-HCl(pH 值为8.3),100mmol KCl,3mmol MgCl2]12.5μL,ddH2O 补足至25μL。反应条件为:95℃预变性7min;95℃变性30s,46℃退火90s,72℃延伸3min,共35 个循环;72℃延伸5min。
2.7 A.muciniphila 菌半定量PCR 反应体系 反应采用20μL 体系:模板2μL,10μmoL/L 上下游引物各0.3μL,2×Taq PCR MasterMix 10μL,去离子水补充体系至20μL。PCR 反应条件:95℃预变性10min;95℃变性30s,60℃退火40s,72℃延伸30s,39 个循环,65℃延伸10min。
2.8 条带克隆测序与序列分析 选取A.muciniphila菌半定量PCR 产物目的条带,按琼脂糖凝胶DNA回收试剂盒说明书回收DNA。收集菌体送上海生工生物有限公司测序,将测序结果与GenBank 中已登录的细菌DNA 序列用BLAST 软件进行比对分析。
2.9 结肠组织病理学检测 实验第18 天摘取结肠组织,挑选有溃疡的结肠组织置于10%甲醛溶液中放置24h 以上,将组织修正大小为1.0cm×1.0cm×0.2cm,放入包埋盒冲洗12h,沥干水后,分别置于100、95、90、85、80、70%乙醇1h;二甲苯1、二甲苯2,各30min;置于左右蜡缸各1h,冰冻后置于切片机,组织切到5μm 厚,进行展片、铺片,将装有结肠组织的载玻片放入烘干箱12h,按照切片盒步骤依次对结肠组织进行HE 染色,观察切片结果。
2.10 统计学方法 应用SPSS 22.0 统计软件,计量资料以均数±标准差()表示,采用单因素方差分析比较,P<0.05 为差异有统计学意义。
3 实验结果
3.1 各组小鼠DAI 评分比较 造模成功后模型组、美沙拉嗪组及保和丸组小鼠均出现精神呆滞、行动缓慢、便血、体质量下降,而空白对照组小鼠精神、活动度、饮食、毛发、大便、体质量等一般情况均为正常。药物干预前,各实验组小鼠DAI 评分显著高于空白对照组(P均<0.01);药物干预后,美沙拉嗪组及保和丸组小鼠DAI 评分显著低于本组干预前(P均<0.01)和同期模型组(P<0.05),美沙拉嗪组与保和丸组比较,差异无统计学意义(P>0.05),见表1。
3.2 ERIC-PCR 检测肠道菌群的多样性 与空白对照组比较,模型组条带数量未明显减少,说明肠道菌群的多样性无明显变化,但条带位置变化较明显,说明菌群紊乱,肠道菌群丰度减少。保和丸组与美沙拉嗪组条带数量明显减少,提示菌群基因组DNA 含量明显减少,肠道菌群多样性抑制。见图1。
3.3 半定量PCR 检测A.muciniphila 菌 与空白对照组比较,模型组条带稍明显,提示A.muciniphila 菌群丰度有所升高,美沙拉嗪组稍暗,提示菌群丰度有所降低,保和丸组亮度明显升高,提示菌群丰度明显升高。见图2。
表1 各组小鼠DAI 评分比较(分,)

表1 各组小鼠DAI 评分比较(分,)
注:空白对照组为正常小鼠给予生理盐水;模型组为UC 模型小鼠给予生理盐水;美沙拉嗪组为UC 模型小鼠给予0.065mg/kg,3 次/天美沙拉嗪混悬液;保和丸组为UC 模型小鼠给予0.78mg/kg,2 次/天保和丸混悬液;DAI 为疾病活动指数;UC 为溃疡性结肠炎;与空白对照组同期比较,aP<0.01;与本组干预前比较,bP<0.01,与模型组同期比较,cP<0.05;与本组干预后3 天比较,dP<0.01

图1 ERIC-PCR 扩增结果

图2 A.muciniphila 菌半定量PCR 结果
3.4 条带克隆测序与序列分析 克隆测序结果显示,与GenBank 中已登录的细菌DNA 序列(NR_042817.1)用BLAST 软件进行比对分析结果一致,属于Akkermansia muciniphila ATCC BAA-835 strain Muc 16S ribosomal RNA,partial sequence,基因全长329bp。见图3。
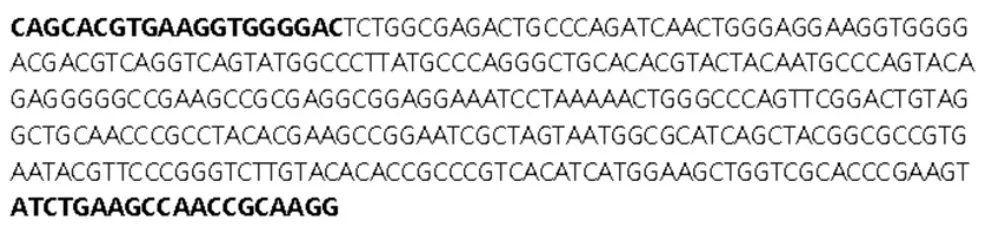
图3 目的基因片段测序核酸碱基序列
3.5 各组小鼠结肠组织病理改变 空白对照组小鼠结肠组织基本未见炎性细胞浸润的现象,黏膜层肌层完好,未见溃疡形成,隐窝和腺体等组织结构完整,排列规则(见图4A);模型组小鼠病理组织切片显示,膜层肌层变薄,见明显溃疡形成,组织结构被破坏,大量炎性细胞浸润(见图4B);与模型组比较,药物干预后,美沙拉嗪组(见图4C)和保和丸组(见图4D)小鼠结肠组织黏膜损伤恢复较好,炎性细胞数量和浸润深度减少。

图4 各组小鼠结肠组织病理改变(HE ×200)
4 讨论
研究显示,用3% DSS 溶液灌胃造模的小鼠肠道内优势菌属减少,而大肠杆菌、肠球菌和小梭菌菌群等条件致病菌数量显著增加[14],即UC 小鼠肠道菌群正常结构失衡,导致机体肠道的炎症产生。本研究小鼠DAI 评分结果显示,用3% DSS 溶液给小鼠连续灌胃7 天可以有效的导致UC 的产生。美沙拉嗪组及保和丸组在治疗3、7 天后均有所改善且小鼠各项身体指标恢复情况相似,模型组虽未治疗,但小鼠也有一定的自愈。造模后的小鼠与空白对照组相比,肠道菌群分布及多样性都有明显改变,每只小鼠个体略有差异但每组总体变化相同,其中服用保和丸与服用美沙拉嗪对肠道菌群结构多样性均可产生一定的影响。
A.muciniphila 菌在肠道的外黏液层中定植,其分解黏蛋白并刺激杯状细胞合成黏蛋白达到动态平衡,从而维持黏液层的稳定[13]。相关研究表明,在治疗难治性慢性活动性UC 时,含有高丰富度的A.muciniphila 粪便样本似乎有利于进行粪便菌群移植疗法[15]。本研究克隆测序结果显示,目的基因检测正确,结合半定量PCR 结果可以看出,保和丸组A.muciniphila 菌群丰度明显升高,提示保和丸对DSS诱导的UC 模型小鼠肠道A.muciniphila 菌有明显促进增殖的作用。
药理研究表明,保和丸主要有助消化、调节肠胃功能、抗溃疡和抑菌的作用[16],能促进双歧杆菌目菌群数量[17],还可促进梭菌目、脱硫弧菌目、产氢细菌目菌群数量,同时减少红蝽菌目、拟杆菌目、芽孢肝菌目、乳杆菌目、丹毒丝菌目、伯克氏菌目、气单胞菌目、疣微菌目菌群数量[18]。说明保和丸有一定选择性抑菌作用,但其对UC 菌群紊乱的调节作用机制尚不明确。
肠道菌群参与固有免疫和适应性免疫,黏膜上皮组织的屏障作用是黏膜局部固有免疫的重要机制,如肠上皮细胞损伤可致使肠道内大量抗原与肠道免疫细胞接触并使之激活,产生大量炎性因子,造成肠道组织损伤[19]。从本研究各组小鼠结肠组织病理改变可以看出,除空白对照组外,其他组小鼠结肠组织都有溃疡,且肠黏膜损伤程度不同。与模型组相比,保和丸组与美沙拉嗪组小鼠结肠黏膜损伤恢复较好,炎性细胞数量和浸润深度减少。提示保和丸与美沙拉嗪能修复DSS 诱导的肠道黏膜损伤,控制炎症的发生发展,保护肠道。总之,本研究结果显示,保和丸具有一定的促进肠黏膜屏障损伤修复的作用。
