丹参素经PI3K/Akt 信号通路改善血管性痴呆模型小鼠认知功能的机制研究
2021-04-27祁敏芳吴慧娟童军卫蒋永泼钱玲珠杨卫星徐挺立
祁敏芳 吴慧娟 童军卫 蒋永泼 钱玲珠 杨卫星 徐挺立
血管性痴呆是脑内长期缺氧和低灌注引起的严重认知功能障碍综合征[1]。脑血管疾病(如缺血性卒中、出血性卒中、脑缺血缺氧)是血管性痴呆的主要临床病因[2]。磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路对细胞生长和存活等许多方面至关重要,其异常表达会导致多种生长因子和调节因子含量发生改变[3]。丹参素是丹参水溶性成分中的主要药效成分之一,具有改善循环、增强免疫及抗氧化等作用[4]。丹参素对血管性痴呆认知功能障碍的治疗效果目前还不清楚。本研究通过制备血管性痴呆小鼠模型,探讨丹参素对其作用机制,报道如下。
1 材料与方法
1.1 实验动物 60 只SPF 级昆明种小鼠,雌雄各半,体质量20~25g,购自重庆医科大学实验动物中心,动物生产许可证号:SCXK(渝)2019-0002,动物使用许可证号:SYXK(渝)2019-0029,动物质量合格证号:002008134。均饲养于清洁级动物房内(室温:20~25℃,相对湿度:50%~70%),动物自由取食、饮水,自动控制光照/黑暗交替(12h/12h)。本研究通过本院伦理委员会审查,符合动物伦理学标准要求。
1.2 药物 尼莫地平注射液(济川药业集团有限公司,规格:50mL:10mg,批号20191013);丹参素(原料药,纯度:99.99%,南京建成生物工程研究所,批号HT0611)。丹参素溶于生理盐水配制成浓度为1、2、3mg/mL 的溶液。
1.3 主要试剂与仪器 星形胶质源性蛋白(S-100β)酶联免疫吸附(ELISA)检测试剂盒、神经元特异性烯醇化酶(NSE)ELISA 检测试剂盒(上海酶联生物科技有限公司,批号057458、094355);RIPA 裂解缓冲液(西安赫特生物科技有限公司,批号WB118);硝化纤维素膜(上海玉博生物科技有限公司,批号P88025);兔源PI3K、Akt 一抗(武汉博欧特生物科技有限公司,批号orb137259、orb197041);3-磷酸甘油醛脱氢酶(GAPDH)单克隆抗体、羊抗鼠二抗(艾美捷科技有限公司,批号MG04-05、MG01-02);Thermo ScientificTMMultiskanTMGO 型酶标仪(美国Thermofisher 公司);BX53 型显微镜(日本奥林巴斯公司);LAS4000 型凝胶成像系统(美国GE Healthcare公司)。
1.4 动物建模、分组及给药 将60 只小鼠采用随机数字表法分为正常对照组、模型组、阳性对照组(尼莫地平注射液,2mg/kg)[5]、丹参素低(10mg/kg)、中(20mg/kg)、高(30mg/kg)剂量组[6],每组10 只。其中正常对照组不做任何处理,其余各组小鼠在禁食、禁水12h 后,3%水合氯醛麻醉,夹闭双侧颈总动脉20min后再灌注10min,重复2 次,构建血管性痴呆小鼠模型[7]。建模成功后,从第1 天开始丹参素各剂量组和阳性对照组腹腔注射相应的药物,注射体积均为10mL/kg,正常对照组和模型组腹腔注射等体积(10mL/kg)生理盐水,每天1 次,持续28 天。
1.5 水迷宫实验 构建Morris 水迷宫,泳池上方放置一个和电脑相连接的摄像头,进行观察。给药28天后,对各组小鼠进行5 天的水迷宫训练,然后进行定位航行测试:将一个平台放在水池的中央,将小鼠放入水池中,观察其能否在60s 内到达平台上,到达后停留30s,若未能到达,则将其强行放在平台30s,记录小鼠逃避潜伏期平均值(逃避潜伏期:从将小鼠放到水池中到爬上平台的时间)[8]。
1.6 脑损伤相关因子检测 给药结束后,小鼠眼球取血,2000rpm 离心15min,取上清于1.5mL EP 管中,用ELISA 试剂盒检测与脑损伤相关标志物S-100β、NSE 含量。
1.7 小鼠脑组织病理观察 脱颈处死小鼠,取脑组织,纵向分成两份,其中一份在4%甲醛溶液中固定48h,进行石蜡包埋、切片,厚度5μm,制作苏木精-伊红(HE)染色切片,镜下观察各组小鼠脑组织结构。
1.8 小鼠脑组织PI3K、Akt 蛋白水平检测 新鲜分离的小鼠脑组织用PBS 缓冲液洗净,采用RIPA 裂解缓冲液裂解蛋白,离心提取蛋白溶液。经聚丙烯酰胺凝胶电泳分离后,蛋白转移到硝化纤维素膜上,将膜放在5%脱脂奶粉溶液中封闭2h,然后用PI3K、Akt、GAPDH 一抗在4℃条件下孵育过夜,1%吐温20溶液清洗3 次,每次10min,加入羊抗鼠二抗孵育2h,然后在凝胶成像系统上显影。GAPDH 为内参蛋白。
1.9 统计学方法 应用SPSS 23.0 统计软件进行数据录入和分析,计量资料采用均数±标准差()表示,采用单因素方差分析比较,多重比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠水迷宫逃避潜伏期比较 与正常对照组比较,模型组小鼠逃避潜伏期显著增加[(46.36±3.12)s 比(15.25±1.23)s,P<0.05];与模型组比较,丹参素低、中、高剂量组和阳性对照组小鼠逃避潜伏期显著降低[(40.78±3.54)s、(34.65±3.13)s、(26.31±2.01)s、(25.23±1.75)s 比(46.36±3.12)s,P均<0.05],随着丹参素给药剂量的增加,小鼠逃避潜伏期呈明显下降趋势,具有量-效关系(P<0.05);丹参素高剂量组与阳性对照组比较,差异无统计学意义(P>0.05)。
2.2 各组小鼠血清脑损伤相关因子S-100β、NSE 水平比较 与正常对照组比较,模型组小鼠血清脑损伤相关因子S-100β、NSE 水平显著升高(P均<0.05);与模型组比较,丹参素低、中、高剂量组和阳性对照组小鼠血清S-100β、NSE 水平显著降低(P均<0.05),随着丹参素给药剂量的增加,小鼠血清S-100β、NSE 水平逐渐降低,具有量-效关系(P<0.05);丹参素高剂量组与阳性对照组比较,差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠血清脑损伤相关因子S-100β、NSE 水平比较(ng/L,)
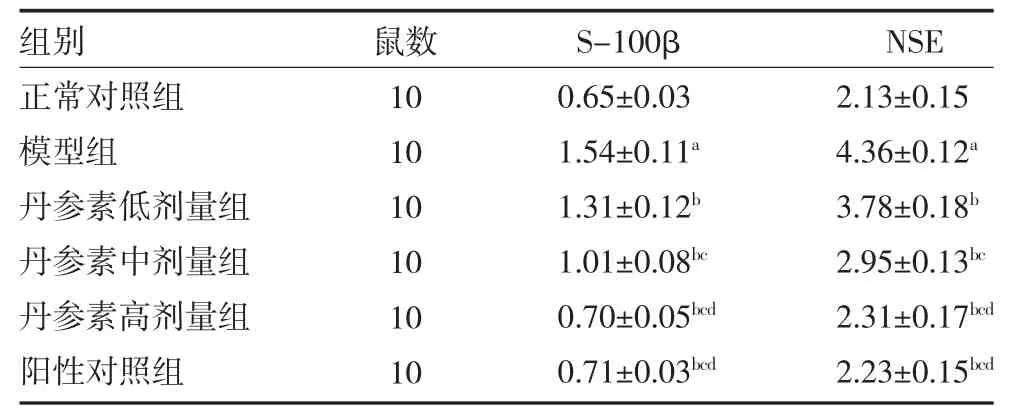
表1 各组小鼠血清脑损伤相关因子S-100β、NSE 水平比较(ng/L,)
注:正常对照组腹腔注射10mL/kg 生理盐水;模型组腹腔注射10mL/kg生理盐水;阳性对照组腹腔注射2mg/kg 尼莫地平注射液;丹参素低剂量组腹腔注射10mg/kg 丹参素;丹参素中剂量组腹腔注射20mg/kg丹参素;丹参素高剂量组腹腔注射30mg/kg 丹参素;S-100β 为星形胶质源性蛋白;NSE 为神经元特异性烯醇化酶;与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与丹参素低剂量组比较,cP<0.05;与丹参素中剂量组比较,dP<0.05

图1 各组小鼠脑组织病理观察(HE×100)
2.3 各组小鼠脑组织病理观察 HE 染色结果显示,正常对照组小鼠脑组织结构正常,细胞排列整齐,无明显空泡结构;模型组可见明显的脑白质受损,细胞排列紊乱,视野中大量空泡结构;在给予丹参素干预后,随着丹参素给药剂量的增加,可见脑组织细胞排列逐渐变整齐,空泡结构逐渐减少;其中丹参素高剂量组与阳性对照组HE 染色结果基本一致。见图1。
2.4 各组小鼠脑组织PI3K、Akt 蛋白表达水平比较与正常对照组比较,模型组小鼠脑组织PI3K、Akt蛋白表达水平显著降低(P均<0.05);与模型组比较,丹参素低、中、高剂量组和阳性对照组小鼠脑组织PI3K、Akt 蛋白表达水平显著升高(P<0.05),随着丹参素给药剂量的增加,小鼠脑组织PI3K、Akt 蛋白表达水平逐渐升高,具有量-效关系(P均<0.05);丹参素高剂量组小鼠脑组织中PI3K、Akt 蛋白表达水平与阳性对照组比较,差异无统计学意义(P>0.05)。见表2 和图2。
3 讨论
血管性痴呆为老年人的常见病,是一种与年龄相关的认知障碍。我们认为影响认知能力的关键因素是脑白质损伤、中枢神经系统炎症、长期缺氧和低灌注引起的氧化应激和神经元凋亡,这也是发生血管性痴呆的主要原因[9]。
PI3K/Akt 信号通路是抑制细胞凋亡的关键信号转导通路[10]。由于外界刺激激活PI3K,磷脂酰肌醇磷酸化产生第二信使:肌醇,在肌醇的控制下,Akt 从细胞质转移到细胞膜,并被Akt 蛋白苏氨酸位点磷酸化[11-12]。本研究发现,与正常对照组比较,模型组小鼠脑组织PI3K、Akt 蛋白表达水平显著降低;与模型组比较,随着丹参素给药剂量的增加,小鼠脑组织PI3K、Akt 蛋白表达水平逐渐升高,具有量-效关系。病理结果显示,正常对照组小鼠脑组织结构正常,细胞排列整齐,无明显空泡结构;模型组可见明显的脑白质受损,细胞排列紊乱,视野中大量空泡结构。在给予丹参素干预后,随着丹参素给药剂量的增加,可见脑组织细胞排列逐渐变整齐,空泡结构逐渐减少。因此,结合蛋白免疫印迹与病理结果可以发现,小鼠脑组织PI3K、Akt 蛋白表达水平与血管性痴呆的恢复程度呈正相关关系,其表达量直接影响血管性痴呆的恢复情况。提示丹参素可能促进小鼠脑组织PI3K、Akt 蛋白的表达,从而缓解疾病的发生发展。
表2 各组小鼠脑组织PI3K、Akt 蛋白表达水平比较()

表2 各组小鼠脑组织PI3K、Akt 蛋白表达水平比较()
注:正常对照组腹腔注射10mL/kg 生理盐水;模型组腹腔注射10mL/kg生理盐水;阳性对照组腹腔注射2mg/kg 尼莫地平注射液;丹参素低剂量组腹腔注射10mg/kg 丹参素;丹参素中剂量组腹腔注射20mg/kg丹参素;丹参素高剂量组腹腔注射30mg/kg 丹参素;PI3K 为磷脂酰肌醇-3-激酶;Akt 为蛋白激酶B;与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与丹参素低剂量组比较,cP<0.05;与丹参素中剂量组比较,dP<0.05
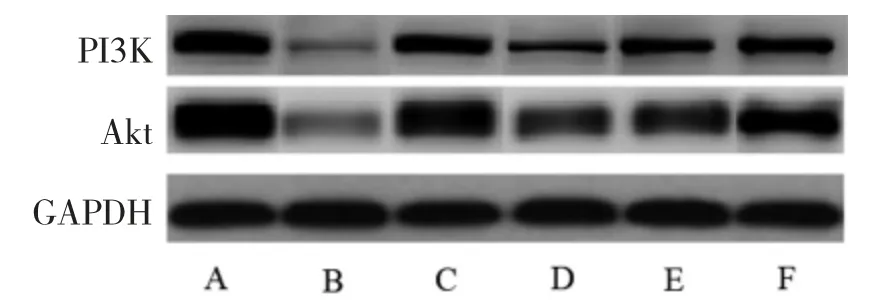
图2 各组小鼠脑组织中PI3K、Akt 蛋白水平条带图
逃避潜伏期可有效反映小鼠学习记忆能力。有研究显示,血管性痴呆小鼠逃避潜伏期显著长于假手术组小鼠,经谷胱甘肽治疗后小鼠逃避潜伏期显著缩短[13]。S-100β、NSE 为两种重要的反应脑损伤程度的细胞因子。研究发现,假手术组大鼠血清S-100β、NSE 两种细胞因子较血管性痴呆组显著降低,其表达量与脑组织病理损伤程度呈负相关;在给予相应的治疗后,S-100β、NSE 含量降低[14]。本研究结果显示,与正常对照组比较,模型组小鼠逃避潜伏期延长,血清S-100β、NSE 水平显著升高;在给予丹参素干预后,小鼠逃避潜伏期缩短,血清S-100β、NSE水平显著降低,且随着丹参素剂量的增加,逃避潜伏期、血清S-100β、NSE 水平变化具有量-效关系。说明丹参素能显著改善血管性痴呆小鼠的脑损伤。
综上所述,丹参素可能通过PI3K/Akt 信号通路,调节PI3K、Akt 蛋白及脑损伤相关细胞因子表达,以改善血管性痴呆小鼠的脑损伤。
