Leptin 介导JAK/STAT 信号通路对猪皮下前脂肪细胞脂类代谢调控的研究
2021-04-26查星琴杨明华李永能赵素梅黄英
查星琴 杨明华 李永能 赵素梅 黄英
(1. 云南农业大学动物医学院,昆明 650201;2. 云南农业大学 云南省动物营养与饲料重点实验室,昆明 650201;3. 云南农业大学党委宣传部,昆明 650201)
Janus 激酶(Janus kinase,JAK)/信号转导子和转录活化子(Signal transducer and activator of transcription,STAT)信号通路是一种细胞内的信号通路,在细胞外信号从细胞膜向细胞核的下游传递过程中起着关键作用,包括炎症、先天和后天免疫反应,以及细胞生长等生物学过程能通过该信号通路进行调节[1]。研究表明,Leptin 介导的JAK/STAT 信号通路的激活对促进脂肪酸的分解有重要的调节作用[2],但对其信号通路的研究目前主要集中在细胞、肿瘤和癌症等方面的研究[3-4],对脂类代谢调节的研究较少。Leptin 主要由脂肪组织合成和分泌,与其受体结合后,可激活多条信号通路,调节脂类代谢,其介导的JAK/STAT 信号通路是其中之一。本研究以100 ng/mL Leptin 处理猪皮下前脂肪细胞48 h,通过油红O 染色,鉴定细胞的形态学特征。采用Realtime PCR 方法检测Leptin 对JAK/STAT 通路中各基因表达水平,并与细胞中甘油三酯和游离脂肪酸含量进行关联分析,旨在阐明Leptin 介导JAK/STAT信号途径调控脂肪代谢的分子机制,为深入开展调节脂类代谢信号转导机制的研究提供理论依据。
1 材料与方法
1.1 材料
地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤购自Sigma 公司;胎牛血清(FBS)、DMEM 培养基、胰蛋白酶购自hyclone 公司,Trizol 购自天根生化科技(北京)有限公司;反转录试剂盒购自北京全式金公司;Real-time PCR 荧光定量试剂盒购自宝生物工程(大连)有限公司;游离脂肪酸试剂盒购自南京建成生物工程研究所;甘油三酯试剂盒购自北京北化康泰临床试剂有限公司。一头15 kg 仔猪由云南农业大学实验猪场提供。
1.2 方法
1.2.1 猪前体脂肪细胞分离、培养及诱导分化 参照黄英等[5]操作方法分离猪前体脂肪细胞。细胞生长至80%左右汇合时,37℃使用0.25%的胰蛋白酶消化后进行培养,细胞生长到60%融合后分为两组,对照组加入诱导分化培养液(诱导分化培养液为:地塞米松0.25 μmol/L、胰岛素10 mg/L 和1-甲基3-异丁基黄嘌呤 0.5 mmol/L),实验组加入诱导分化培养液+100 ng/mL Leptin 处理48 h 后收集细胞,一部分细胞用于油红O 染色鉴定和总RNA 提取,其余部分用于测定细胞中的甘油三酯和游离脂肪酸含量。
1.2.2 油红O 染色 前脂肪细胞诱导分化48 h 后,用10%多聚甲醛固定细胞30 min,PBS 清洗后晾干,加入0.5%油红O 染液染色30 min,用PBS 漂洗残留的油红O 溶液,37℃干燥细胞,倒置显微镜下观察。
1.2.3 甘油三酯和脂肪酸含量测定 用甘油三酯试剂盒和游离脂肪酸测试盒(NEFA)分别测定细胞中甘油三酯浓度和游离脂肪酸含量,操作步骤按照说明书进行。
1.2.4 提取总RNA 用Trizol-A+Reagent 分别提取诱导48 h 后脂肪细胞的总RNA,用核酸蛋白定量仪测定RNA 的浓度及纯度,并用1%琼脂糖凝胶电泳检测RNA 完整性。
1.2.5 Real-Time PCR 反应及条件 使用EasyScript First-Strand cDNA Synthesis SuperMix 进行反转录,各取2 μg 总RNA,反应体系为20 μL:1 μL EasyScript RT/RI Enzyme Mix、10 μL 2×ES Reaction Mix、1 μL Anchored Oligo(dT),DEPC 水补至20 μL。42℃孵育30 min 之后85℃加热5 min,获得的cDNA 产物保存于-20℃中备用。
从GenBank 数据库中检索猪瘦素受体(Leptin receptor,LepR),Janus 激酶2(Janus kinase-2,JAK2),信号转导和转录激活因子3(Signal transducer and activator of transcription-3,STAT3),肉碱棕榈酰转移酶-1(Carnitine palmitoyltransferase-1,CPT-1),脂酰基辅酶A 氧化酶1(Acyl-coenzyme A oxidase,ACOX1),过氧化体增殖活化受体γ 辅助活化因子(Peroxisome proliferators activated receptor gamma coactivator-1,PGC-1α)和看家基因18S rRNA mRNA 序列,利用Primer Primer 5.0 软件设计引物,以18S rRNA 为内参基因检测基因的表达水平,引物序列见表1。
Real-time PCR 反应体系为20 μL:SYBR Premix Ex Taq 10 μL,10 mmol/L 上下游引物各0.4 μL,反转录产物1.5 μL 和ddH2O 7.7 μL。
1.2.6 数据分析 试验数据采用SPSS13.0 统计软件包和Graphpad Prism 进行分析,以平均值±标准差表示,并对平均值进行方差分析,均值的多重比较采用Duncan 法进行,以P< 0.05 为差异有统计学意义。

表1 内参基因与目的基因的引物序列、产物长度和登陆号
2 结果
2.1 Leptin对前脂肪细胞形态变化的影响
观察猪皮下前体脂肪细胞的诱导分化结果(图1),发现不同浓度的Leptin 对前脂肪细胞形态变化无明显影响。处理48 h 后,可见部分细胞开始分化,细胞内可见少量球形脂滴。油红O 染色结果显示,Leptin 组比对照组着色细胞数多。
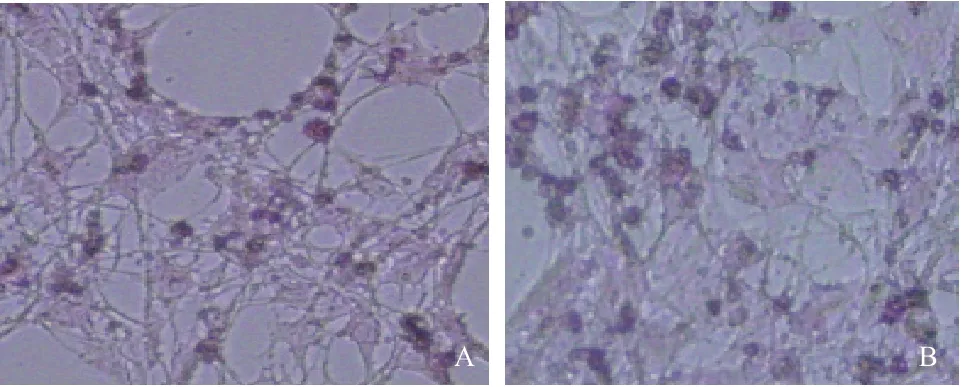
图1 皮下前脂肪细胞油红O 染色(×200)
2.2 Leptin对甘油三酯和游离脂肪酸合成的影响
Leptin 组中甘油三酯含量低于对照组并达到显著水平(P<0.05);Leptin 组中游离脂肪酸含量低于对照组(表2)。
2.3 JAK/STAT信号通路中基因的mRNA表达水平
Leptin 介导的JAK/STAT 信号通路中各基因mRNA 表达水平(图2),Leptin 组LepR基因相对表达量增加了2.36 倍并达到显著水平(图2-A,P<0.05),JAK2基因相对表达量增加了1.19 倍并达到显著水平(图2-B,P<0.05),STAT3基因相对表达量增加了1.79 倍并达到显著水平(图2-C,P<0.05),CPT-1基因相对表达量增加了2.73 倍并达到显著水平(图2-D,P<0.05),ACOX1基因相对表达量增加了2.03 倍并达到显著水平(图2-E,P<0.05),PGC-1α基因相对表达量增加了1.73 倍并达到显著水平(图2-F,P<0.05)。
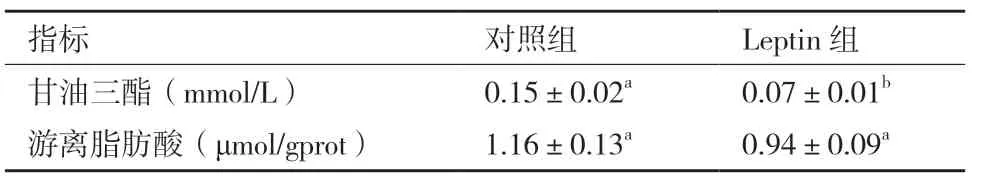
表2 甘油三酯和游离脂肪酸含量
2.4 JAK/STAT信号通路中基因mRNA表达水平与甘油三酯含量相关性分析
通路中各基因mRNA 表达水平与细胞中甘油三酯含量之间相关性分析结果(图3)表明,LepR(图3-A)、JAK2(图3-B)、STAT3(图3-C)、CPT-1(图3-D)、ACOX1(图3-E)和PGC-1α(图3-F)基因的mRNA 表达水平与甘油三酯含量之间均存在显著负相关(P<0.05)。
2.5 JAK/STAT信号通路中基因mRNA表达水平与游离脂肪酸含量相关性分析
通路中各基因mRNA 表达水平与细胞中游离脂肪酸含量之间的相关性分析结果(图4)表明,LepR(图4-A)、JAK2(图4-B)、STAT3(图4-C)、CPT-1(图4-D),ACOX1(图4-E)和PGC-1α(图4-F)基因的mRNA 表达水平与游离脂肪酸含量之间均存在显著负相关并达到显著水平(P<0.05)。
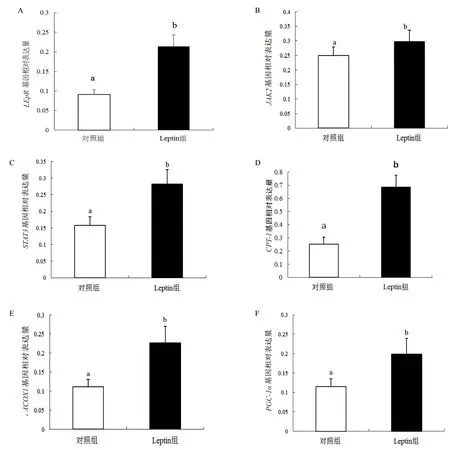
图2 Leptin 介导JAK/STAT 信号通路中基因的mRNA 表达水平
3 讨论
动物脂肪沉积主要受脂类代谢和脂肪细胞分化两方面的调节。脂肪组织中的脂肪沉积,主要由脂肪的摄取速度,脂肪酸的从头合成,甘油三酯的合成,脂类降解和脂肪酸的转运等过程决定。脂类代谢包括甘油三酯代谢、胆固醇代谢、磷脂代谢以及脂类的运输,其中甘油三酯代谢尤为重要。动物脂肪沉积的过程其实是脂肪前体细胞的增殖、分化并且生长肥大的过程。脂肪细胞在其分化的过程中根据脂滴的变化可将脂肪细胞大致分为脂肪前体细胞、前脂肪细胞和成熟的脂肪细胞。脂肪前体细胞的形状与成纤维细胞类似,为梭形,脂滴尚未出现,而前脂肪细胞则是脂滴刚刚出现,两者之间并没有严格区分,通常将这两种细胞都称为前脂肪细胞。前脂肪细胞在分化的早期有多个小脂滴贮存在脂肪细胞中,在胰岛素等诱导因子的促进下,这些小的脂滴逐渐向成熟的脂肪细胞形态转变,逐渐融合成一个大的脂滴,开始合成甘油三酯,最后形成成熟的脂肪细胞,成熟的脂肪细胞一般是大颗粒脂滴充盈细胞的大部分,而位于周围胞浆狭小区域的为稍微扁平的细胞核。脂泡是甘油三酯的储藏库,脂肪细胞内脂泡的大小是脂肪组织成熟的一个重要参数,其大小反映了细胞的能量储存和成熟程度。油红O 染料是脂溶性的染料,在脂肪内可高度溶解,使组织内甘油三酯等中性脂肪特异性的着色,可使脂泡形成便于观察的红色小脂滴。脂肪前体细胞向成熟脂肪细胞分化是受一系列转录因子调控的复杂过程[6]。
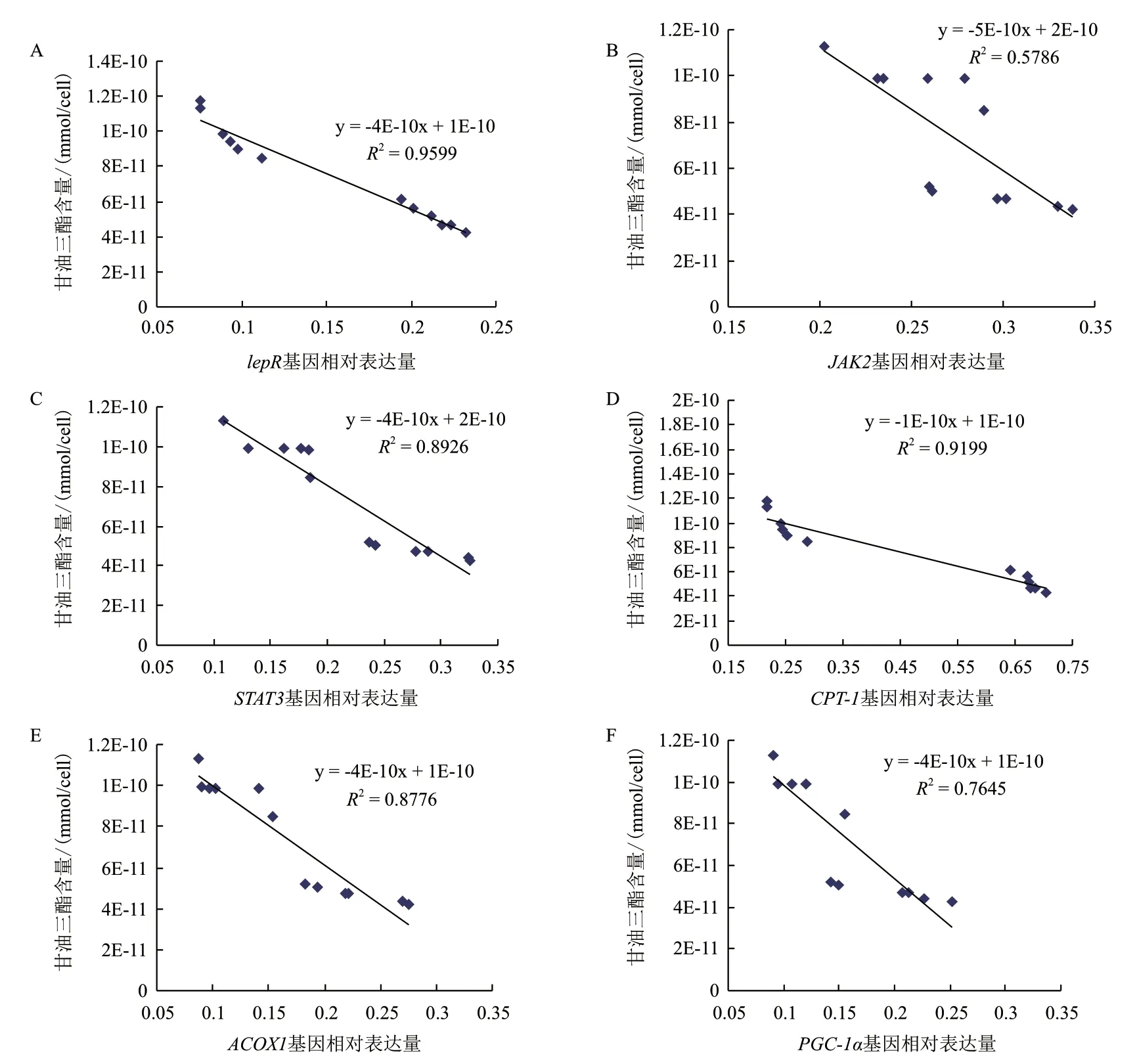
图3 JAK/STAT 信号通路中基因mRNA 表达水平与甘油三酯含量相关性
3.1 Leptin对细胞内甘油三酯、游离脂肪酸含量的影响
脂肪即甘油三酯,是动物体内贮存能量的主要形式,在动物新陈代谢中有着至关重要的作用。动物体内脂肪酸的合成主要来自两条途径,一是机体的自身合成,另一条途径来源于肝脏脂肪酸的合成以及对肠道脂肪酸的吸收。动物体内脂肪的沉积过程是脂肪组织细胞内脂肪的不断合成、蓄积与脂肪不断分化的过程[7-9]。因此,脂类代谢在动物脂肪沉积中占有重要的地位。脂肪在动物体内的沉积是一个动态的平衡过程,取决于脂肪酸的合成、分解及脂肪转运等3 个过程,其中脂肪酸的合成与分解受酶促反应的影响,与脂类代谢相关的酶基因和调控酶基因表达的机制己成为近年来关注的焦点。Leptin 对调节体内甘油三酯的含量具有重要作用,Leptin 可增加脂肪酸氧化和甘油三酯的水解速度,同时抑制酯化作用[10]。在体外培养的前脂肪细胞中加入少量Leptin 可加速脂肪细胞的分化与增殖[11],促使前脂肪细胞向成熟的脂肪细胞转化。Ramsay[12]研究表明,在培养基中加入100 ng/mL Leptin 处理猪脂肪细胞后,葡萄糖氧化、总脂合成及脂肪酸的合成降低并达到显著水平,并可抑制胰岛素对上述过程的促进作用,显著抑制了胰岛素对糖代谢的影响,但对脂蛋白脂酶活性无影响。生物体内脂肪酸的分解主要为β-氧化,β-氧化在线粒体基质内进行。但长链脂肪酸不能透过线粒体内膜,需要肉碱依赖的转运系统将其运到线粒体基质。CPT-1 催化长链脂酰CoA 与肉碱形成脂酰肉碱,是脂酰辅酶A 转入线粒体进行脂肪酸β-氧化的限速酶。CPT-1表达水平升高可促进脂肪酸分解,降低其体脂肪的沉积量。ACOX1 可促进脂肪酸在过氧化物酶体中的氧化,具有降低血清甘油三酯的作用[13]。ACOX1 参与过氧化物酶体β 氧化催化反应的第一步,同时也是其限速酶。PGC-1α 为转录共激活因子,具有许多生理学的功能,如诱导线粒体增殖,促进适应性产热,脂肪酸氧化等[14]。本研究表明,猪皮下前脂肪细胞中添加100 ng/mL Leptin,细胞内甘油三酯含量均显著降低,游离脂肪酸含量降低,在诱导分化48 h 后,细胞中出现了脂滴,油红O 红染色后,可见脂滴着色并呈橘红色。
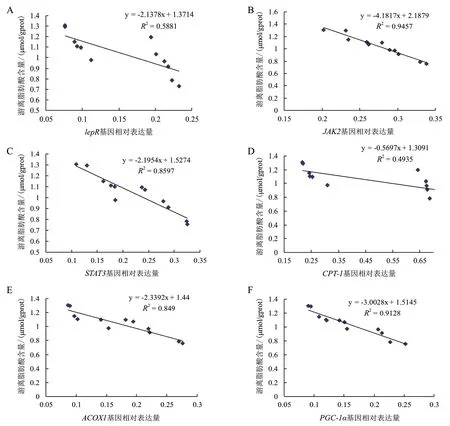
图4 JAK/STAT 信号通路中基因mRNA 表达水平与游离脂肪酸含量相关性
3.2 Leptin对JAK/STAT信号通路相关基因mRNA表达水平的影响
研究表明,Leptin 除了在食欲调节和肥胖方面发挥作用外,还在脂肪细胞的代谢以及改变脂肪细胞的脂质分解中发挥着重要的作用[11]。通常,STAT 蛋白是不活跃的细胞质蛋白,在细胞因子激活后,STAT 蛋白细胞因子/受体复合物通过STAT上的被磷酸化的SH2 结构域与受体结合,同时自身被磷酸化,从而形成磷酸化的二聚体p-STAT。形成的p-STAT 同源二聚体或异源二聚体使STAT 蛋白能够有效的转运到细胞核中,与DNA 上的STAT特定调节序列结合之后能够调节基因的转录[2,15]。CPT-1、ACOX1、PGC-1α基因均为活化STAT3 调节的靶基因。即Leptin 体外诱导皮下前脂肪细胞,可以激JAK/STAT 信号通路,进而上调与脂肪分解相关基因如CPT-1、ACOX1、PGC-1α的表达。CPT-1和ACOX1 分别是脂肪酸在线粒体和过氧化物酶体中经β 氧化途径的限速酶,PGC-1α 为转录共激活因子,具有诱导线粒体增殖、促进适应性产热、脂肪酸氧化等功能。另外,活化的STAT3 受核内及胞质的PTP 和细胞因子信号转导抑制因子的负调控作用。CPT-1 位于线粒体外膜,通过过氧化物酶体增殖物激活受体、丙二酸单酰辅酶A、磷酸化P 脱磷酸化依赖的细胞骨架成分在转录水平、翻译及翻译后水平接受调解,在能量代谢中起关键作用。而且胰岛素可以通过诱导乙酰辅酶A 羧化酶(Acetyl CoA carboxylase,ACC)的活化和合成的丙二酸单酰CoA浓度的增加直接或间接抑制CPT-1 的作用。同时当细胞中游离脂肪酸浓度升高时也可以促进CPT-1 的表达。本研究表明,100 ng/mL Leptin 体外诱导皮下前脂肪细胞,均使LepR、JAK2、STAT3、CPT-1、ACOX1、PGC-1α基因的表达水平增强。皮下前脂肪细胞Letin 组LepR、JAK2、STAT3、CPT-1、ACOX1、PGC-1α基因相对表达量均高于Letin 组并达到显著水平。说明了Leptin 具有促进游离脂肪酸氧化,降低甘油三酯含量的作用。
3.3 JAK/STAT通路相关基因mRNA表达水平与细胞甘油三酯、游离脂肪酸含量相关性分析
脂肪组织具有强大的内分泌功能,能够产生和分泌多种脂肪源性因子如白介素-6、脂联素、Leptin等,影响脂肪组织本身乃至整个机体的能量代谢平衡。Leptin 是脂肪细胞分泌的主要细胞因子之一,可作用于中枢神经系统,抑制食欲,减少进食量。并通过兴奋交感神经系统,促进脂肪分解,产热增加,从而降低机体脂肪含量。另外,Leptin 还有抑制炎症反应、调节免疫系统及神经内分泌系统、促血细胞和血管生成等方面[16]。Leptin 对脂肪细胞脂类代谢的调节主要是通过激活JAK/STAT 信号转导通路实现的。甘油三酯主要在肝脏、脂肪组织和小肠粘膜上皮合成,其合成方式有甘油二酯和甘油一酯两种途径。其中甘油二酯合成甘油三酯是其脂肪细胞合成的主要途径,脂肪酸的从头合成提供了合成大部分甘油三酯所需要的脂肪酸。在机体需要时,甘油三酯被脂肪酶逐步水解为游离脂肪酸和甘油,游离脂肪酸经一系列酶氧化分解产生能量供机体的需要。100 ng/mL Leptin 体外诱导皮下前脂肪细胞,启动了JAK/STAT 信号通路,使LepR、JAK2、STAT3、CPT-1、ACOX1、PGC-1α基因的相对表达量升高。其中CPT-1、ACOX1、PGC-1α基因均是脂肪分解代谢相关基因,其表达量的升高加快了脂肪酸的氧化。该信号通路激活之后,上调与脂肪分解的相关基因CPT-1、ACOX1和PGC-1α等的表达,进而促进了脂肪酸的分解,降低了细胞中甘油三酯的含量。本研究结果表明皮下前脂肪细胞中添加Leptin,细胞中甘油三酯、游离脂肪酸含量均降低。另外,本研究将JAK/STAT 信号通路中基因的相对表达量分别于细胞内甘油三酯含量和游离脂肪酸含量进行了相关性分析,皮下前脂肪细胞LepR、JAK2、STAT3、CPT-1、ACOX1、PGC-1α基因mRNA 表达水平与脂肪细胞内甘油三酯和游离脂肪酸的含量均呈负相关。这表明该基因在脂肪分解代谢过程中起到重要作用。
4 结论
Leptin 激活皮下前脂肪细胞中JAK/STAT 信号通路,上调其通路中相关基因的表达,促进脂肪酸氧化,降低了甘油三酯含量。
