高羊茅逆境胁迫蛋白基因FaUSP 的克隆、表达及生物学功能分析
2021-04-26陈莹陈锡王茜王小利
陈莹 陈锡 王茜 王小利
(贵州省农业科学院 贵州省草业研究所,贵阳 550006)
高羊茅(Festuca arundinacea)是禾本科多年生地被植物,可作为观赏性草坪草,也可作为牧草饲养牲畜,作为我国主要草品种之一,在草坪建植与水土保持方面发挥着巨大的作用。干旱、盐、高温或低温、重金属和氧化胁迫等非生物胁迫严重影响了它的生长与发育,期间涉及多种复杂机制,通过激活应激反应基因将外部信号转化为下游效应因子,称之为受体对信号的感知。效应蛋白介导植物一些形态和生理的改变,帮助植物更好地适应胁迫条件。在多种生物中被发现。在拟南芥中,已经研究发现许多应激反应基因家族,逆境胁迫蛋白(Universal stress protein,USP)家族是其中之一。
逆境胁迫蛋白USP 又称应激蛋白,普遍存在于细菌和植物的细胞质中,通常由111-167 个氨基酸残基组成。逆境胁迫蛋白基因UspA 超家族最初是在大肠杆菌中发现的[1],在多重应激条件和营养缺乏等逆境条件下,其表达急剧增加,在非生物应激反应中发挥积极作用。USP 的结构域属于疏水蛋白,在USP 肽链上有8 个磷酸化位点,具有应激性,并作用于苏氨酸与丝氨酸的蛋白磷酸化。一些USP 蛋白具有使DNA 结合、修复和重新折叠的功能,可以支持生物体保护其核酸免受外部压力,有的USP 蛋白可以与ATP 结合,可能会参与激素的合成、产物代谢、细胞内物质运输等[2]。植物USP 蛋白中发现的催化修饰物包括丝氨酸/苏氨酸激酶、酪氨酸激酶、U-box、SWI2/snf2、Mudr(SWIM)-锌指结构、HDzip、阳离子交换器与IKI3。植物USP 的催化修饰物可能是在不同胁迫下选择性的演化过程中产生,导致了不同催化修饰物与USP 域的融合,这个过程为植物提供了多种调控方式来保护它们免受外来胁迫的伤害。前人已在很多高等植物中发现USP基因,David 等[3]在拟南芥中发现了44 个USP 相似的蛋白,系统发育树分析将其分为2 种类型,一种包含ATP 结合位点;另一种不包含ATP 结合位点。MsUspA 可能参与调控激素和次生代谢物合成以提高苹果的抗旱性[4]。在亚洲棉中,Maqbool 等[5]成功克隆出USP1与USP2发现,其在干旱胁迫下表达量更高,推测USP基因能在干旱胁迫下对亚洲棉起到保护作用。Jung 等[6]研究表明AtUsp启动子能被非生物诱导性胁迫与植物激素高度诱导,并产生多种胁迫的抗逆性。过表达AtUsp植株表现出较强的耐热和抗氧化性[7]。之后陆续在大豆[8]、黄檗[9]、拟南芥[10]、紫云英[11]中发现USP基因,该基因编码的蛋白几乎参与所有的逆境胁迫,因此吸引了大量国内外学者对其功能进行深度研究。高羊茅中有关USP基因的抗旱性研究仍鲜见报道。
本研究通过cDNA 末端快速扩增技术获得高羊茅逆境胁迫蛋白基因FaUSP全长,利用生物信息学技术,分析FaUSP的结构与其他物种USP 的同源性。利用RT-PCR 技术研究FaUSP在不同非生物胁迫条件下的表达情况。将FaUSP在菊苣中过量表达,研究在干旱胁迫下过量表达FaUSP对菊苣生理特性的响应,探索USP基因家族的抗逆功能和机理,旨为制备具有抗旱性和高产性的优良品种奠定理论基础。
1 材料与方法
1.1 材料
采用的高羊茅黔草1 号是2005 年由贵州省草业研究所育成的国家牧草新品种(登记号:299)。
1.2 方法
1.2.1 材料的处理 选取饱满的高羊茅种子,播种于花盆中,置于温度为(23±2)℃、光照12 h/黑暗12 h、湿度是70%的光照培养箱中,定期浇水。待生长一段后进行高温、干旱、高盐、低氮胁迫处理。
高温胁迫:将发芽的植株移栽到土壤基质中生长30 d,然后将高羊茅植株转入42℃持续处理24 h,对照组的生长条件为23℃。
干旱处理:将生长14 d 的高羊茅幼苗放于30%的PEG 溶液中处理24 h,对照组为正常Hoagland 营养液。
高盐处理:将生长14 d 的高羊茅幼苗分别放置于含有400 mmol/L NaCl 的Hoagland 营养液和正常Hoagland 营养液中处理24 h。
低氮处理:将生长30 d 幼苗分别转移到Hoagland 营养液与无氮水培液中(营养液中NO3-被Cl-取代)进行生长处理15 d。
按照取样时间分别取0、0.5、1、2、6、12 和24 h 共7 个点,采集处理组与对照组高羊茅的叶片用液氮速冻,-80℃保存待用。
1.2.2 RNA 提 取 采 用TaKaRa RNAiso Reagent 试剂盒进行高羊茅叶片的RNA 提取,参照RevertAid First Strand cDNA Synthesis Kit 试剂盒说明反转录mRNA,以总mRNA 为模板合成第一链cDNA[12]。
1.2.3FaUSP的克隆 参考高羊茅转录组测序结果中USP 相关基因片段,采用Primer Premier 5.0 设计PCR 扩增特异引物(表1)。采用5'RACE 试剂盒(Invitrogen)与3'RACE 试剂盒(Clontech)扩增获得FaUSP的5'端与3'端,PCR 产物回收纯化后送至上海生工公司测序。
1.2.4 实时荧光定量PCR 检测 以反转录成的高羊茅cDNA 为模板,采用qRT-PCR 技术检测高温、低氮、干旱与高盐逆境胁迫下高羊茅叶片中FaUSP的表达量,引物见表1。反应体系为6 μL ddH2O、2 μL cDNA、1 μL 上游引物、1 μL 下游引物和10 μL 2×SYBR Premix Ex Taq,置于荧光定量PCR 仪上进行反应,95℃ 3 min;94℃ 10 s,60℃ 10 s,72℃ 30 s,45 个循环,内参基因为UBI(表1)。每个取样点3个生物学重复,3 个技术重复。

表1 高羊茅FaUSP 克隆及荧光定量PCR 的引物序列
1.2.5 生物信息学分析 使用NCBI 网站搜索进行Blast 比对,并分析编码蛋白功能域(https://www.ncbi.nlm.nih.gov),使用SOPMA 网站预测FaUSP 蛋白的基本性质、二级结(https://npsa-prabi.ibcp.fr/cgi-bin/ npsaautomat.pl?page=npsa_sopma.html)。 使用MEGA6.0 软件进行氨基酸序列同源性分析,构建FaUSP 蛋白序列的系统进化树;在ExPASY 网站分析FaUSP 蛋白的相对分子量、等电点及疏水性(http://www.expasy.ch/tools/proscale.html)。
1.2.6 遗传转化载体的构建与菊苣的遗传转化 参考李小冬等[13]方法构建过量表达载体及菊苣的遗传转化,USP基因为逆境胁迫基因,能被多种逆境胁迫诱导,为了进一步研究USP基因的功能,将准备好的菊苣外植体与含有目标质粒的农杆菌放入无菌培养皿中浸染,使农杆菌与外植体充分接触,将侵染好的外植体转入培养皿中,放入人工气候室培养,温度为24℃,用加100 mg/mL 头孢霉素的无菌水清洗外植体3 次,直至长出愈伤组织,每星期继代一次,待长出根系移植到培养基质中(泥炭土∶蛭石=1∶1),最后提取DNA 进行阳性检测。
1.2.7 干旱胁迫下转基因菊苣生理特性的响应 提取菊苣RNA,采用荧光定量PCR 检测野生型和转基因植株中FaUSP的表达,引物参照表1。将野生型与转基因的菊苣进行干旱胁迫处理,在胁迫后的0、5 和10 d 时取样进行生理指标测定。
2 结果
2.1 高羊茅FaUSP的克隆与核酸序列分析
以高羊茅cDNA 为模板,使用特异引物FU-fwd1与FU-rev1,扩增获得一条长度为470 bp 条带(图1),回收、测序后获得高羊茅FaUSP的核心片段。利用合成的3' RACE 与5' RACE 引物(表1)进行PCR扩增,获得3'端364 bp与5'端的315 bp的cDNA片段。利用DNAMAN 软件将以上3 段序列进行拼接,得到总长度为844 bp 的基因全长cDNA 序列(图2),含501 bp 的开放阅读框,共编码166 个氨基酸,该基因包含70 bp 的5'端非编码区和273 bp 3'端非编码区,命名为FaUSP。
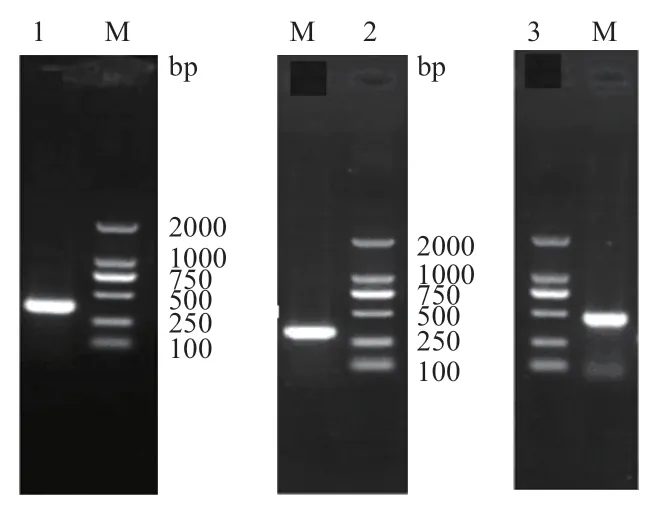
图1 FaUSP 基因的RACE 扩增

图2 FaUSP 核苷酸及推导的氨基酸序列
保守结构域分析表明,该基因编码的蛋白属于USP 家族。经系统进化树分析,FaUSP 蛋白与禾本科植物小麦、大麦、二穗短柄草、山羊草的USP 蛋白亲缘关系较近,同源性均在70%以上(图3)。
2.2 高羊茅FaUSP编码蛋白的生物信息学分析
利用SOPMA 软件预测FaUSP 蛋白的二级结构,结果显示,FaUSP 蛋白结构域主要由α-螺旋(39.76%)、延伸链(19.88%)、β-转角(4.82%)和无规则卷曲(35.54%)组成。理化性质分析表明,FaUSP编码的蛋白质的相对分子质量为18.06 kD,理论等电点为5.93,不稳定系数为32.49,疏水性分析发现,FaUSP 蛋白疏水性最大值为2.067,最小值为-3.2,为亲水蛋白。
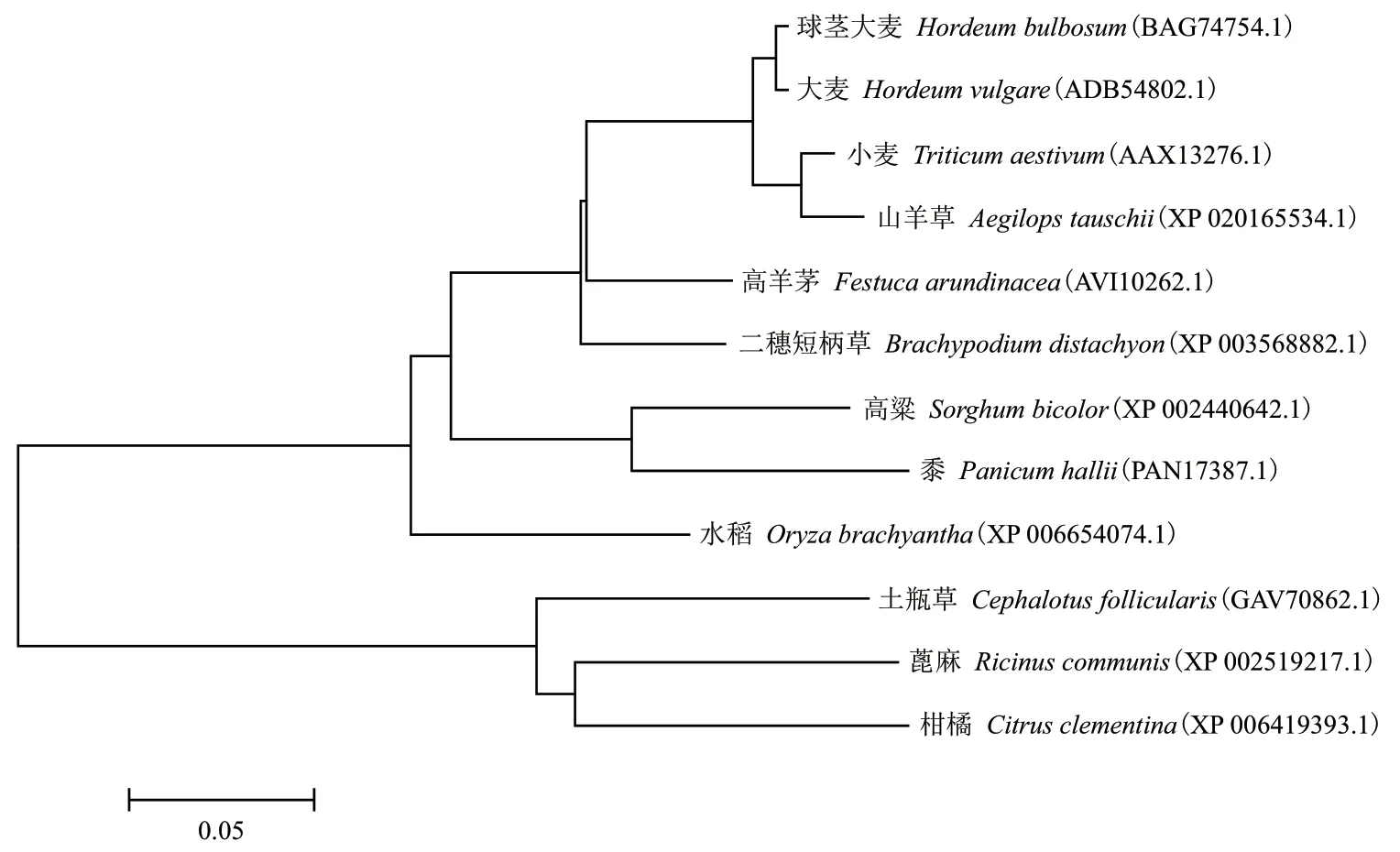
图3 植物USP 同源基因氨基酸序列的系统进化树分析
2.3 在非生物胁迫下高羊茅逆境胁迫FaUSP的表达模式分析
采用实时荧光定量PCR 检测高羊茅叶片中逆境胁迫FaUSP在高盐、低氮、干旱与高温胁迫处理下的时空特异性的表达规律(图4),在高温胁迫下,FaUSP的表达在胁迫处理0.5 h 后被诱导上升,处理6 h 达到峰值,在胁迫处理12 h 后受到抑制,然而与对照相比,在胁迫12-24 h 时FaUSP表达显著降低;在干旱胁迫下,胁迫处理早期(0-1 h)FaUSP的表达与正常条件相当,呈现下降趋势,在胁迫6 h时,FaUSP的表达受到极显著的诱导。在低氮胁迫下,与正常条件下相比,FaUSP的表达在胁迫处理0.5-2 h 时显著降低,在胁迫6-24 h 后FaUSP表达被诱导显著上升。在高盐胁迫0-1 h 时FaUSP表达与对照相当,在胁迫12-24 h,FaUSP表达显著被诱导上升,在胁迫24 h 时表达量达到峰值,为对照组的3 倍,说明高羊茅FaUSP受干旱、高温、氮胁迫及盐胁迫的诱导,该基因可能与抗性相关。
2.4 FaUSP转基因菊苣的表型与表达分析
野生型菊苣(WT)与转基因菊苣(FaUSP超量表达)在相同的培养条件下呈现不同的表型(图5),培养62 d 后,野生型菊苣处于抽穗期,而超表达FaUSP的菊苣呈现晚花表型。以野生型为对照,检测5 株转基因菊苣FaUSP表达量(图6),与野生型相比,FaUSP的表达量显著上调,升高了7-11 倍。
2.5 干旱胁迫对FaUSP转基因菊苣生理特性的影响
转基因与野生型的菊苣随着干旱胁迫时间的延长,叶绿素含量呈现先升后降的趋势(图7),干旱胁迫下转基因组和对照组的叶绿素含量相比差异不显著。而转基因组菊苣的可溶性蛋白含量随干旱胁迫时间的延长呈上升的趋势,在胁迫的第10 天达到峰值,显著高于对照组。说明干旱胁迫能有效诱导菊苣的可溶性蛋白的合成,使其含量上升。
谷胱甘肽还原酶(Glutathione reductase,GR)作为植物体内重要的抗氧化剂与自由基清除剂,保护机体不受逆境胁迫的伤害(图7),随着干旱胁迫时间的延长,转基因与野生型的菊苣的GR 含量均呈现先升后降的趋势,转基因组在干旱胁迫下的GR含量显著高于对照组,说明干旱胁迫下转基因组菊苣体内GR 的合成能力显著强于对照组。
抗氧化酶系统是植物遭受逆境胁迫重要的防御体系,超氧化物岐化酶(SOD)、过氧化物酶(POD)与过氧化氢酶(CAT)是抗氧化酶系的主要组成部分。随着干旱胁迫时间的延长,转基因组与对照组的CAT 与POD 活性呈现先升后降的趋势,均在胁迫第5 天活性最高,转基因组CAT 与POD 活性显著高于对照组。转基因组SOD 的活性随着干旱胁迫时间的延长呈现升高趋势,在胁迫10 d 达到了峰值,说明干旱胁迫下转基因组能够使菊苣叶片抗氧化酶活性显著升高。
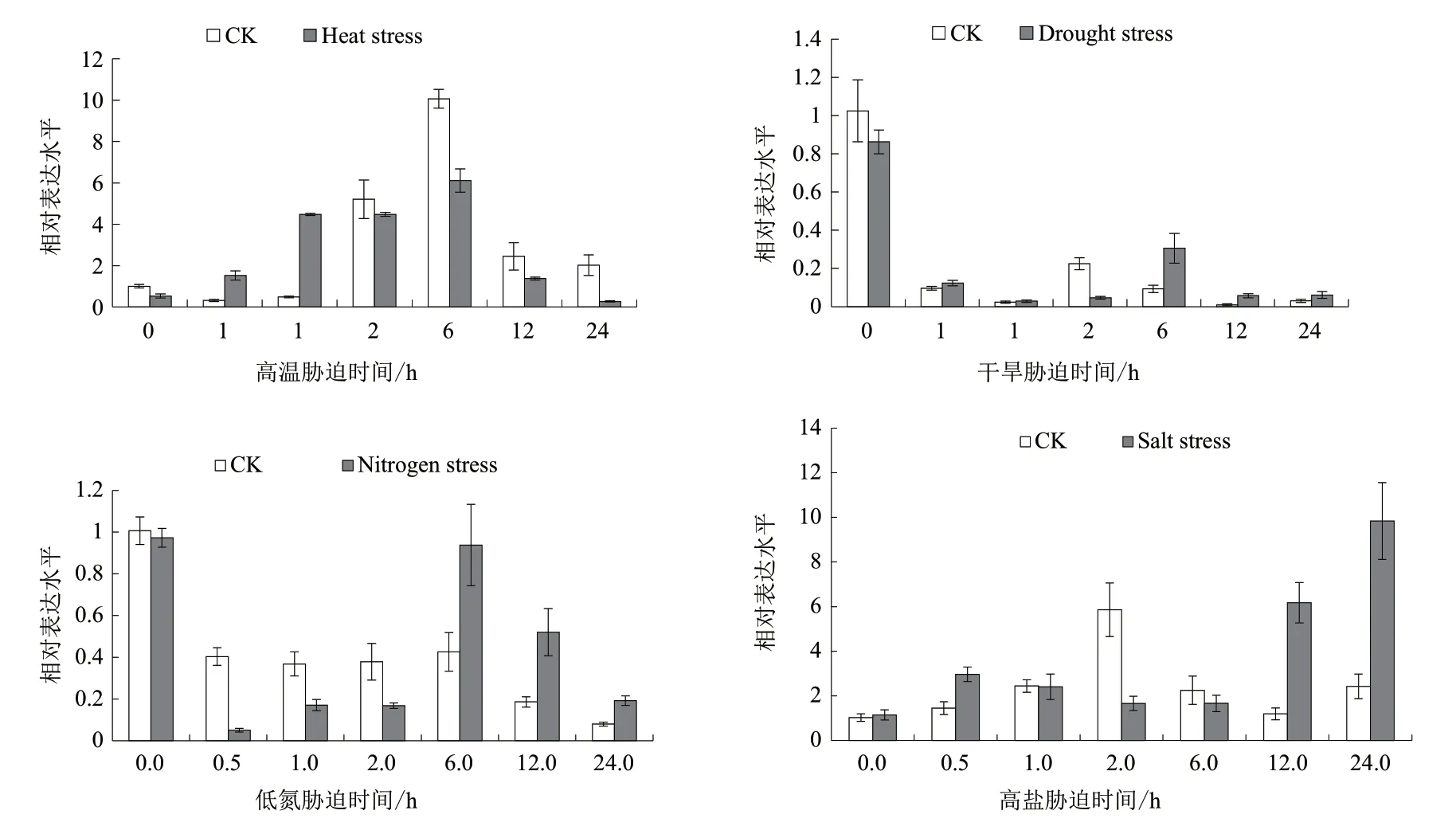
图4 非生物胁迫下FaUSP 基因在高羊茅中的转录水平
3 讨论
逆境胁迫蛋白USP 是一个保守的蛋白家族,参与大量逆境胁迫应答反应。最早于大肠杆菌中被发现[1]。在高等植物中,USP 的发现起始于水稻。USP 蛋白一般存在于细胞质中,是普遍存在于植物中的抗性相关蛋白,在植物受到外界胁迫时会受诱导表达上调,增强植物的抗逆性[14-15]。赵莘等[16]发现抗病的中国野生华东葡萄株系在接种白粉病后VpUS表达量呈明显的增加趋势,表明VpUSP在与白粉病菌互作过程中具有表达活性等。本研究利用cDNA 末端快速扩增技术获得高羊茅逆境胁迫蛋白FaUSP,序列全长844 bp,含501 bp 的开放阅读框,共编码166 个氨基酸。保守结构域分析表明,该基因编码的蛋白属于USP 家族。对其氨基酸序列进行分析,结果表明,高羊茅FaUSP 蛋白与禾本科植物小麦、大麦、二穗短柄草的USP 蛋白亲缘关系较近,在进化树分析中高羊茅FaUSP 与禾本科植物的USP聚在一起。这可能是同为禾本科的植物,与其他同科植物的家族成员具有共同的保守区,而逆境胁迫蛋白FaUSP 在其他科属中存在着分化。

图5 转基因菊苣的表型
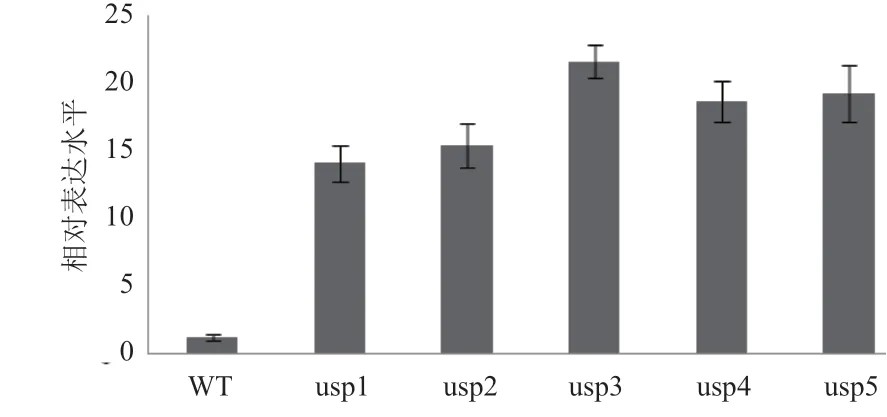
图6 转基因菊苣FaUSP 的表达分析
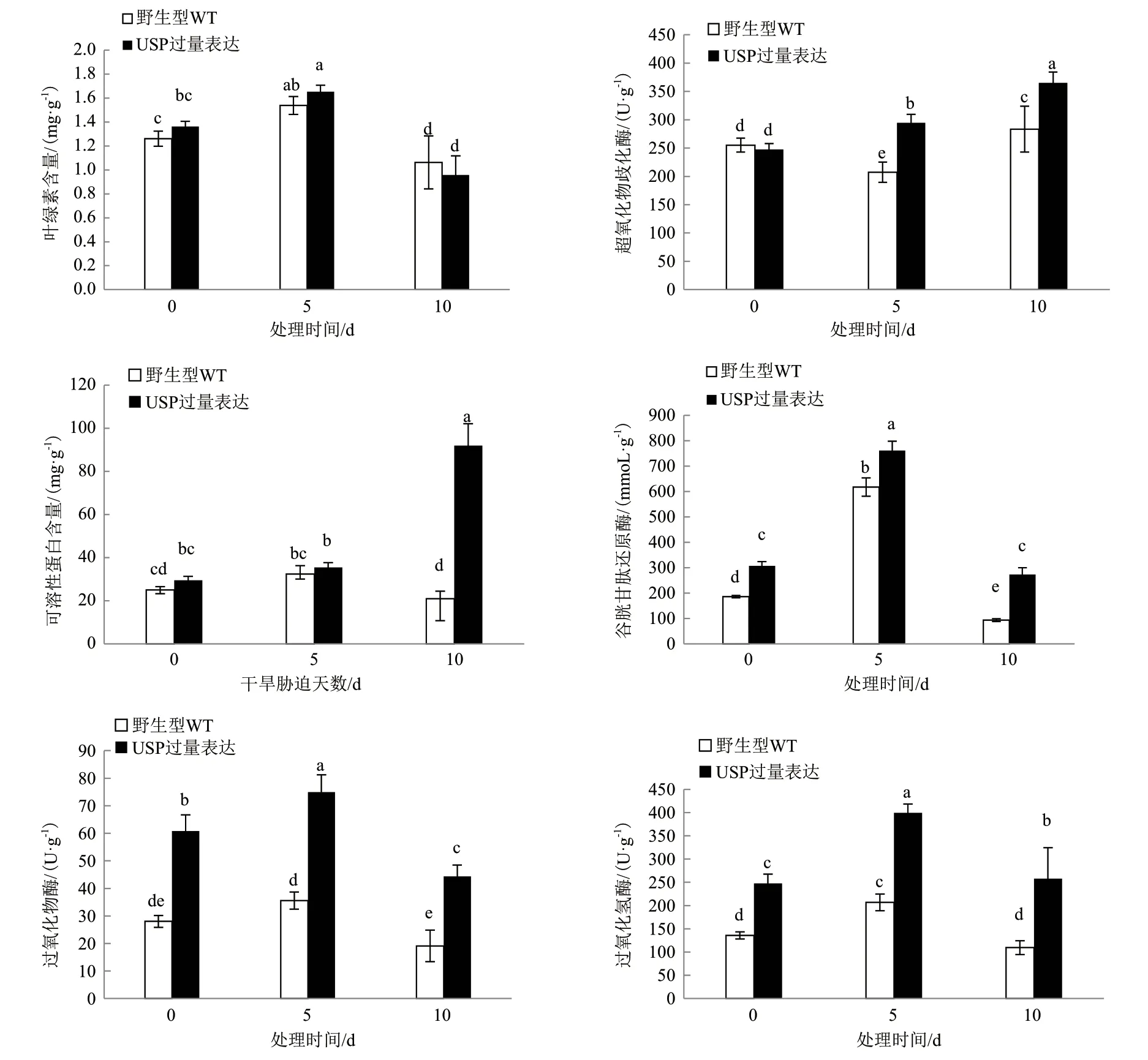
图7 转基因菊苣在干旱胁迫下的生理应答差异
Usp基因在植物中普遍存在,其表达受多种逆境如干旱、高温、涝害等条件调控,被认为与植物胁迫反应有关。研究发现USP 基因表达受多种逆境条件诱导,如Sauter 等[17]发现水稻OsUSP1受乙烯与涝害的诱导表达;小麦胁迫相关基因W1受干旱、低温的诱导[18];黄姗等[8]发现大豆在盐、ABA、干旱胁迫下大豆Usp1被诱导表达量上调。本研究进行实时荧光定量PCR 表达分析显示,高羊茅FaUSP受干旱、高温、氮胁迫及盐胁迫的诱导表达上调,表明该基因与抗性相关。关于高羊茅FaUSP的分子作用机制,进一步构建过表达载体遗传转化转入菊苣进行功能验证研究。
在对植物构成威胁的环境因素中,干旱是最常见的非生物胁迫之一,它对植物生长发育的影响比其他环境因素更为严重[19-20]。为了减少干旱的危害,植物已经进化出了几种方式应对,包括提高植物自身耐受性、抵御干旱的伤害与适应干旱的能力,这些适应性可以通过调控一系列不同的信号转导基因加以实现[21-23]。逆境胁迫蛋白基因USP 在干旱胁迫下被诱导并发挥积极作用,提高了植物的抗逆能力。Loukehaich 等[24]发现过量表达的SpUsp明显提高了番茄抗旱性。生理生化指标的测定结果表明转基因SpUsp烟草可以保护细胞免受氧化损伤[25]。这与本研究结果一致,干旱胁迫下过量表达FaUSP菊苣可溶性蛋白、GR、SOD、POD、CAT 的合成显著高于对照组,说明FaUSP能够提高植物的抗旱能力。
4 结论
从高羊茅中克隆得到逆境胁迫蛋白FaUSP,含501 bp 的开放阅读框,共编码166 个氨基酸,该基因编码的蛋白属于USP 家族。其受干旱、高温、氮胁迫及盐胁迫的诱导。干旱胁迫下菊苣中过表达FaUSP可以显著提高抗旱能力。
