小桐子低温诱导型启动子JcDnaJ20p 的克隆及烟草转化功能鉴定
2021-04-26王海波郭俊云
王海波 郭俊云
(曲靖师范学院 生物资源与食品工程学院,曲靖 655011)
转录水平的调控在植物基因表达中发挥重要作用[1-2]。启动子是功能基因上游负责RNA 聚合酶识别并开始转录的顺式作用元件(Cis-acting element),其包含RNA 聚合酶特异结合所需的保守序列,以及控制转录精确起始的TATA-box 核心元件与控制转录频率的CAAT-box 和GC-box 元件[1],也可通过与特定反式作用因子(Trans-acting element)如转录因子的结合,从而调节功能基因转录的速度与频率[1-3]。根据基因的表达方式,启动子分为组成型启动子(如花椰菜花叶病毒CaMV35S 启动子[4]、水稻肌动蛋白ActinI 启动子[5]、玉米泛素Ubiquitin启动子[6])、组织特异性启动子(如拟南芥韧皮部AtPP2基因启动子[7]、火炬松微管组织PAL基因启动子[8])、诱导型启动子(如干旱诱导Lea启动子[9]、rd29A启动子[10]、低温诱导cor15a启动子[11]、高盐诱导Rab16A启动子[12]、病原诱导SRA启动子[2,13]等)。目前,在植物遗传转化研究中,大部 分 使 用CaMV35S(Cauliflower mosaic virus 35S promoter)作为目的基因表达的启动子,作为典型的植物组成型强启动子,CaMV35S 驱动外源基因在植物中表达没有组织特异性与发育阶段特异性,但会造成转基因植物由于过表达浪费大量物质与能量,增加代谢负担,甚至改变植物的代谢途径与外部形态,从而影响植物正常生长发育[14],而诱导型启动子具有逆境诱导表达特性且不影响植物正常生长的优点,成为培育植物抗逆新品种的最好选择。
目前,已经从多种植物中分离出低温诱导表达启动子。拟南芥cor15a基因属典型低温诱导表达基因,其过量表达可以显著提高拟南芥的低温抵抗能力,同时该基因的启动子也具有低温诱导表达特性,能够在低温条件下,特异驱动GUS基因的表达[11]。另外,拟南芥rd29A基因启动子在植物抗冷基因工程中也有广泛的应用,且由rd29A启动子驱动的转基因植株比由CaMV35S 启动子驱动的转基因植株生长影响更小[10]。
能源植物小桐子作为主要的生物柴油植物之一,其种子含油量高,且流动性与石化油掺和性好,成为未来最有可能替代化石能源的潜力树种,我国在“十五”、“十一五”、“十二五”能源发展纲要中都把发展小桐子产业列为可再生能源中长期发展规划的重点[15]。小桐子(Jatropha curcasL.)属大戟科(Euphorbiaceae)麻疯树属(Jatropha)多年生落叶半肉质小乔木或大灌木[16],目前在我国滇、黔、川、桂、闽、粤及琼等省份有较多野生资源分布[17]。小桐子原产中南美洲的热带及亚热带地区,低温冷害是限制小桐子种植面积进一步扩大与产业发展的主要环境因素。前期通过小桐子低温转录组[18]与数字基因表达谱[19]测序表明,小桐子低温条件下高诱导表达基因主要包括电子传递与氧化还原平衡类基因、水解酶基因、渗透调节物运输家族基因以及转录因子家族基因,暗示小桐子在响应低温过程中能量平衡、光合效率、渗透调节等功能起重要作用。DnaJ20 蛋白属于Hsp40 家族分子伴侣,在逆境胁迫下能保护胞内蛋白质等的结构与功能稳定性。DnaJ20基因在12℃低温处理12、24、48 h 下上调表达都达到极显著水平,与小桐子的抗冷性直接相关,而其启动子是否也具有低温诱导表达特性还未见报道。本研究克隆了DnaJ20基因上游2 023 bp 的启动子序列,并通过GUS基因融合构建了pCambia1381Z-JcDnaJ20p-GUS 植物表达载体,进而在烟草中瞬时表达鉴定了该启动子的低温诱导特性,旨在为小桐子抗冷性基因工程的研究提供理论与应用依据。
1 材料与方法
1.1 材料
实验所用小桐子材料采自云南省元谋县干热河谷地区。遗传转化受体烟草品种为云烟87。大肠杆菌(Escherichia coli)菌株DH5α、根癌农杆菌(Agrobacterium tumdfaciens)菌株EHA105、植物表达载体pCambia1381Z 由本实验室保存。pMD18-T 载体、T4 DNA 连接酶、基因组提取试剂盒、凝胶回收试剂盒及质粒提取试剂盒均购自宝生物工程有限公司(TaKaRa)。TaqDNA 聚合酶购自TOYOBO 公司,限制性内切酶购自Fermentas 公司。其他试剂为国产分析纯。引物合成与测序由深圳华大基因有限公司完成。
1.2 方法
1.2.1 小桐子JcDnaJ20p 启动子的克隆及序列分析 根据本实验室前期小桐子数字基因表达谱(低温12℃处理12、24、48 h)数据[19],分子伴侣DnaJ20基因属于低温高响应基因。通过DnaJ20基 因 的mRNA 序 列(GenBank 登 录号:XM_012230104.2)对小桐子基因组数据库(JatCur_1.0)进行Blast 相似性检索,获得该基因起始密码子ATG 上游2 500 bp 的启动子序列。利用Primer5.0 软件设计扩增引物(JcDnaJ20p_C),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3',下划线表示SalI 酶切位点;下游R:5'-CCCAAGCTTG AGATCATTCCTGCAGTAG-3',下划线表示Hind III 酶切位点,菌落PCR 验证引物(JcDnaJ20p_T),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3';下游R:5'-CAAAGGGAAATAATTTCATTG-3'(扩增长度284 bp)。
采用植物基因组DNA 提取试剂盒提取小桐子叶片基因组DNA。以基因组DNA 为模板,使用高保 真DNA 聚 合 酶KOD FX Neo DNA Polymerase 及JcDnaJ20p_C 引物进行PCR 扩增,扩增条件为:98℃预变性5 min;98℃变性10 s,60℃退火30 s,68℃延伸2 min,30 个循环,68℃后延伸5 min。将扩增片段切胶回收后与克隆载体pMD18-T 连接,命名为pMD18-T-JcDnaJ20p,转化大肠杆菌DH5α 感受态细胞,涂LB 抗性平板(包含50 mg/L Amp),过夜生长。利用引物JcDnaJ20p_T 进行菌落PCR 验证的阳性克隆,送检测序并提取重组质粒。测序序列 通 过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子顺式作用元件进行鉴定。
1.2.2 植物表达载体的构建 将pMD18-TJcDnaJ20p 质粒与植物表达载体pCambia1381Z 经SalI、Hind III 双酶切,切胶回收后利用T4 DNA 连接酶16℃过夜连接,将小桐子启动子JcDnaJ20p序列克隆至pCambia1381Z 的多克隆位点,获得JcDnaJ20p 启动子与GUS基因融合的植物表达载体pCambia1381Z-JcDnaJ20p-GUS,将该质粒转化大肠杆菌DH5α 感受态细胞,涂布LB 抗性平板(含50 mg/L 的Kan),37℃过夜生长,提取重组质粒,通过SalI 与Hind III 双酶切进行鉴定。同时构建CaMV35 启动子与GUS基因融合的植物表达载体pCambia1381Z-35S-GUS,将pCambia1381ZJcDnaJ20p-GUS、pCambia1381Z-35S-GUS 融合载体与pCambia1381Z-GUS 空质粒通过冻融法转化根癌农杆菌EHA105 菌株。
1.2.3 烟草转化及GUS 组织化学染色 将以上转化了不同载体的农杆菌菌株挑取单克隆于1 mL LB液体培养基中(含50 mg/L Rif 与50 mg/L Kan),28℃震荡培养24 h。将过夜培养的农杆菌转至25 mL LB 液体培养基中(含50 mg/L Rif 与50 mg/L Kan),加入100 μL 0.5 mol/L 2-(N-吗啉)-乙磺酸(2-N-morpholino ethane sulfonic acid,MES),28℃震荡培养至OD 值约为1.0,4 000 r/min 离心15 min,弃上清,用10 mmol/L MgCl2重悬菌体至OD 值约为1.0,静置3 h。取正处于生长期的烟草叶片,用针头在叶片反面扎数个创伤孔,将转化pCambia1381ZJcDnaJ20p-GUS 质粒的农杆菌菌液通过注射器注入叶片下表皮进行浸染,同时以转化pCambia1381Z-35S-GUS 与pCambia1381Z-GUS 空质粒的农杆菌为对照浸染烟草叶片。将以上浸染的烟草叶片分别置于15、4℃的培养箱中进行低温处理24 h,室温25℃为对照,之后进行GUS 组织化学染色。将烟草叶片置于GUS 染液(购自Coolaber 公司)室温下染色1 h,用70%乙醇进行脱色,每次1 h,重复4 次,拍照观察。
2 结果
2.1 小桐子JcDnaJ20p启动子的克隆及植物表达载体的构建
根据GenBank 中发表的小桐子基因组数据设计引物,扩增得到JcDnaJ20基因起始密码子上游2 023 bp 的启动子DNA 片段,命名为JcDnaJ20p(图1-A)。pCambia1381Z 是包含标记基因GUS的启动子功能分析专业植物表达载体,双酶切-T4 DNA 连接酶法构建了JcDnaJ20p 启动子与GUS基因融合的植物表达载体pCambia1381Z-JcDnaJ20p-GUS(图2),通过农杆菌菌落PCR(扩增长度284 bp)(图1-B)与SalI、Hind III 双酶切验证(图1-C)显示,pCambia1381Z-JcDnaJ20p-GUS 已成功转化农杆菌EHA105 菌株,同时提取阳性菌落的重组质粒(图1-D)并送样进行测序。测序结果表明,克隆的JcDnaJ20p 启动子序列与小桐子基因组中的序列相似性为99.8%(图3-D)。
2.2 小桐子JcDnaJ20p启动子的序列分析
根据Wu 等[20]构建的小桐子基因组高密度遗传连锁图谱,通过Scaffold 数据在染色体水平定位JcDnaJ20基因,并使用MapChart 软件进行可视化绘图显示,小桐子JcDnaJ20基因定位7 号染色体(总长度131.4 cM)的9.7 cM(图3-A)。进一步通过基因组数据分析显示,小桐子JcDnaJ20基因(GenBank登录号:105644672)长度为894 bp,包含1 个外显子(618 bp),在基因两端还鉴定到长度分别为82 bp、194 bp 的5'-UTR、3'-UTR 区域(图3-B)。
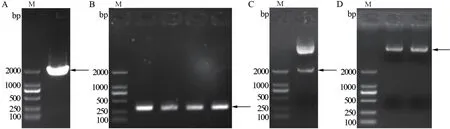
图1 小桐子JcDnaJ20p 启动子的克隆
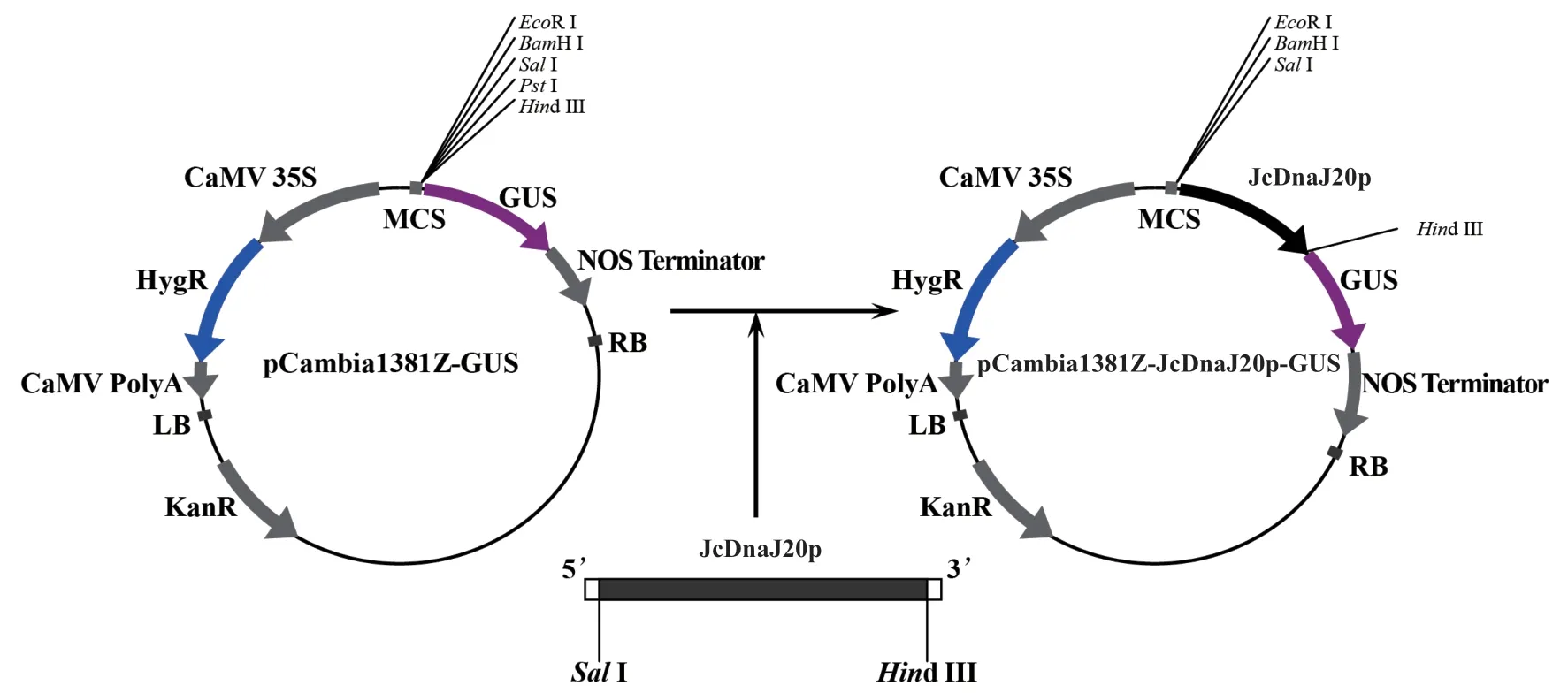
图2 小桐子JcDnaJ20p 启动子与GUS 基因融合植物表达载体的构建
利用PlantCARE 工具分析克隆的JcDnaJ20p 启动子序列存在的顺式作用元件。结果表明,该启动子具有真核生物典型的核心启动子序列,包含31 个CAAT-box 和87 个TATA-box。另外,还鉴定到激素类的响应元件,如脱落酸响应元件(ABRE,核心序列ACGTG)、赤霉素响应元件(P-box,核心序列CAAAAGG),以及非生物胁迫类响应元件,如低温/脱水响应元件(DRE,核心序列ACCGAGA)(图3-C)。还包括MYB、MYC 转录因子识别(CAACGG)与 结 合(CAACAG) 序列,MYBHv1 结合元件(CCAAT-box,核心序列CAACGG),从而具备与多种信号转导系统互作的通路,同时,具有多个光信号响应元件(ATC-motif,核心序列AGTAATCT;GT1-box,核心序列GGTTAA;Gap-box,核心序列CAAATGAA;TCCC-motif, 核心序列TCTCCCT;TCT-motif,核心序列TCTTAC)(图3-D)。另外,通过GenBank 数据库下载JcDnaJ20基因上游5000 bp 启动子序列,与克隆的2 023 bp 序列相似性为99.8%,且在克隆序列的上游鉴定到更多的与防御、胁迫相关的响应元件(TC-rich repeats,核心序列GTTTTCTTAC)。

图3 小桐子JcDnaJ20p 启动子顺式作用元件的分析
2.3 烟草叶片GUS活性的组织化学染色
以转化空质粒pCambia1381Z-GUS、35S启动子融合GUS的载体pCambia1381Z-35S-GUS 为对照,将pCambia1381Z-JcDnaJ20p-GUS 重组载体采用农杆菌渗透法转化烟草叶片,之后以常温25℃为对照,分别置于15、4℃经过低温处理24 h 后进行GUS 染色。结果显示,转化pCambia1381Z-GUS 的烟草叶片,由于缺乏启动子,GUS报告基因在3 个温度下都没有表达,而转化pCambia1381Z-35S-GUS 的烟草叶片在3 个温度下都检测到GUS表达活性,但染色深度基本一致,与35S 启动子为组成型启动子的特性一致。另外,转化pCambia1381Z-JcDnaJ20p-GUS 的烟草叶片在3 个温度下也都表现出GUS表达活性,且随着温度的降低,表达量逐渐升高,GUS 染色的颜色也逐渐加深(图4),表明小桐子JcDnaJ20p 启动子具有启动子活性,且属于低温诱导型启动子。
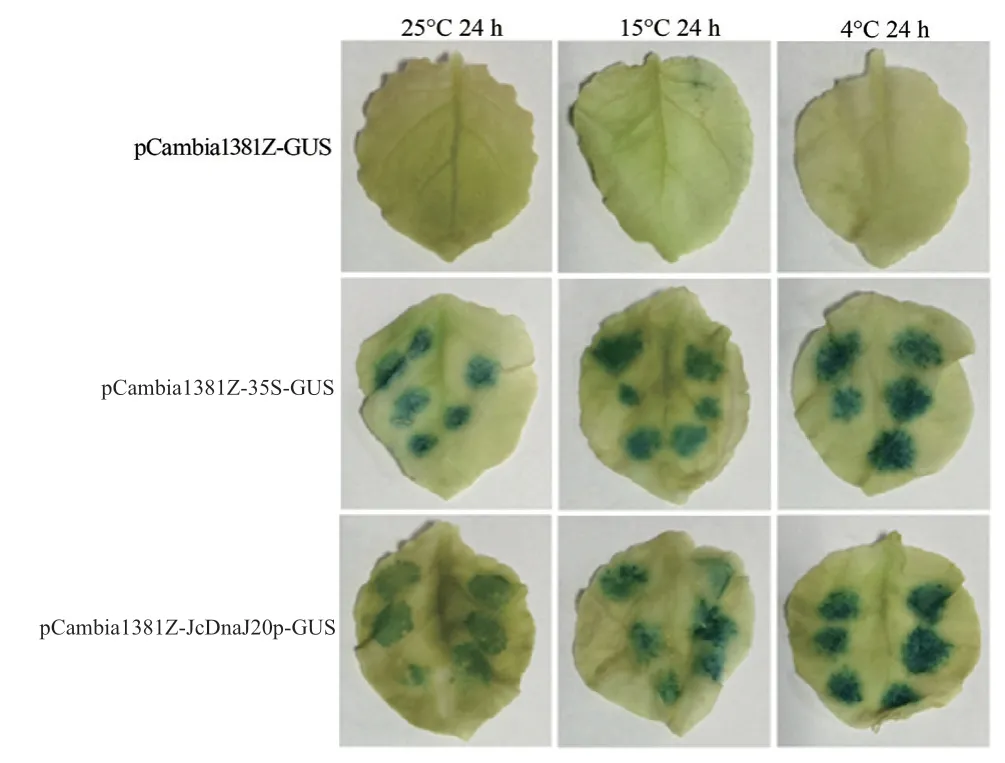
图4 转基因烟草叶片的GUS 组织化学染色
3 讨论
功能基因启动子区域的不同顺式作用元件决定了该基因的诱导表达模式。通过分析发现,小桐子JcDnaJ20基因启动子区除了具有真核生物典型核心启动子元件CAAT-box 和TATA-box 外,也鉴定到低温、干旱响应DRE 元件(Dehydration Responsive element),文献报道,DRE 顺式作用元件普遍存在于干旱、高盐、低温胁迫应答基因的启动子中[10-11],说明其可能参与小桐子抗冷性与抗旱性的胁迫响应过程。同时,还鉴定到参与多种胁迫调节的MYB元件、MYC 元件。如拟南芥抗逆rd(Responsive to drought)系列基因都包含MYB 元件[21],另外,拟南芥低温诱导CBF系列基因都包含MYC 元件[22],暗示JcDnaJ20基因及其启动子在小桐子抗冷性及其他抗逆性响应中发挥重要作用,成为未来小桐子转基因研究的主要候选功能基因。
植物逆境诱导型启动子,对下游调控基因只在逆境胁迫条件下才诱导其表达,避免过量表达浪费植物的物质与能源而导致生长发育障碍[1-3,14]。目前,国内外对植物低温信号转导机制以及低温诱导启动子已有一些报道。cor15a作为典型的低温诱导基因,其过量表达能显著提高拟南芥的低温抵抗能力,同时cor15a基因启动子也具有低温诱导表达特性[11]。将该启动子与GUS标记基因构建融合表达载体并转化马铃薯表明,经过低温处理的转基因马铃薯叶片都检测到GUS 产物,而未经低温处理的对照组则未检测到GUS 活性[23]。低温冷害诱发的次级水分胁迫也被认为是冷害的主要原因之一,在拟南芥rd29A启动子区域鉴定到干旱、低温及高盐胁迫响应的顺式作用元件[10]。Kasuga 等[24]将组成型启动子CaMV35S 与低温诱导启动子rd29A驱动的CBF基因在转基因烟草中进行表达,发现两个转基因株系都表现出较野生型对照组更强的抗冷性,且由rd29A驱动的CBF转基因植株比CaMV35S 驱动的转基因植株表现出更弱的生长抑制。另外,拟南芥ADH 启动子[25]、LT178 启动子[26]、CBF2 启动子[27],小麦mwcs120 启动子[28],水稻Tdcor39 启动子[29]及大麦blt4.9 启动子[30]也都表现出低温诱导特性,DnaJ20基因是小桐子低温诱导上调表达较显著的基因,属于分子伴侣DnaJ基因家族,烟草瞬转及低温诱导表达证明,该基因启动子能够提高GUS基因的表达量,具有低温诱导启动子活性。本研究对深入理解低温胁迫下DnaJ基因家族的作用机制奠定了基础,同时为后续小桐子抗冷育种的研究积累了潜在基因资源。
4 结论
转录组测序表明,DnaJ20基因是小桐子低温诱导高表达基因。本研究克隆到小桐子DnaJ20基因上游2 023 bp 的启动子序列,PlantCARE 分析表明,该启动子中包含低温胁迫等响应元件。同时,成功构建了该启动子驱动的GUS标记基因的植物表达载体,通过烟草瞬时转化表达显示,该启动子能够显著提高GUS基因的表达量,具有低温诱导启动子活性。
