甘草苷调控PI3K/Akt/m-TOR信号通路对口腔鳞状细胞癌细胞及裸鼠移植瘤小鼠的作用研究
2021-04-25邓溪川刘璐王占利姚睿
邓溪川 刘璐 王占利 姚睿
甘草苷(Liquiritin, LIQ)是甘草类黄酮的主要成分,具有显著的抗癌作用,研究表明,LIQ通过诱导细胞凋亡和抑制细胞增殖来发挥其抗癌效果,然而,LIQ对口腔鳞状细胞癌的效果和相关分子机制还没有被揭示,本研究探讨了LIQ对口腔鳞状细胞癌细胞活力、凋亡的影响并通过构建裸鼠瘤模型进行了体内验证,并分析了的PI3K/AKT/m-TOR信号通路在其中所扮演的角色。
1 材料与方法
1.1 细胞株和动物分组
人口腔鳞状细胞癌Cal-27、Tca8113细胞系、人正常肝QSG-7701、人正常肾293T细胞系购自于中国科学院细胞研究所; 24 只6~7 周龄SPF级BALB/c nu/nu雄性裸鼠,体重18~20 g, 购自上海杰思捷实验动物有限公司,实验分为四组(对照组、低浓度LIQ处理组,中浓度LIQ处理组和高浓度LIQ处理组);各组小鼠在恒温恒湿的IVC小鼠房进行饲养,所有接触的笼具,饮水,饲料等均进行灭菌处理,并已通过实验动物伦理委员会的批准。
1.2 主要试剂与仪器
LIQ(CAS:551-15-5, HPLC≥98%)(上海纯优生物科技有限公司);高糖DMEM培养基、PRMI 1640细胞培养基(Hyclone公司, 美国);胰蛋白酶-EDTA细胞消化液(TE)、FBS 胎牛血清和链霉素-青霉素(PS)双抗(上海冰晴公司);一抗、二抗(北京索莱宝生物科技公司);CCK-8试剂盒、细胞凋亡试剂盒、蛋白浓度测定试剂盒、TUNEL检测试剂盒、电化学发光(ECL)发光试剂盒(上海碧云天生物科技有限公司)。
ReadMax 1900Plus型光吸收全波长酶标仪(上海闪谱生物科技有限公司);海尔HCB-900V洁净工作台(上海臣莲生物科技发展有限公司);二氧化碳恒温培养箱(SANYO公司,日本);流式细胞仪(贝克曼-库尔特生有限公司, 美国)。
1.3 实验方法
1.3.1 CCK-8实验检测LIQ对口腔鳞状细胞癌的杀伤作用 体外实验利用CCK-8实验检测LIQ对口腔鳞状细胞癌细胞的杀伤作用和对正常细胞的毒副作用,将Cal-27、Tca8113、QSG-7701和293T细胞以1×105的浓度接种至96 孔板中。当细胞满度长到60%时饥饿处理2 h,随后用不同终浓度(0、 5、 10、 20、 30及40 μmol/L)的LIQ处理,每个浓度梯度设置8 个复孔。药物处理24 h后将10 μL CCK-8溶液加入孔中并放入培养箱继续孵育,利用酶标仪在490 nm波长下测量吸光度值,实验重复3 次并计算细胞存活率及IC50值(半数致死浓度)。用细胞存活率衡量LIQ对细胞的杀伤作用。
1.3.2 流式细胞术检测LIQ对口腔鳞状细胞癌的诱导凋亡作用 将Cal27细胞以1×105个每孔接种至6 孔板,用IC50值浓度的LIQ分别处理Cal27细胞3、 6、 12和24 h,收集细胞并经过PBS清洗后,根据细胞凋亡检测试剂盒说明书操作,加入195 μL的 Annexin V-FITC结合液重悬细胞,再加入3 μL Annexin V-FITC与2 μL PI,室温避光孵育15 min,每组加入300 μL PBS,转移至流式管后流式细胞仪检测细胞凋亡率,实验重复3 次,验证Cal27细胞的凋亡情况。
1.3.3 口腔鳞状细胞癌小鼠的构建与分组 体内实验首先需要构建裸鼠移植瘤模型并将裸鼠分组。因裸鼠不具备胸腺,没有免疫能力,将Cal27细胞以3×107个/mL的细胞密度重悬,然后以每只200 μL细胞悬液为基准,在SPF级环境下将细胞皮下接种至裸鼠背部右侧靠近腋窝处,每天观察裸鼠及肿瘤状况,当接种裸鼠均出现直径大5 mm3的圆形或椭圆形皮下质硬结节,即为模型建立成功。根据本研究设定的实验方案,将裸鼠随机数字表法随机分为4 组,具体为空白对照组、LIQ低(10 mg/kg)、中(20 mg/kg)、高(40 mg/kg) 3 个浓度实验组,给药通过灌胃的方式,每2 d/次进行,给药10 次,实验中各组裸鼠未出现死亡情况。停药后,牺牲裸鼠,剥离肿瘤备用。
1.3.4 对裸鼠瘤小鼠肿瘤体积及重量的测定 实验过程中,每2 d用游标卡尺对瘤体的体积进行测量,计算公式为V=1/2×长径×短径2;待实验结束处死小鼠后,完整剥离肿瘤,记录瘤体最终的质量;计算口腔鳞状细胞癌肿瘤抑制率=(空白对照组瘤重均值-实验组瘤重均值)/空白组对照瘤重均值×100%。
1.3.5 TUNEL法检测LIQ对口腔鳞状细胞癌肿瘤组织细胞的诱导凋亡作用 将取出的肿瘤组织进行固定、石蜡包埋,并按4 μm厚切片,然后按TUNEL检测试剂盒说明书操作,对肿瘤组织中的细胞凋亡情况进行检测。每张切片随机选取5 个视野(×200),计数细胞总数和凋亡细胞数,并计算细胞凋亡率=凋亡细胞数/肿瘤细胞总数。
1.3.6 Western Blotting检测肿瘤组织细胞中凋亡相关蛋白变化 取出在低温条件下保存的移植瘤组织,用超声波破碎仪超声 10 s,在4 ℃离心机中以14 000×g离心30 min,取上清蛋白,BCA法测蛋白含量,配置10%~15%的SDS-PAGE凝胶进行电泳,随后转移至NC膜上,丽春红染色后,TBST洗膜,脱脂乳封闭,一抗4 ℃水平摇床孵育过夜。第2 天取出后,TBST洗膜,二抗室温孵育2 h,ECL发光试剂进行显色,再通过化学发光成像系统进行拍照。内参选择α-tubulin,并利用ImageJ软件对所出条带进行灰度分析。
1.4 统计学分析
2 结 果
2.1 LIQ对口腔鳞状细胞癌细胞和正常细胞的杀伤作用
从表 1中可以看出,LIQ能够明显抑制两种口腔鳞状细胞癌细胞的增殖,并且呈现出明显的浓度依赖性和时间依赖性,经计算LIQ对Cal27、Tca8113的IC50值分别为(19.2±0.8)、 (23.4±0.5) μmol/L。在对正常细胞的检测中发现,当LIQ浓度为40 μmol/L时, 2 种正常细胞的存活率均处在90%以上,说明LIQ对2 种正常细胞的毒副作用较小。

表 1 LIQ在体外抑制口腔鳞状细胞癌细胞的增殖
2.2 LIQ对Cal27细胞的诱导凋亡作用
从图 1A中可以看出,随着LIQ处理时间(0、 3、 6、 12、 24 h)的不断增加,早期凋亡和晚期凋亡的细胞数目逐渐增加,凋亡细胞数目百分比分别为2.88%±0.52%、5.09%±1.37%、 24.19%±2.28%、 35.25%±2.94%、 50.42%±2.87%; 随后对凋亡相关蛋白进行检测,发现LIQ能够以时间依赖性的方式上调Bax, Caspase-3和Cytochrome C(Cyto-C)的表达,下调Bcl-2的表达(图 1B),说明LIQ能够通过线粒体依赖性凋亡途径诱导Cal27细胞凋亡。
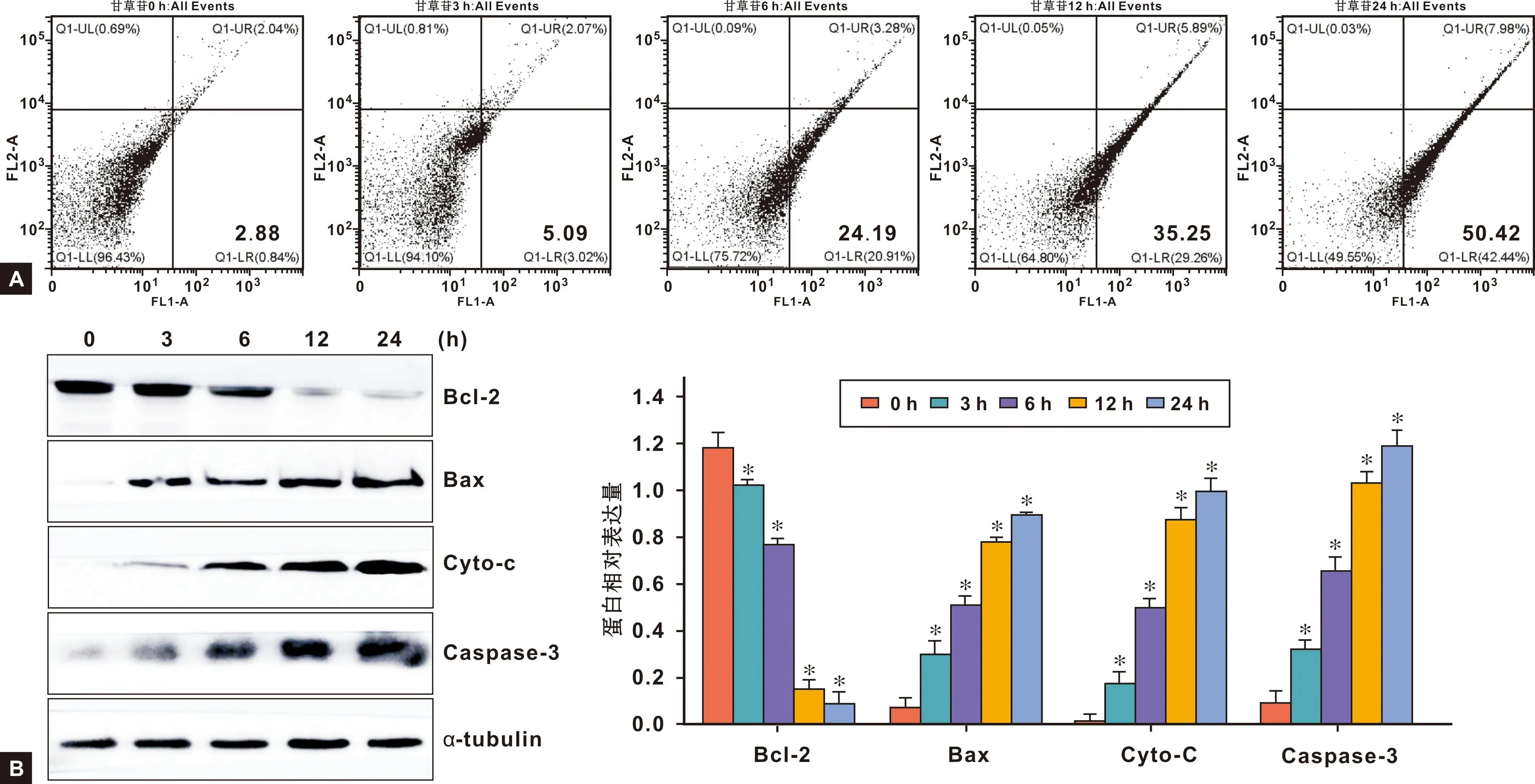
图 1 LIQ诱导口腔鳞状细胞癌Cal27细胞凋亡(*: 与0 h相比, P<0.01)
2.3 LIQ对口腔鳞状细胞癌裸鼠移植瘤的影响
体内实验结果显示与对照组相比,LIQ能够明显抑制裸鼠移植瘤生长,瘤体的体积和瘤重明显减少,肿瘤抑制率为15.92%、 48.67%和68.14%(P<0.05),呈现出浓度依赖性(图 2),在对小鼠体重的检测中,我们发现,LIQ灌胃给药没有影响到小鼠的体重,说明LIQ对小鼠没有明显的毒副作用,表明LIQ能够在一定范围内以浓度梯度来抑制肿瘤的生长。
2.4 LIQ对口腔鳞状细胞癌裸鼠移植瘤细胞凋亡的影响
从TUNEL实验检测结果中可以看出,随着LIQ处理剂量的不断增加,视线范围内黄棕色的细胞数目不断增加 (黄棕色表示发生凋亡的细胞, 蓝色表示未凋亡细胞),并具有明显的浓度依赖性(图 3),进一步证明了LIQ具有诱导口腔鳞状细胞癌细胞凋亡的作用。

图 2 LIQ对口腔鳞状细胞癌裸鼠移植瘤的抑制作用(*: 与对照组相比, P<0.01)

表 2 LIQ对裸鼠瘤重量的影响及肿瘤抑制率
2.5 LIQ调节口腔鳞状细胞癌细胞胞中PI3K/AKT/m-TOR信号通路
为了检测在LIQ诱导口腔鳞状细胞癌细胞凋亡过程中,有哪些信号通路参与了这个过程,检测了PI3K/AKT/m-TOR信号通路相关蛋白的表达量变化情况。如图 4所示,随着LIQ处理时间的不断延长,PI3K,p-AKT, m-TOR的表达量逐渐降低, 具有明显的时间依赖性,与对照组比较,差异有显著性(P<0.05)。

图 3 LIQ诱导口腔鳞状细胞癌裸鼠移植瘤细胞凋亡(×200)

图 4 LIQ对口腔鳞状细胞癌细胞中PI3K/AKT/m-TOR信号通路的影响(*: 与0 h相比, P<0.01)
3 讨 论
目前为止,口腔鳞状细胞癌的发病机理还未被完全揭示,对于这种对人类危害极大且发病率死亡率逐年上升的癌症,其治疗方法已经成为减轻病患的关键[1]。国内外众多研究都证明植物中的许多活性成分能够有效抑制癌细胞的增殖和瘤体的增长,中药提取物作为潜在的化学治疗药物开发前景广阔[2]。LIQ是从豆科甘草属植物甘草中提取出来的黄酮类单体活性成分,具有多种生物活性,具有来源广泛、价格低廉、无毒副作用等优点,近年来有研究表明,LIQ对宫颈癌、非小细胞肺癌等癌症具有良好的抑制作用,其抗肿瘤作用受到越来越多的关注[3-4]。本研究通过用不同浓度的LIQ作用口腔鳞状细胞癌Cal27、Tca8113细胞后,结果表明LIQ能够呈剂量和时间依赖性地抑制口腔鳞状细胞癌的细胞活力,在对正常细胞的杀伤作用检测中发现,LIQ对正常的肝肾细胞没有明显的毒副作用,提示LIQ具有高效抑制口腔鳞状细胞癌细胞生长且低毒的作用。
随着对口腔鳞状细胞癌研究的进一步深入,越来越多的研究学者认为细胞凋亡在口腔鳞状细胞癌的发生、发展和愈后化疗的过程中都扮演着重要角色,手术切除后再辅以化疗药物诱导癌细胞凋亡是当前癌症治疗中最可行的方法之一[5]。细胞凋亡是细胞增殖的屏障,可以阻止肿瘤细胞的过度增殖,为了验证LIQ是否是通过诱导口腔鳞状细胞癌细胞发生细胞凋亡进而抑制其增殖的,进行了流式细胞术和Western blot实验从细胞和分子两个层面分别对细胞凋亡进行了检测。从结果中可以看出,LIQ能够以时间依赖性的方式上调Bax,Cyto-c,Caspase3的表达,下调Bcl-2的表达进而诱导口腔鳞状细胞癌细胞凋亡。
PI3K/AKT/m-TOR信号通路是一条经典的细胞通路,PI3K在整个信号通路的上游,AKT是整条通路的核心,m-TOR是一种丝氨酸-苏氨酸激酶,处于整条信号通路下游,该信号通路调控着细胞的增殖、凋亡、各种物质的合成和代谢等过程,同时还调控着众多信号分子,如Caspase家族、Bcl-2家族的各种蛋白[6]。近年来的研究表明,PI3K/AKT/m-TOR信号通路在卵巢癌,肝癌等多种癌细胞中处于过表达的状态,抑制该信号通路的表达能够起到抗癌的作用[7]。同样,PI3K/AKT/m-TOR信号通路参与口腔鳞状细胞癌的形成、抑制细胞凋亡、促进肿瘤细胞的侵袭和转移、影响血管新生等方面具有明显的调控作用,且在口腔鳞状细胞癌中一直处于一个过表达的状态[8-9]。本实验的研究表明,LIQ能够下调PI3K,p-AKT,m-TOR的蛋白表达,抑制PI3K/AKT/m-TOR信号通路,从而起到诱导口腔鳞状细胞癌凋亡并抑制增殖的作用。同时,体内实验结果表明,LIQ能够有效地抑制裸鼠瘤小鼠瘤体的体积,降低瘤体的重量,与对照组相比有显著性差异并具有明显的浓度依赖性,并且TUNEL实验结果表明,LIQ处理组的裸鼠瘤体细胞中,凋亡细胞的数量逐渐升高,也进一步验证了LIQ能够诱导体内的口腔鳞状细胞癌细胞发生凋亡。
综合以上实验结果,可以推断LIQ能够在体内外对口腔鳞状细胞癌产生抗癌效果,其作用机制可能是通过抑制PI3K/AKT/m-TOR信号通路,使Bcl-2/Bax蛋白之间形成同二聚体,降低了线粒体膜电位,使其通透性降低,导致Cyto-C从线粒体中释放,激活Caspase-3,触发Caspase级联反应,最终诱导口腔鳞状细胞癌凋亡。本实验为LIQ在治疗口腔鳞状细胞中的应用提供了一定的理论基础,但是仍然有一些具体的机制有待进一步研究。
