慢性肾衰竭与血清胃蛋白酶原、胃泌素-17的相关性研究
2021-04-25郭融
郭 融
广东祈福医院肾内科,广东广州 511495
消化道症状是慢性肾功能衰竭(CRF)患者最早发生也是最明显的症状,在非透析患者中发病率高达80%,严重影响患者生活质量及预后[1]。传统观点认为,CRF患者出现消化道症状的主要危险因素是尿毒症毒素。但多项研究数据表明[2],进行透析治疗CRF患者消化道症状的发生率依然超过40%。随着近年来对胃肠激素研究的深入,研究者对CRF患者出现消化道症状病因的理解也愈加成熟,认为胃肠动力学、胃肠激素以及尿毒症毒素均是主要病因[3-4]。有研究显示[5],CRF患者由于肾脏解毒功能下降,会导致胃肠激素紊乱,使得胃肠运动功能异常,引起患者营养不良和生活质量下降。因此改善CRF患者的消化道症状至关重要。本研究通过CRF患者的血清胃泌素-17(G-17)、胃蛋白酶原(PG)的变化水平,来探讨其相关性,旨在为早期干预CRF患者的胃肠道症状提供一定的依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年12月~2020年3月广东祈福医院收治的100例CRF患者作为研究对象。同时选取同期的30名健康体检者作为对照组。100例患者均未行透析治疗,其中男54例,女46例;平均年龄(58.7±10.9)岁;平均病程(22.61±11.03)个月;原发病:糖尿病肾病36例,IgA 肾病25例,膜性肾病13例,高血压性肾病10例,梗阻性肾病8例,多囊肾8例。对照组中,男18例,女12例;平均年龄(54.0±11.9)岁;均无基础疾病,未服用任何药物。100例CRF患者参考2002年版K/DIGO 指南[6]关于慢性肾脏病(CKD)分期进行分组:Ⅰ期:肾损伤,肾小球滤过率(GFR)正常或≥90 mL/(min·1.73 m2);Ⅱ期:GFR 轻度下降,GFR 60~89 mL/(min·1.73m2),Ⅰ、Ⅱ期为1组(33例)。Ⅲ期:GFR 中度下降,GFR30~59 mL/(min·1.73m2),为2组(34例)。Ⅳ期:GFR 重度下降,GFR15~29 mL/(min·1.73 m2);Ⅴ期:肾衰竭,GFR<15 mL/(min·1.73 m2),Ⅳ期、Ⅴ期为3组(53例)。四组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有纳入患者及其家属均知情同意并签署知情同意书,且本研究经广东祈福医院医学伦理委员会审核批准。
1.2 纳入及排除标准
纳入标准:①非透析患者;②年龄18~80岁。排除标准:①合并严重心脏、肝功能不全者;②幽门螺杆菌阳性感染者;③合并有活动期恶性肿瘤,肝硬化失代偿期或造血系统等严重原发性疾病者;④感染性疾病者(活动性肝炎、细菌、真菌、病毒及非典型病原体感染者);⑤无法合作者,如精神病、老年痴呆患者;
1.3 方法
空腹状态下以专用采血管采集受检者的肘静脉血3~5 mL,常规静置后,在3000 r/min 的速度下对混合液进行离心分离处理10 min,吸取上层血对血清中的血清蛋白酶原Ⅰ(PGⅠ)、血清蛋白酶原Ⅱ(PGⅡ)、胃泌素-17(G-17)水平进行测定,试剂盒选择必欧翰(合肥)生物技术有限公司的G-17 检测试剂盒、PGⅠ、PGⅡ检测试剂盒,检测仪器为采用全自动化学发光免疫分析系统(合肥运涛光电科技有限公司,型号:LUMIART-Ⅱ),操作严格按照仪器及试剂盒说明进行。检测结束后计算PGⅠ/PGⅡ比值。分别对不同分期患者及健康志愿者的PGⅠ、PGⅡ、G-17、血肌酐(SCr)、尿素氨(BUN)水平进行测定。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验;相关性分析采用Pearson 相关分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 四组血清PGⅠ、PGⅡ、G-17水平的比较
1、2、3 组的PGⅠ、PGⅡ、G-17水平高于对照组,差异有统计学意义(P<0.05);3组的PGⅡ水平高于1组,差异有统计学意义(P<0.01);2、3组的G-17水平均高于1组,差异有统计学意义(P<0.01);3组的G-17水平高于2组,差异有统计学意义(P<0.01)(表1)。
表1 四组血清PGⅠ、PGⅡ、G-17水平的比较()
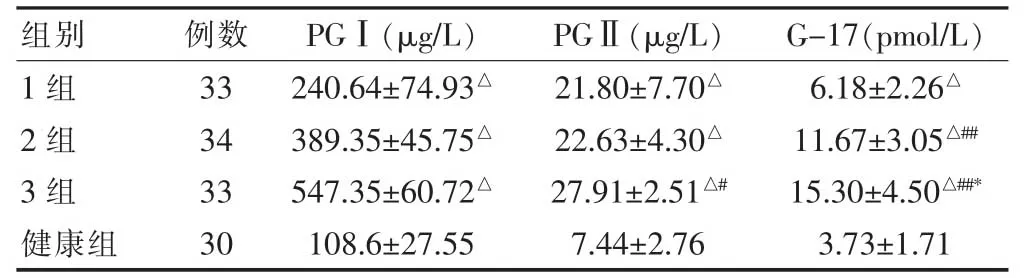
表1 四组血清PGⅠ、PGⅡ、G-17水平的比较()
与健康组比较,△P<0.05;与1组比较,#P<0.05,##P<0.01;与2组比较,*P<0.05
组别例数 PGⅠ(μg/L) PGⅡ(μg/L) G-17(pmol/L)1组2组3组健康组33 34 33 30 240.64±74.93△389.35±45.75△547.35±60.72△108.6±27.55 21.80±7.70△22.63±4.30△27.91±2.51△#7.44±2.76 6.18±2.26△11.67±3.05△##15.30±4.50△##*3.73±1.71
2.2 四组SCr、BUN水平的比较
1、2、3 组的SCr、BUN水平高于对照组,差异有统计学意义(P<0.05);3组的BUN 高于1组,差异有统计学意义(P<0.01),2组BUN 高于1组,差异有统计学意义(P<0.05)(表2)。
表2 四组Scr、BUN水平的比较()
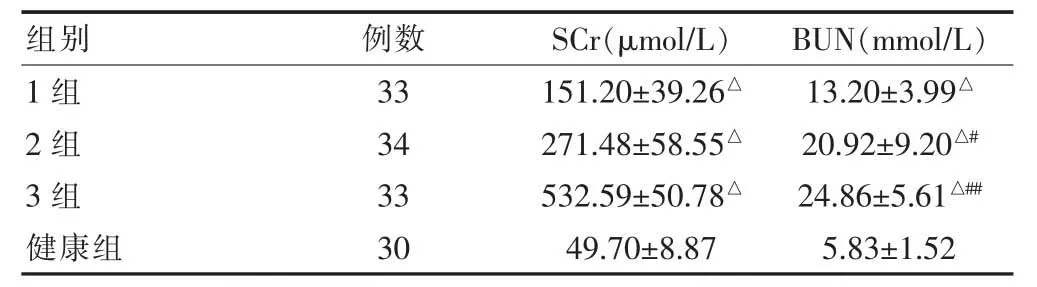
表2 四组Scr、BUN水平的比较()
与健康组比较,△P<0.05;与1组比较,#P<0.05,##P<0.01
组别例数 SCr(μmol/L) BUN(mmol/L)1组2组3组健康组33 34 33 30 151.20±39.26△271.48±58.55△532.59±50.78△49.70±8.87 13.20±3.99△20.92±9.20△#24.86±5.61△##5.83±1.52
2.3 PGⅠ、PGⅡ、G-17 与SCr 在CRF 中的相关性
血清PGⅠ、PGⅡ、G-17水平与SCr 水平在CFR中呈正相关(r=0.847,P<0.01;r=0.476,P<0.01;r=0.681,P<0.01)(表3)。
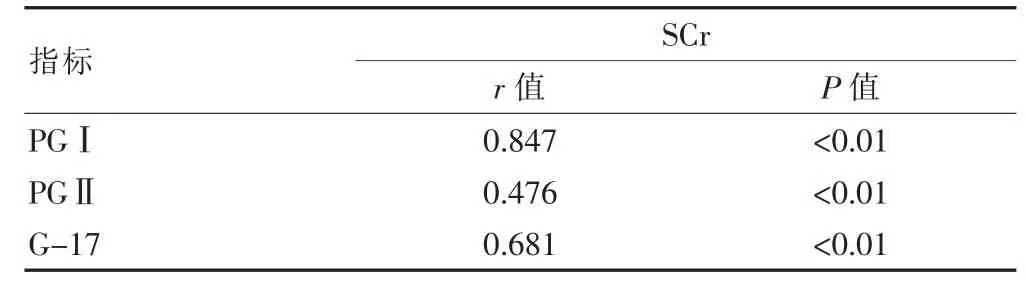
表3 PGⅠ、PGⅡ、G-17 与Scr 在CRF 中的相关性
3 讨论
胃肠道症状是一种常见的CRF 的并发症,多出现于病程早期阶段,晚期将引起恶心呕吐、体重减轻等症状[7],甚至消化道出血。胃肠道激素是一种具有特殊性的化学物质,主要存在于消化道,产生于内分泌细胞和非内分泌细胞,顺着血液循环作用于机体的各个细胞和组织,主要用于胃肠道的分泌、运动、吸收整个过程,是胃肠道进行活动的主要因子[8]。CRF时体内常出现多种胃肠激素如胃泌素、胃动素、生长抑素水平的改变及黏膜的病理损害,是产生CRF 消化道症状的基础。其中G-17是一种常见的胃肠激素,是由胃窦粘膜中的G 细胞产生,是胃窦中胃泌素(GAS)的主要形式,具有促进胃酸及胃蛋白酶分泌、营养胃黏膜、促进胃肠道平滑肌的收缩、松弛幽门括约肌等多种生理功能。血清G-17水平取决于胃内酸度及胃窦G 细胞数量[9]。胃蛋白酶原是胃液中胃蛋白酶的无活性前体,可分为PGⅠ和PGⅡ两种生化和免疫活性不同的亚型。其中PGI 由胃体粘膜主细胞与颈粘液细胞所分泌,PGⅡ由全胃腺和近端十二指肠Brunner 腺分泌[10]。PGⅠ是检测胃泌酸腺细胞功能的指标,胃酸分泌增多,PGⅠ增高胃酸分泌减少或胃黏膜腺体萎缩均导致PGⅠ降低[11]。PGⅡ与胃底黏膜病变的相关性较大,其升高与胃底腺管萎缩、胃上皮化生或假幽门腺化生、异性增殖有关[12]。当胃粘膜发生病理变化时,血清PG 含量也随之改变[13]。综上所述,PG 和G-17均为胃黏膜细胞所分泌,当胃黏膜发生病变时,黏膜细胞的分泌功能异常,血清PG、G17 含量也发生变化[14]。本研究结果显示,差异有统计学意义(P<0.05);3组的PGⅡ水平高于1组,差异有统计学意义(P<0.01);2、3组的G-17水平均高于1组,差异有统计学意义(P<0.01);3组的G-17水平高于2组,差异有统计学意义(P<0.01)。提示不同CKD分期其G-17、PGⅠ、PGⅡ水平存在差异性,这也与既往研究相一致[15],且随着病情的加重,G-17、PGI 升高更明显。在相关性分析研究中,血清PGⅠ、PGⅡ、G-17水平与SCr 水平在CFR 中呈正相关,差异有统计学意义(P<0.01)。正常情况下,分子量较小的PGⅠ、PGⅡ能够自由通过肾小球基底膜,而肾脏又是胃泌素降解和排泄的主要器官,在肾功能受损加重,肾小球滤过率降低,使G-17、PG 的排泄减少所致。
综上所述,目前在临床上对CRF 消化系统的疾病多采用电子胃肠镜的来确诊,此种检查方法价格昂贵、痛苦大,较难为患者所接受,本研究将G-17、PGⅠ、PGⅡ做为新的标志物来筛选CRF 合并胃部疾病,具体简便、快速、便于动态监测、重复性好等优点,为今后中西医结合治疗早期CRF 合并消化道症状患者提供一定的依据,且能为疗效的判定提供一种量化的指标,但本研究样本量较少,研究结果有一定的局限性,有待于进一步深入研究。
