乳腺癌术后局部区域复发患者预后的影响因素观察
2021-04-25胡松
胡 松
湖北省荆州市第三人民医院普外科,湖北荆州 434001
乳腺癌在欧美国家患病率非常高,近年来,国内乳腺癌患病率也呈逐年增高趋势[1]。目前,手术切除仍是治疗该病的主要方式,但部分患者治疗后,出现了局部复发现象,提示治疗失败[2]。有研究表明,局部复发大多出现于初次干预后2年内,且单纯局部复发较少,大部分患者伴有病灶转移[3-4]。乳腺癌局部复发患者预后大多不佳,因此完善对其预后评价的因素分析,可为临床提供关键指导。本研究旨在观察乳腺癌术后局部区域复发患者的临床特征,并分析患者预后的影响因素,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月~2019年10月荆州市第三人民医院普外科收治的98例乳腺癌术后局部区域复发患者的临床资料。患者年龄34~76岁,平均(50.35±11.68)岁;月经状态:未绝经45例,绝经53例;术后无瘤生存间期:≥2年47例,<2年51例;辅助放疗:有72例,无26例;术后化疗:有75例,无23例;局部复发类型:区域淋巴结35例,胸壁弥漫性26例,胸壁单个37例;孕激素受体:阳性34例,阴性64例;淋巴结转移:有57例,无41例;原发瘤临床分期:Ⅰ期23例,Ⅱ期48例,Ⅲ期27例;胸壁复发灶最大径:≥3 cm 42例,<3 cm 56例;后续是否行手术:是37例,否61例;病理类型:导管原位癌31例,浸润性导管癌57例,其他10例。本研究经荆州市第三人民医院医学伦理委员会审核并批准。
1.2 纳入及排除标准
纳入标准:①既往有乳腺癌手术治疗史,复查时提示存在局部区域复发;②既往接受手术与规范性治疗;③病例资料齐全;④女性患者。
排除标准:①合并其他部位的原发性肿瘤者;②术前新辅助化疗史。
1.3 方法
1.3.1 原发灶治疗 98例患者均行原发灶手术治疗,包括乳房根治术67例,改良根治术17例,扩大根治术14例。其中75例术后行辅助化疗,使用蒽环类药22例,无蒽环类药53例。有72例术后行辅助放疗,14例照射部位为内乳区、锁骨上方以及胸壁,55例照射部位为内乳淋巴引流区、锁骨上方,3例为锁骨上、胸壁。
1.3.2 研究方法 收集所有纳入者的临床资料,包括年龄、月经状态、术后无瘤生存间期、辅助放疗、辅助化疗、局部复发类型、孕激素受体、淋巴结转移、原发瘤临床分期、胸壁复发灶最大径、病理类型、泌乳素(PRL)水平、癌胚抗原(CEA)水平;血清指标均于患者术后收集其空腹静脉血5 mL,离心后采用放射免疫法检测PRL 水平,采用电化学发光法检测CEA 水平,仪器均为美国雅培公司生产的i2000型全自动微粒子发光免疫分析仪,试剂盒购自雅培公司。根据患者6个月内的预后情况,分成生存组和死亡组,比较两组临床资料,分析患者预后的影响因素。经COX回归模型分析患者预后的影响因素。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验;经COX回归模型分析患者预后的影响因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 乳腺癌术后局部区域复发患者生存曲线图分析
随访6个月,有79例生存,19例死亡,生存曲线见图1。
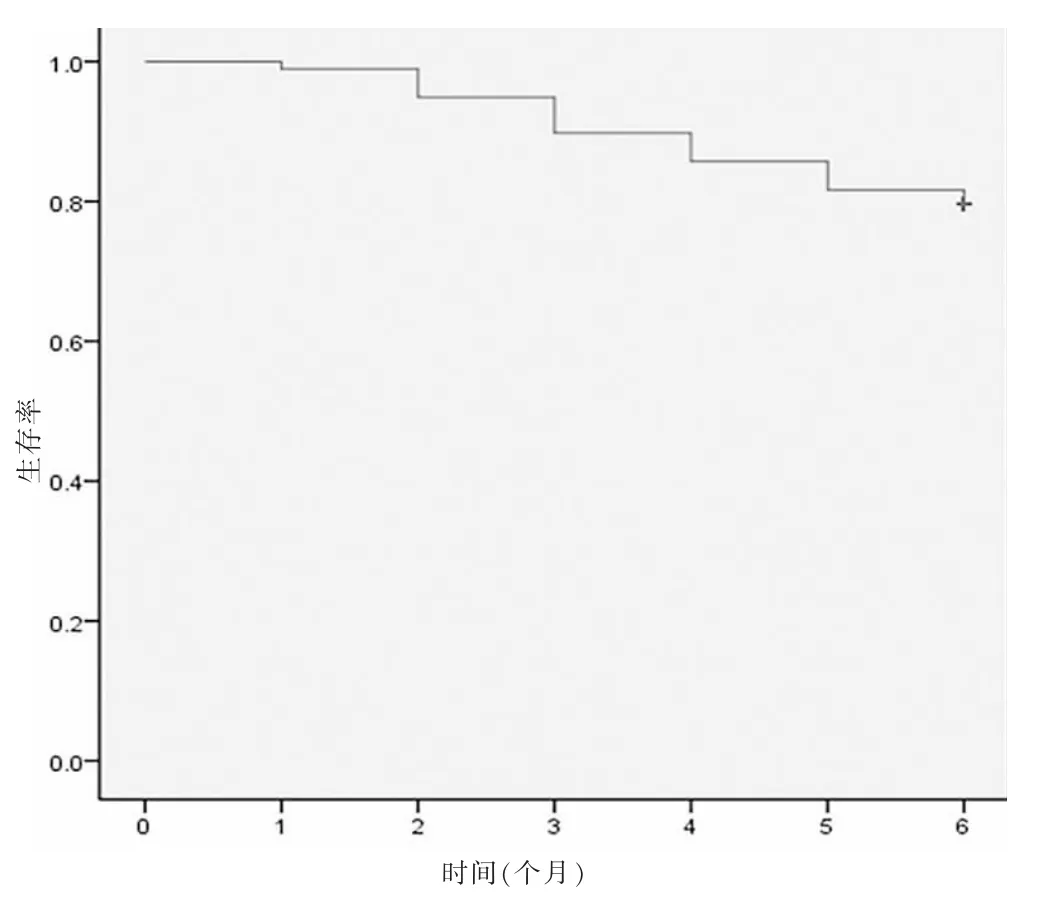
图1 乳腺癌术后局部复发患者生存曲线图
2.2 影响乳腺癌术后局部区域复发患者预后的单因素分析
单因素分析结果显示,死亡组和生存组术后无瘤生存间期、局部复发类型、淋巴结转移、后续手术及PRL≥457.35 mIU/mL、CEA≥1.35 ng/mL 占比比较,差异有统计学意义(P<0.05)(表1)。
2.2 影响乳腺癌术后局部区域复发患者预后的多因素COX回归模型分析
将乳腺癌术后局部区域复发患者是否死亡作为因变量,单因素分析中有统计学意义的因素作为自变量进行COX回归模型分析。对变量进行赋值,以术后无瘤生存间期(≥2年=0,<2年=1)、局部复发类型(区域淋巴结=0,胸壁弥漫性=1,胸壁单个=2)、淋巴结转移(无=0,有=1)、后续手术(无=0,有=1),PRL(<457.35 mIU/mL=0,≥457.35 mIU/mL=1)、CEA(<1.35 ng/mL=0,≥1.35 ng/mL=1)为自变量分别用X1、X2、X3、X4,X5、X6表示;以预后(生存=0,死亡=1)为因变量,用Y表示。COX回归模型分析结果显示,术后无瘤生存间期<2年、胸壁弥漫性复发、淋巴结转移、PRL≥457.35 mIU/mL、CEA≥1.35 ng/mL是导致死亡的危险因素(P<0.05),而后续手术能降低死亡风险(P<0.05)(表2)。
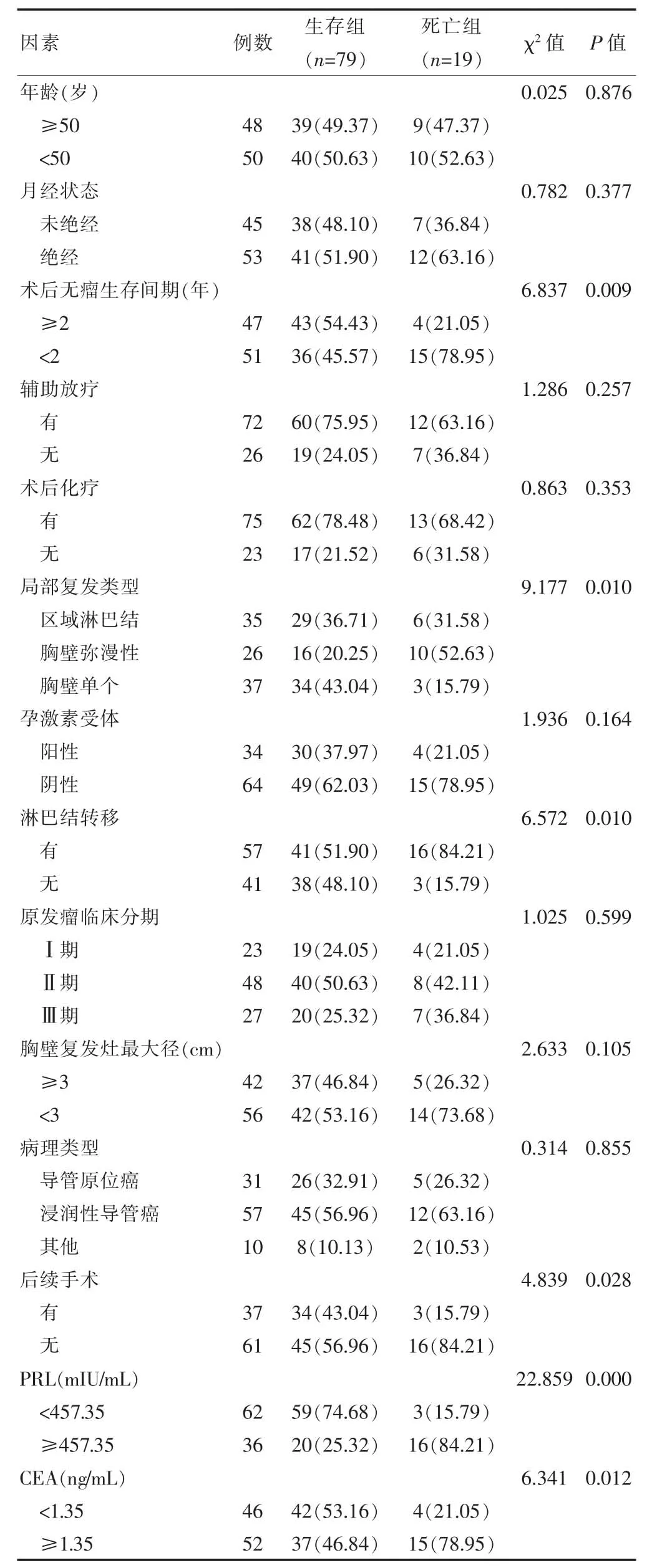
表1 影响乳腺癌术后局部区域复发患者预后的单因素分析[n(%)]
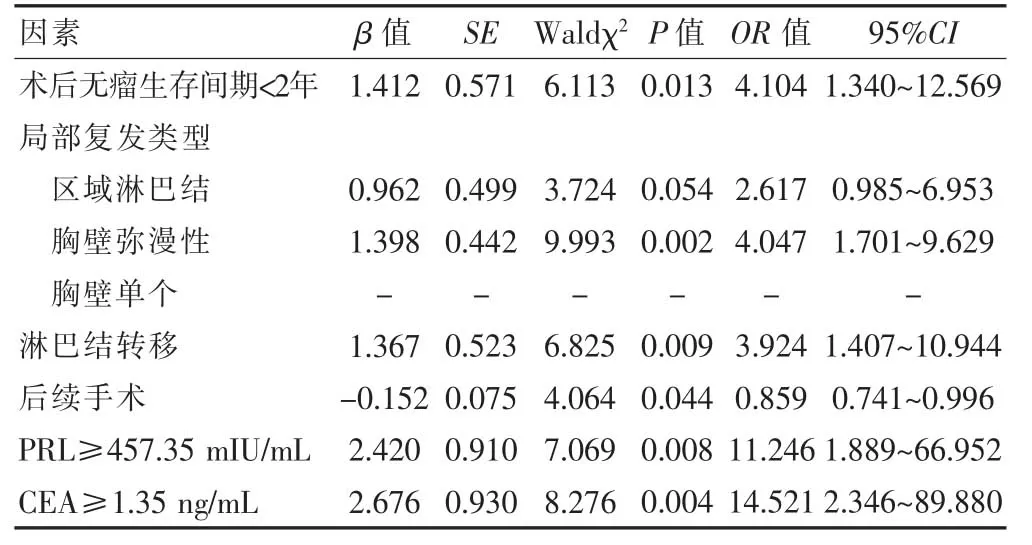
表2 影响乳腺癌术后局部区域复发患者预后的多因素COX回归模型分析
3 讨论
乳腺癌在全球患病率均较高,起初仅依赖于手术治疗,现阶段,临床对该病的治疗方式越来越丰富,包括放疗、化疗、手术治疗等,通常行综合治疗干预,改善其生存质量[5-6]。随着治疗技术的发展,乳腺癌生存率较过去有很大提升,但术后病灶转移、复发仍对其预后影响较大[7]。乳腺癌复发后,临床关于其是否再次行手术治疗仍存在争议。研究发现,部分局部复发者经全身或局部综合干预后,仍进展成远处转移,增加死亡风险[8-11]。
本研究结果显示,患者预后主要与无瘤生存间期、胸壁弥漫性复发、淋巴结转移、后续手术存在关联。其中无瘤生存间期<2年、胸壁弥漫性复发是患者死亡的危险因素。这类患者复发病灶的负荷大,且病灶复发范围广,不容易清除,不建议再次行手术治疗[12-13]本研究结果显示,淋巴结转移与患者预后密切相关。曹博等[14]研究发现,在行乳腺癌切除术后,若患者出现局部复发,则提示已存在潜在远处转移,且复发可能是病灶转移的一种表现,在远处转移病例中,60%~80%的患者死亡。提示出现远处转移者的死亡率较高,为本次结论提供了支持。本研究结果显示,后续手术的实施可降低近期死亡风险。原因可能在于,后续实施手术,有利于病灶进一步清除,从而改善预后。然而,后期是否行手术,需要根据患者的术后无瘤生存间期、局部复发类型进行考虑。有研究发现[15-16],胸壁复发灶最大径与乳腺癌复发患者预后存在关联,病灶越大,复发风险越高,则会进一步增加死亡风险。本研究则未体现这点,可能与所选病例数少有关,且因随访时间短,可能导致研究结论产生差异。
PRL 作为一种包含199个氨基酸的单链多肽,其生理功能为促进乳腺的发育和维持哺乳期泌乳,而大部分乳腺癌组织中存在PRL受体,当PRL 与PRL受体结合后可加速乳腺癌细胞的生长、繁殖,并加速其浸润和转移,同时癌细胞自身也可通过自分泌或旁分泌途径生成PRL 并合成PRL 诱导蛋白,进一步促进乳腺癌发展,因而PRL 水平的异常升高即可提示乳腺癌有发生转移和复发的风险。CEA 广泛存在于肺癌、乳腺癌、胃癌等腺癌患者血清中,可帮助判断恶性肿瘤发展程度,当癌灶手术进行彻底时,通常CEA 浓度会发生下降,但手术一段时间后仍为发生下降提示肿瘤可能存在远处转移或复发风险,需引起临床医师关注。
综上所述,乳腺癌术后局部区域复发后续是否行手术治疗主要与术后无瘤生存间期、局部复发类型有关,临床需引起重视。此外,患者预后受多种因素影响,包括术后无瘤生存间期、局部复发类型、淋巴结转移、后续手术。
