植物microRNAs在干旱胁迫响应中的研究进展
2021-04-25张豪洋金伊楠孙燕鑫李子玮郭笑恒许自成
张豪洋, 金伊楠, 孙燕鑫, 李子玮, 郭笑恒, 许自成
(河南农业大学烟草学院, 郑州 450002)
干旱是最常见的非生物胁迫之一,严重影响植物的生长和发育,了解植物的抗旱性对提高作物产量非常重要[1]。植物在进化过程中形成了不同的抗旱机制,通常可分为4种类型:逃旱、避旱、耐旱和旱后恢复[2]。逃旱是指自然或者人为因素使植物逃离干旱敏感的发育阶段(如生殖生长阶段等),这一类型主要在干旱胁迫不太严重时发生;避旱是指避免干旱,通过调整某种形态学结构或生长速率来维持植物高组织水势,这一类型多发生在轻度和中度干旱胁迫[3];耐旱是指通过抑制蒸腾作用尽量减少水分损失,通过渗透作用增加细胞弹性和通过膨压降低细胞大小,从而增强植物对干旱的耐受性,该机制多发生在植物重度干旱胁迫条件下[4];旱后恢复是指植物受重度干旱胁迫后,叶片在完全脱水的条件下仍维持关键细胞生理代谢的功能,并在复水后快速恢复生长。研究发现许多抗旱相关基因,如转录因子相关基因ERF、DREB、MYB和NAC等,抗氧化代谢相关基因GMPase、CuZnSOD,渗透调节相关基因BADH、P5CS,相关功能蛋白基因LEA、FBA和HSP等[5]。然而,一些抗旱基因过表达的转基因植物并没有表现出显著的抗旱性,这说明植物响应干旱胁迫的机制是一个极其复杂的过程。
miRNAs表达是在植物遭受干旱胁迫期间发现的,这一发现有助于了解植物应对干旱的机制,并针对性地开发新的抗旱作物[6]。本文从miRNAs的发现、合成及作用机制,响应干旱胁迫的miRNAs种类及其靶基因、miRNAs介导干旱胁迫的响应机制等方面进行了综述,并对miRNAs在植物干旱胁迫中的研究方向和应用前景进行了展望。
1 miRNAs的发现、合成及作用机制
1.1 miRNAs的发现
1993年miRNA首次在线虫中被发现,当时普遍认为其是一种小分子RNA,2001年miRNAs被正式命名为一类具有调控功能的RNA[7]。目前,在72种植物中已鉴定出7 385种成熟miRNAs和6 150种前体miRNAs(pre-miRNAs)[8]。miRNAs是一种单链内源性非编码RNA,大小通常在20~24 nt之间,它们影响植物生长的多个过程,如根、茎、叶和花等器官的发育。研究表明,miRNAs在植物应答生物和非生物胁迫的反应中起着关键作用[9]。
1.2 miRNAs的合成
miRNAs是由基因转录而来的,但是转录产物并没有被翻译成蛋白质。原始转录本(pri-miRNAs)与自身碱基配对形成包含茎环和双链RNA片段的结构,然后由RNase Ⅲ酶[在植物中称为DCL1(dicer-like1),在动物中称为Drosha]将其加工成约70 nt的茎环结构,在动植物体内,miRNA/双工miRNA由DCL1在细胞核中加工而成[10]。“miRNA”指的是将成为miRNA的那条链,“双工miRNA”指的是与miRNA互补的那条链。每条链都经甲基化后被运送到细胞质,随后miRNA/双工miRNA被整合到RISC(RNA-induced silencing complex)蛋白质复合物中,这是一个包含一股miRNA或siRNA(small interfering RNA)的多蛋白复合体[11]。miRNA/双工miRNA被整合到RISC中之后,通过与mRNA配对来引导AGO降解靶基因或抑制靶基因的翻译。
1.3 miRNAs的作用机制
miRNAs对靶mRNA表达和调控主要通过两个机制进行,即靶mRNA的裂解和翻译抑制。miRNAs及其靶基因结合位点之间的互补程度决定了其作用方式,高互补性的miRNAs介导靶基因的切割,而互补性较差的miRNAs则介导翻译抑制[12]。在大多数植物中,miRNAs的靶基因位于ORFs(open-reading frame)的开放阅读框,偶尔也位于5′末端的UTR区、3′末端的UTR区以及非编码RNA中[13]。研究表明,在某些情况下裂解和翻译抑制可能重叠,miRNAs对mRNA表达的调节受不同机制的影响,其中包括内切核酸酶裂解、翻译表达或两者的结合[14]。综上所述, miRNAs可能通过上述机制来调节靶基因的表达,且miRNAs调控机制对植物生长发育和非生物胁迫响应都有重要影响。
2 响应干旱胁迫的miRNAs
2.1 响应干旱胁迫的miRNAs表达谱分析
高通量测序技术(high-throughput sequencing)是传统测序基础上的一次革命性改变,可同时对数百万个短序列读长进行测序,这使得对一个物种的转录组和基因组进行细致全貌的分析成为可能[15]。相关研究人员利用高通量测序技术,在干旱胁迫和ABA处理后发现了大量参与豆科植物特有细胞过程的miRNAs。Kulcheski等[16]利用高通量测序技术在大豆中鉴定出了256个干旱敏感型或耐旱型miRNAs,其中有71个是保守的miRNAs。另有研究发现了22个保守的miRNAs家族和4个新的miRNAs家族中的121个miRNAs变体。对其中的11个miRNAs进行分析发现,干旱胁迫下大多数miRNAs在敏感的基因型中表达上调,而在耐受的基因型中表达下调,miRNAs在两种基因型中的不同表达可能与其调控的基因抗旱性有关。同样,Barrera-Figueroa等[17]利用高通量测序技术从2个豇豆基因型(抗旱和敏感)的sRNA库中鉴定出89个家族的157个miRNAs,通过比较干旱胁迫处理和对照处理植物的表达水平,确定了28个家族的44个miRNAs可响应干旱胁迫,其中30个miRNAs的表达上调,14个miRNAs的表达下调。结果表明,这些miRNAs家族可能参与了保守的干旱胁迫响应途径。此外,32个miRNAs具有多种预测的生理功能,这些预测目标大部分是转录因子。Liu等[15]对干旱敏感的番茄基因型M82和IL9-1幼苗进行干旱处理,发现干旱胁迫下IL9-1的存活率和H2O2消除方面表现优于M82,并利用高通量测序技术构建了4个sRNA和8个mRNA文库,鉴定出105个保守的miRNAs和179个新的miRNAs,其中,在干旱胁迫下差异表达分别有54和98个;且在M82和IL9-1中分别发现2 714和1 161个在干旱胁迫下差异表达的基因,它们的许多同源基因与植物非生物胁迫有关。
数字基因表达谱(dgital gene expression profiling,DGE)利用新一代高通量测序技术和高性能计算分析技术,能够全面、经济、快速地检测某一物种特定组织在特定状态下的基因表达情况[18]。Yin等[19]为了解烟草在响应非生物胁迫过程中的转录模式,从正常和干旱胁迫的烟草根中测序并分析了3个DGE库,发现了276个响应干旱胁迫的基因,其中82个是转录因子(TFs),包括WRKY、NAC、ERF和bZIP家族;此外,鉴定出39个miRNAs家族中的122个miRNAs在干旱胁迫下差异表达,其中miR160在干旱胁迫下表达上调,且miR160的靶基因是ARF转录因子,miR395在干旱胁迫下表达下调,其靶基因尚不清楚;而一些常见的miRNAs家族(如miR159、miR169、miR402和miR408)干旱胁迫下的表达没有变化,说明文库间变化以及不同胁迫条件可能引起不同的植物反应和生理响应。
以上研究结果表明,通过高通量表达谱和数字基因表达谱分析,已发现多种植物中存在大量响应干旱胁迫的miRNAs,其中普遍响应的miRNAs包括miR156、miR159、miR160、 miR169、miR319、miR393、miR396、miR408等。
2.2 miRNAs对干旱胁迫响应的模式
2.2.1响应干旱胁迫miRNAs与植物物种依赖性
miRNAs的表达水平或对干旱胁迫响应具有物种依赖性,相同miRNAs在不同物种中的表达存在差异。例如,干旱胁迫下miR156在拟南芥(Arabidopsisthaliana)、桃树(Prunuspersica)、大麦(HordeumvulgareL.)、柳枝稷(Panicumvirgatum)和小麦(Triticumaestivum)中表达上调,但在水稻(Oryzasativa)和玉米(ZeamaysL.)中的表达下调[20]。另有研究表明,干旱胁迫下拟南芥、桃树、柳枝稷和苜蓿(Medicagotruncatula)中miR169的表达下调,但在水稻、大豆(Glycinemax)、胡杨(Populuseuphratica)和番茄(Lycopersiconesculentum)中miR169的表达上调[21]。miR1510 在大豆中表达上调,但在苜蓿中表达下调;miR396在苜蓿和豇豆(Vignaunguiculata)中表达下调,但在大豆中表达上调[22]。Lu等[23]研究发现,干旱胁迫下miR1450在野生二粒小麦中表达上调,而在毛果杨(Populustrichocarpa)中的表达下调,结果表明,miR1450受到不同植物物种的不同调控网络控制。Akdogan等[24]研究表明,干旱胁迫下miR399在玉米和小麦中表达上调,但在水稻中表达下调。另有研究表明,干旱胁迫下水稻和玉米中miR168的表达下调,而在拟南芥中miR168的表达上调[25]。
2.2.2响应干旱胁迫miRNAs与干旱胁迫条件
同一种植物的相同miRNAs在不同干旱条件下也会表现出不同的反应。Trindade等[26]研究表明,在干旱胁迫下miR398a/b在苜蓿中的表达量增加。而在Li等[27]的研究中,不同干旱胁迫条件下相同的miRNAs在苜蓿中表达水平下降,这说明了miRNAs对不同程度干旱胁迫的高度敏感性。Frazier等[28]研究表明,不同浓度聚乙二醇(polyethyleneglycol,PEG)模拟的干旱条件下,相同的miRNAs如miR167、miR172、miR393、miR395、miR396、miR398和miR399在烟草植物中表现出不同程度的上调或下调。由于不同时间和不同处理条件的作用,导致miRNAs的表达存在差异,推测可能是不同干旱胁迫条件下miRNAs调控的靶基因发生了改变,进而导致miRNAs表达的改变。Wang等[29]研究表明,在田间中度干旱胁迫条件下玉米miR156的表达下调,而在田间严重干旱胁迫条件下玉米miR156的表达上调;在PEG模拟干旱胁迫处理16 h后miR156的表达上调,而在干旱处理24 h后表达下调。以上研究结果表明,植物miRNAs在不同干旱胁迫条件下的表达存在差异。
2.2.3响应干旱胁迫miRNAs与植物组织特异性表达干旱胁迫下相同miRNAs在同种植物不同组织中的表达可能相似或者不同,同一miRNAs在不同植物相同组织中的表达可能相似或者不同。例如,miR169在水稻根中的诱导作用比在芽中更明显[30]。干旱调控的miRNAs在大麦不同组织中表达不同,如Hvu-miR166a在大麦叶片中表达上调,在根系中表达下调;Hvu-miR168-5p仅在大麦叶片中表达上调,在根组织中表达水平不变;Osa-miR393a和Hvu-miRX35在叶片中表达,但在根中不表达[31]。有研究发现,干旱胁迫下miR172在玉米根部表达下调,而在水稻和小麦叶片中miR172的表达下调,在小麦根系中miR172的表达上调[32]。以上研究结果表明,响应干旱胁迫的miRNAs在植物组织中存在特异性表达。
3 响应干旱胁迫miRNAs的靶基因
miRNAs在植物干旱胁迫中有重要的调控作用,miRNAs可通过编码功能蛋白和调控功能蛋白靶基因的上调和下调来响应干旱胁迫。一些响应干旱胁迫miRNAs的靶基因可对植物抗旱性起积极作用,另一些则起消极作用。因此,miRNAs的靶基因与植物的抗旱性息息相关。通常miRNAs的表达上调意味着在相同的环境条件下,其靶基因表达下调,反之亦然。Sunkar等[33]研究表明,过表达靶基因或降解相应的miRNAs,可增加靶基因的积累,从而提高植物抗旱性。近年来,有许多响应干旱胁迫的miRNAs及其对应的靶基因的研究报道,这些靶基因的功能各不相同(图1)[34]。
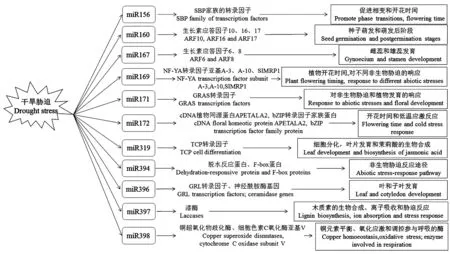
图1 干旱胁迫下miRNAs的靶基因及功能[34]Fig.1 Target genes and functions of miRNAs under drought stress[34]
3.1 miRNAs与植物激素合成
在干旱条件下,植物生长素(auxin)、赤霉素(gibberellin)和细胞分裂素(cytokinin)的浓度下降,而脱落酸(abscisic acid,ABA)和乙烯(ethylene)的内源浓度则上升[30]。miRNAs可调节植物对激素信号的响应,进而增强植株的抗旱性。Xia等[35]研究发现,miR393可调节植物生长素信号,因为miR393的过表达导致水稻对生长素合成敏感性降低,从而降低干旱胁迫下植物的生长。miR393还被证实可降解生长素受体或生长素(Aux/IAA)的阳性调节因子TIR1 (transport inhibitor response 1),从而降低生长素的浓度[36]。但miR393的具体调控机制仍有待进一步研究。Reyes等[37]发现,miR159的靶基因为MYB33和MYB101,它们是干旱胁迫下ABA合成的重要参与者。另有学者对ABA超敏突变体进行分析,发现涉及miRNAs合成的几个基因包括DCL1、HASTY、HEN1、HYL1和SE,其中DCL1和HEN1突变体在发芽过程中对ABA敏感,而SE和HASTY突变体则对高渗透和盐胁迫敏感[38]。miR156参与调控ABA和花青素的合成,进而增加花青素合成相关基因的表达水平,提高花青素含量和植物的抗旱性[39]。研究表明,拟南芥等双子叶植物在干旱胁迫下一些miRNAs(miR160、miR164、miR165和 miR166)参与调节生长素信号途径,促进植株侧根生长[40]。
3.2 miRNAs与转录因子
3.2.1miRNAs与MYB转录因子MYB是植物中最大的转录因子(transcription factor,TF)家族之一,在植物生长和发育过程中起着多方面的作用[37]。miR159的靶基因主要为MYB转录因子家族。Xue等[41]研究表明,干旱胁迫下拟南芥miR159的靶基因是MYB转录因子家族中的MYB33、MYB65和MYB101。miR159的表达下调可促进其靶基因的表达上调,靶基因的表达会促进拟南芥根部分生组织的细胞分裂,增强初级根的生长,加速细胞周期。另有研究发现,番茄miR159的靶基因是MYB转录因子(SlMYB33),该基因与脯氨酸和腐胺的积累有关,从而促进了植株对干旱胁迫的耐受性[42]。
3.2.2miRNAs与NAC转录因子NAC转录因子家族基因受microRNAs的调控,miRNA164可提高水稻抗旱性,其靶基因为NAC类转录因子[43]。水稻miR164b的靶基因为OsNAC2,OsNAC2基因的表达可提高水稻植株的抗旱性和耐盐性[43]。Shuai等[44]研究发现,干旱胁迫下毛果杨miR160和miR164的表达下调,其靶基因ARF和NAC类转录因子家族基因表达量增加;此外,毛果杨miR408、miR1444和miR394在干旱胁迫下的表达下调,其靶基因主要是脱水反应蛋白。Qiu等[45]研究发现,干旱胁迫下小麦miR160、miR164和miR398的表达下调,其靶基因为生长素反应因子(ARF22)、NAC类转录因子和Cu/Zn SOD的表达水平提高。
3.2.3miRNAs与SPL转录因子SPL(squamosa promoter-binding protein like)转录因子家族是植物特有的,主要通过结合下游基因启动子区的顺式作用元件GTAC基序,参与调控下游基因的表达。SPLs转录因子在植物生长发育和信号传导等方面有着重要作用。miR156s在植物中具有高度保守性,通过识别其转录本发现,miR156s可将SPL基因的一个子集作为目标,其中在17个拟南芥SPL中,有11个是miR156s的靶基因,在水稻中发现有11个OsSPL基因是水稻miR156的靶基因[46]。因此,miR156的靶基因主要为SPL转录因子家族。Zheng等[47]研究表明,干旱条件下,拟南芥miR156的靶基因包括3种SPL基因(SPL3、SPL9和SPL10),这些基因与促进侧根生长相关。另有研究发现,miR156的靶基因为SPL转录因子,且miR156在调节苜蓿植物发育中起着重要作用[48]。Feyissa等[49]研究发现,苜蓿miR156可调节至少7个SPL基因(SPL2、SPL3、SPL4、SPL6、SPL9、SPL12和SPL13)。此外miR156的靶基因还包括bHLH、HD-ZIP、TCP、C2H2和WRKY等转录因子家族。
3.2.4miRNAs与其他转录因子NF-Y转录因子家族参与植物生长和发育。Li等[30]研究表明,干旱胁迫下miR169的靶基因为NF-Y转录因子。生长调控因子(GRFs)是一类植物特有的转录因子家族,其中包含2个保守域QLQ和WRC,GRFs信号通路介导植物种子发育、根系生长和花的发育等重要生命过程[50]。研究表明,干旱胁迫下,水稻miR396d的靶基因是水稻生长调节因子相关基因(OsGRF),mR396d的表达下调导致靶基因的表达上调,进而有效缓解干旱对花器官发育造成的损伤[51]。HD-Zip转录因子属于Homeobox蛋白家族,由高度保守的HD(Homeodomain)结构域和Leu zipper(Zip)元件组成,前者可与DNA特异结合,后者可介导蛋白二聚体的合成[52]。HD-Zip转录因子家族包括4个亚家族(HD-Zip Ⅰ-Ⅳ)。Zhang等[52]研究表明,miR166的靶基因是HD-ZIPⅢ转录因子,通过调节靶基因HD-ZIP可促进水稻根部、分生组织和叶片的细胞发育。
3.3 miRNAs与植物抗氧化系统
抗氧化酶可清除活性氧(reactive oxygen species,ROS),增强植物对干旱胁迫的耐受性。超氧化物歧化酶(superoxide dismutase,SOD)是一种重要的ROS清除酶,在非生物胁迫中发挥重要作用,植物中的SOD根据金属配体的不同可分为3种类型,分别是铁SOD(Fe-SOD)、锰SOD(Mn-SOD)和铜锌SOD(CuZnSOD)[53]。过氧化物酶(peroxidase,POD)是以过氧化氢为电子受体催化底物氧化的酶,参与多种生理代谢,具有消除过氧化氢和酚类、胺类、醛类、苯类毒性的双重作用[54]。过氧化氢酶(catalase,CAT)与SOD和POD略有不同,非生物胁迫会破坏CAT的活性[55]。
已有研究证实miRNAs在干旱胁迫的响应主要涉及激素信号、脂质和碳水化合物代谢以及抗氧化防御等方面,其中miR528的靶基因可编码SOD和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等过氧化氢清除网络的关键酶,可缓解ROS对植株造成的损伤[53]。干旱胁迫下在水稻耐旱品种中miRNAs(如miR159f、miR397a、miR398b、miR408-3p、miR528-5p、miR1871和miR2878-5p)的表达上调,在干旱敏感型品种中表达下调,其靶基因为植物色素和Cu/Zn SOD等,可增强ROS的清除水平并促进气孔闭合[54]。miR408的靶基因为铜调控相关基因,且miR408的表达上调可增强陆地植物的抗旱性,使用qRT-PCR检测发现miR408可调控7个与干旱响应相关的基因(如DREB转录因子等)的表达[55]。干旱胁迫下红花miR398在根和叶中的表达下调,其靶基因是可清除ROS的CSD1[56]。Wei等[57]研究发现,干旱胁迫下miR168和miR528的表达下调,导致它们的靶基因丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和POD活性提高,进而增强植株的抗旱性。
4 miRNAs介导干旱胁迫的响应机制
miRNAs在植物干旱胁迫调节网络中发挥重要作用(图2)[34]。目前已报道了多种响应干旱胁迫的植物miRNAs,其响应机制的研究也在逐步开展,miRNAs介导干旱胁迫的响应机制研究主要在植物激素信号的调控方面。
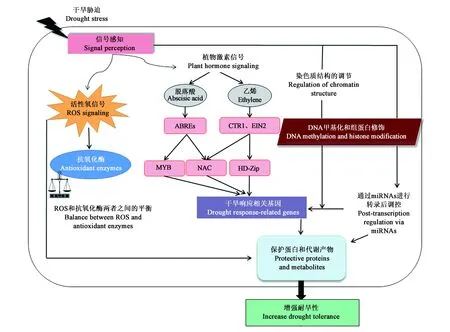
图2 干旱胁迫响应调节网络[34]Fig.2 Regulating network involved in response to drought stress[34]
4.1 脱落酸信号与miRNAs调控
ABA在植物生长发育过程中起重要作用,如种子成熟、种子萌发、幼苗生长和气孔运动等,ABA被认为是在干旱和其他非生物胁迫下对胁迫感知和响应路径中的重要信号。干旱胁迫会抑制植物侧根生长,同时将营养物质向主根运输,以便更有效地从土壤深处吸收水分。Nambara等[58]研究表明,ABA可作为植物中的特定胁迫信号,因此在干旱胁迫下根的脱水过程中会形成ABA。研究发现,ABA信号使miR393的表达上调。另有研究表明,拟南芥中的ABA 超敏感突变可增加miR393的表达水平,减少侧根生长,因此miR393可作为干旱胁迫下的根系调节剂。此外,已知miR393的靶基因还包括生长素受体TIR1和AFB[59]。大多数响应ABA信号的基因启动子中均具有保守的顺式作用元件和ABA响应元件(ABREs)。研究表明,拟南芥中miR167在干旱胁迫下表达上调,且在相应基因的启动子中具有ABREs的响应元件[60]。综上所述,miR393和miR167可用于研究干旱胁迫响应机制。ABA在植物种子中也发挥着重要作用,可促进休眠。Reyes等[37]研究表明,外源ABA或干旱处理会影响拟南芥中miR159的表达水平,miR159介导MYB转录因子的裂解,这些转录因子是植物中ABA反应的正向调节剂,因此miR159的过表达会抑制转基因植物中MYB33和MYB101基因的表达,并降低植物对ABA的敏感度。Lian等[61]研究表明,miR159的靶mRNA可调节ABA的含量,诱导干旱胁迫下的种子休眠。此外,与干旱和ABA调节相关的miRNAs包括miR168、miR169、miR319、miR396、miR397、miR2118、miR393和miR167等。其中miR168和miR396的启动子区域中包含ABRE的顺式作用元件,且干旱胁迫下促进其表达。因此,推测启动子中存在ABRE的miRNAs基因会影响植物的抗旱性[62]。以上结果揭示了miRNAs在ABA调控与植物抗旱性之间扮演着十分重要的角色。
4.2 乙烯信号与miRNAs调控
乙烯是一种结构简单的小分子化合物,参与植物的生长发育过程,且与植物抵御干旱胁迫的响应机制密切相关。通常情况下,干旱胁迫诱导高等植物体内乙烯含量增加。有研究表明,叶片衰老是抗旱的响应机制之一,因为叶片衰老可减少树冠的大小和蒸腾作用,使水分和养分流向生殖器官,miRNAs可能参与植物叶片衰老的调控过程[27]。Kim等[63]研究发现,拟南芥中乙烯信号蛋白EIN2(ethylene insensitive 2)会下调干旱胁迫下衰老叶片中miR164的表达,这使NAC1、ORE1和At5g61430等基因的表达水平上调,因此miR164可作拟南芥叶片衰老的调节剂。进一步研究发现,miR164的过表达或抑制会影响其靶基因ORE1的表达,延长拟南芥叶片寿命。
当植物受到干旱胁迫刺激时,会促进超氧化物阴离子和过氧化氢等ROS物质的生成,而ROS可作为信号分子刺激乙烯合成酶的活性提高,进而促进乙烯合成,增强植株的抗旱性[64]。研究表明,当乙烯信号缺失时,乙烯受体活化激酶CRT1可调控下游的乙烯反应途径,番茄CTR家族有SlCTR1、2、3和4四个成员,干旱胁迫下miR1917可调控其靶基因乙烯信号负调控因子SlCTR4的可变剪切体SlCTR4sv1和SlCTR4sv2基因的表达,参与乙烯信号的转导调控[65]。研究发现,干旱胁迫下HD-Zip转录因子编码的Hahb-4基因表达上调,且Hahb-4基因在乙烯介导的叶片衰老过程中表达上调,该基因的过表达会增强植物对干旱胁迫的耐受性[66]。以上结果表明,乙烯信号参与调控miR164和miR1917的表达,进而调节植物对干旱胁迫的抗性。
5 展望
多变的气候条件和环境非生物胁迫是农业生产所关注的重点问题,干旱是限制全球农作物生产和产量的重要非生物胁迫之一。miRNAs参与调控植物对干旱胁迫的响应,但是其过程非常复杂。因此,对干旱胁迫下不同植物物种miRNAs的表达谱进行研究是至关重要的,通过表达谱分析可探究植物在抵御干旱胁迫过程中miRNAs的保守性和物种特异性。然而植物的抗旱机制是十分复杂的过程,每个内源性miRNAs可调控多个基因,不同的基因又有着不同的功能,且某些基因可由多个miRNAs调控,这正是现阶段miRNAs参与干旱胁迫的作用机制及其靶基因的调控网络尚未十分清楚的主要原因。因此,尽管目前已从多种植物中鉴定出许多miRNAs,且其中部分miRNAs已被证明受干旱调控,但这些miRNAs的靶基因及其具体调控机制仍是未知的,需进一步研究。只有了解miRNAs如何响应干旱胁迫才能知道miRNAs对干旱胁迫的响应机制,所以,未来的主要研究方向将是在挖掘响应干旱胁迫miRNAs的靶基因,探究miRNAs调控基因中的顺式调控元件的特征以确定相关转录因子,探索干旱胁迫调控miRNAs的机制以及靶基因的功能与植物干旱胁迫应答网络关键因子间的相互作用,构建植物抗旱microRNAs资源库等。这将有助于鉴定miRNAs的抗旱能力以及进一步探究植物在干旱胁迫下基因表达调控作用机制,为通过分子育种和改良培育新型抗旱植物品种提供参考。
