干旱胁迫对栀子内源激素含量的影响
2021-04-25王得运刘培培陈云婷徐月莹周丽罗光明
王得运, 刘培培, 陈云婷, 徐月莹, 周丽, 罗光明*
(1.江西中医药大学药学院, 南昌 330004; 2.江西科技师范大学, 南昌 330038)
干旱是影响植物正常生长发育的主要非生物因子之一,其危害程度在诸多非生物胁迫中占首位[1]。全球干旱、半干旱地区约占土地总面积的36%,占耕地面积的43%。我国干旱、半干旱地区占国土总面积的45%,占耕地面积的51%,即使在降水较多的地区也经常出现由于不均匀降水而造成的干旱灾害[2-3]。目前,随着全球气候变暖且不断加剧,植物遭受干旱胁迫的现象普遍存在。植物在遭受到干旱胁迫后,内源激素作为植物响应干旱胁迫最敏感的生理活性物质,其含量与平衡会发生一系列变化,多种内源激素以复杂方式协调作用,共同响应干旱胁迫[4]。
栀子(GardeniajasminoidesEllis)在我国药用历史悠久,最早记载于《神农本草经》,是卫生部发布的第一批药食两用植物。栀子果实具有泻火除烦、清热利湿、凉血解毒之功效,主治热病心烦、湿热黄疸、淋证涩痛、血热吐衄、目赤肿痛、火毒疮疡以及外伤扭挫伤痛[5]。栀子根是畲族常用药材,在浙江、福建、湖南等地主要用来治疗乙型肝炎、丙型肝炎、黄疸型肝炎、肾炎水肿、感冒高热等病症[6]。同时,栀子果实中含有丰富的色素,广泛用于饮料、食品、日用化工和化妆品等领域。因栀子用途广、需求量大,在我国江西、湖南、湖北、福建、浙江、安徽、四川以及贵州等地大量种植生产,安徽、江苏、河南和山东等地也有种植[7]。目前,我国人工种植栀子面积高达1.7万hm2,年产栀子近4万t[8]。
本研究采用PEG-6000溶液模拟干旱胁迫,探讨了不同干旱程度下栀子幼苗叶片脱落酸(abscisic acid,ABA)、生长素(indoleacetic acid,IAA)、赤霉素(gibberellic acid,GA)以及玉米素核苷(zeatin riboside,ZR)四种内源激素的含量水平及变化规律,分析并讨论了栀子在激素水平上对干旱胁迫的生理响应,旨在为激素在植物响应干旱化学调控机理研究和栀子抗旱性深入研究提供理论依据。
1 材料与方法
1.1 试验材料
选用1年生栀子幼苗为材料,由江西普正制药有限公司所建设的繁育基地提供。2019年3月,将栀子幼苗自苗圃地带土移植到白色聚乙烯塑料花盆中,花盆高29 cm,直径为23 cm,栽培基质为普通园圃土。
1.2 试验方法
1.2.1栀子幼苗干旱模型的建立与取样所有盆栽幼苗正常管护30 d,缓苗后,新老叶出现更替、萌发新芽,生长速度明显加快。选取长势基本一致且无病虫害的栀子幼苗40盆,每10盆为1个处理组。以质量分数分别为5%、10%、20%的PEG-6000溶液模拟栀子幼苗轻度干旱(light droght,LD)、中度干旱(moderate droght,MD)、重度干旱(severe droght,SD)胁迫,蒸馏水作为正常对照(CK)。每天傍晚每组用对应的PEG-6000溶液进行浇灌,浇灌量以盆底溢出溶液为准。干旱胁迫的第5、10、15 d,栀子幼苗生长状态良好、无萎蔫现象。在干旱胁迫的第5、10、15 d的同一时间段采摘栀子上部相同叶位的成熟叶片,存放于-80 ℃冰箱内。
1.2.2栀子叶片中内源激素含量测定称取1.0 g叶片,加4 mL 80%甲醇提取液(内含0.5% BHT抗氧化剂),冰浴研磨,转移至10 mL离心管,摇匀置于4 ℃冰箱浸提过夜,3 500 r·min-1离心,取上清液,再加入2 mL提取液,摇匀,置于4 ℃冰箱4 h,离心,合并上清液。上清液过C-18固相萃取柱得到待测样品,将待测样品用氮气吹干,以样品稀释液定容。然后采用酶联免疫法测定ABA、IAA、GA和ZR含量,测定步骤与所需试剂均来自试剂盒(购自南京建成生物工程研究所),试验设3次生物学重复。
1.3 数据处理
采用WPS表格和Graphpad Prism 7.0软件处理试验数据。
2 结果与分析
2.1 干旱胁迫对栀子叶片ABA含量的影响
图1显示,随着干旱胁迫时间的延长,CK组栀子叶片ABA含量呈现逐渐下降的趋势,LD、MD、SD 3组ABA含量均呈先升高后下降的变化趋势。但与CK组相比较,LD、MD组栀子叶片ABA含量在干旱胁迫第5、10、15 d逐渐上升,SD组ABA含量先上升后在胁迫15 d时上升幅度降低。干旱胁迫第5 d,LD、MD、SD组栀子叶片ABA含量较CK组分别上升了60.29%、84.50%、89.93%;在胁迫第10 d,LD、MD、SD组ABA含量较CK组分别上升了133.96%、153.97%、120.04%;胁迫第15 d,LD、MD与SD 3组ABA含量较CK组分别上升了185.93%、154.59%、69.52%。
2.2 干旱胁迫对栀子叶片IAA含量的影响
图2显示,试验过程中CK组栀子叶片IAA含量逐渐上升。LD、MD、SD 3组IAA含量在干旱胁迫第5 d高于CK组,后逐渐下降,在胁迫第15 d显著低于CK组。在干旱胁迫第15 d时,CK组栀子叶片IAA含量较胁迫第5、10 d分别上升了171.25%、110.80%。干旱胁迫第5 d,LD、MD、SD组栀子叶片IAA含量较CK组分别上升了45.71%、244.61%、225.18%,其中,MD、SD组与CK组相比差异显著(P<0.05);在胁迫第10 d,LD、MD、SD组IAA含量较CK组分别上升了26.36%、10.12%、37.84%,但差异不显著(P>0.05);胁迫第15 d,LD、MD与SD 3组IAA含量较CK组分别下降了36.25%、51.11%、57.15%,并具有显著性差异(P<0.05)。

注:同一处理时间不同小写字母表示差异在P<0.05水平具有显著性。Note: Different small letters at the same treatment time indicate significant difference at P<0.05 level.图1 干旱胁迫下栀子叶片ABA含量Fig.1 ABA content of Gardenia jasminoides Ellis leaf under drought stress

注:同一处理时间不同小写字母表示差异在P<0.05水平具有显著性。Note: Different small letters at the same treatment time indicate significant difference at P<0.05 level.图2 干旱胁迫下栀子叶片IAA含量Fig.2 IAA content of Gardenia jasminoides Ellis leaf under drought stress
2.3 干旱胁迫对栀子叶片GA含量的影响
图3显示,随着干旱胁迫时间的延长,与CK组相比,LD、MD、SD三组栀子叶片GA含量在胁迫第5 d显著升高,后逐渐降低,在胁迫第15 d时低于CK组。干旱胁迫的第5 d,LD、MD、SD组栀子叶片GA含量较CK组分别上升了56.06%、130.90%、62.40%,均差异显著(P<0.05);在胁迫第10 d,LD、MD、SD组GA含量较CK组分别上升了28.37%、5.33%、34.49%,差异不显著(P>0.05);胁迫第15 d,LD、MD与SD 3组GA含量较CK组下降了12.92%、27.56%、71.54%,且SD组与CK组相比差异显著(P<0.05)。

注:同一处理时间不同小写字母表示差异在P<0.05水平具有显著性。Note: Different small letters at the same treatment time indicate significant difference at P<0.05 level.图3 干旱胁迫下栀子叶片GA含量Fig.3 GA content of Gardenia jasminoides Ellis leaf under drought stress
2.4 干旱胁迫对栀子叶片ZR含量的影响
图4显示,随着干旱胁迫时间的延长,CK组栀子叶片ZR含量逐渐下降,LD、MD、SD 3组ZR含量具有高-低-高的变化趋势。在干旱胁迫第15 d时,CK组栀子叶片ZR含量较第5、10 d分别下降了55.13%、41.15%。干旱胁迫第5 d,LD、MD、SD组栀子叶片ZR含量较CK组分别上升了85.60%、41.85%、27.19%,均差异显著(P<0.05);在胁迫第10 d,MD组ZR含量较CK组上升了4.74%,LD、SD组ZR含量较CK组下降了14.12%、16.36%,均差异不显著(P>0.05);胁迫第15 d,LD、MD与SD3组ZR含量较CK组上升了174.66%、248.51%、205.30%,差异显著(P<0.05)。
2.5 干旱胁迫对栀子叶片中内源激素比例的影响
表1显示,随着干旱胁迫时间的延长,CK组栀子叶片IAA/ABA、IAA/GA、IAA/ZR值逐渐上升,ZR/ABA值波动不大,GA/ABA、GA/ZR值呈现先降低后升高的变化趋势。LD、MD、SD 3组栀子叶片IAA/ABA、GA/ABA、ZR/ABA值呈现先降低后升高的变化趋势,IAA/GA值逐渐上升,IAA/ZR、GA/ZR值逐渐下降。干旱胁迫第5 d,LD、MD、SD组栀子叶片IAA/ABA值总体高于CK组;而在胁迫第15 d,LD、MD、SD组IAA/ABA值较CK组分别降低了77.67%、80.83%、76.67%。胁迫第5 d,LD、MD、SD组栀子叶片GA/ABA值与CK组相比变化不大;而在胁迫第15 d,LD、MD、SD组GA/ABA值较CK组分别降低了69.54%、71.57%、83.21%。干旱胁迫第5 d,LD组栀子叶片ZR/ABA值高于CK组,MD、SD组低于CK组;然后,3组先降低再升高,在胁迫第10 d有最低值;胁迫第15 d时,LD组ZR/ABA值较CK组下降了3.94%,MD、SD组较CK组分别上升了36.91%、80.10%。胁迫第5 d,LD、MD、SD组栀子叶片IAA/GA值总体高于CK组;胁迫第10 d,LD、MD、SD组IAA/GA值与CK组接近;胁迫第15 d,LD、MD组IAA/GA值低于CK组,SD组高于CK组。胁迫第5 d,LD、MD、SD组栀子叶片IAA/ZR值总体高于CK组;随后,CK组IAA/ZR值逐渐上升,LD、MD、SD组总体逐渐下降;在胁迫第15 d,LD、MD、SD组IAA/ZR值较CK组分别降低了75.38%、85.79%、85.79%。胁迫第5 d,LD组栀子叶片GA/ZR值低于CK组,MD、SD组高于CK组;随后,LD组先升高后降低,MD、SD组逐渐降低;在胁迫第15 d,LD、MD、SD组GA/ZR值均低于CK组,并较CK组分别下降了68.27%、79.21%、90.66%。总的来说,干旱胁迫下栀子IAA/ABA、GA/ABA值逐渐下降,并且下降幅度较大,ZR/ABA、IAA/GA、IAA/ZR、GA/ZR值发生不同的波动,说明栀子通过调节内源激素含量变化以维持内源激素间的一种平衡来适应和抵御胁迫。

注:同一处理时间不同小写字母表示差异在P<0.05水平具有显著性。Note: Different small letters at the same treatment time indicate significant difference at P<0.05 level.图4 干旱胁迫下栀子叶片ZR含量Fig.4 ZR content of Gardenia jasminoides Ellis leaves under drought stress
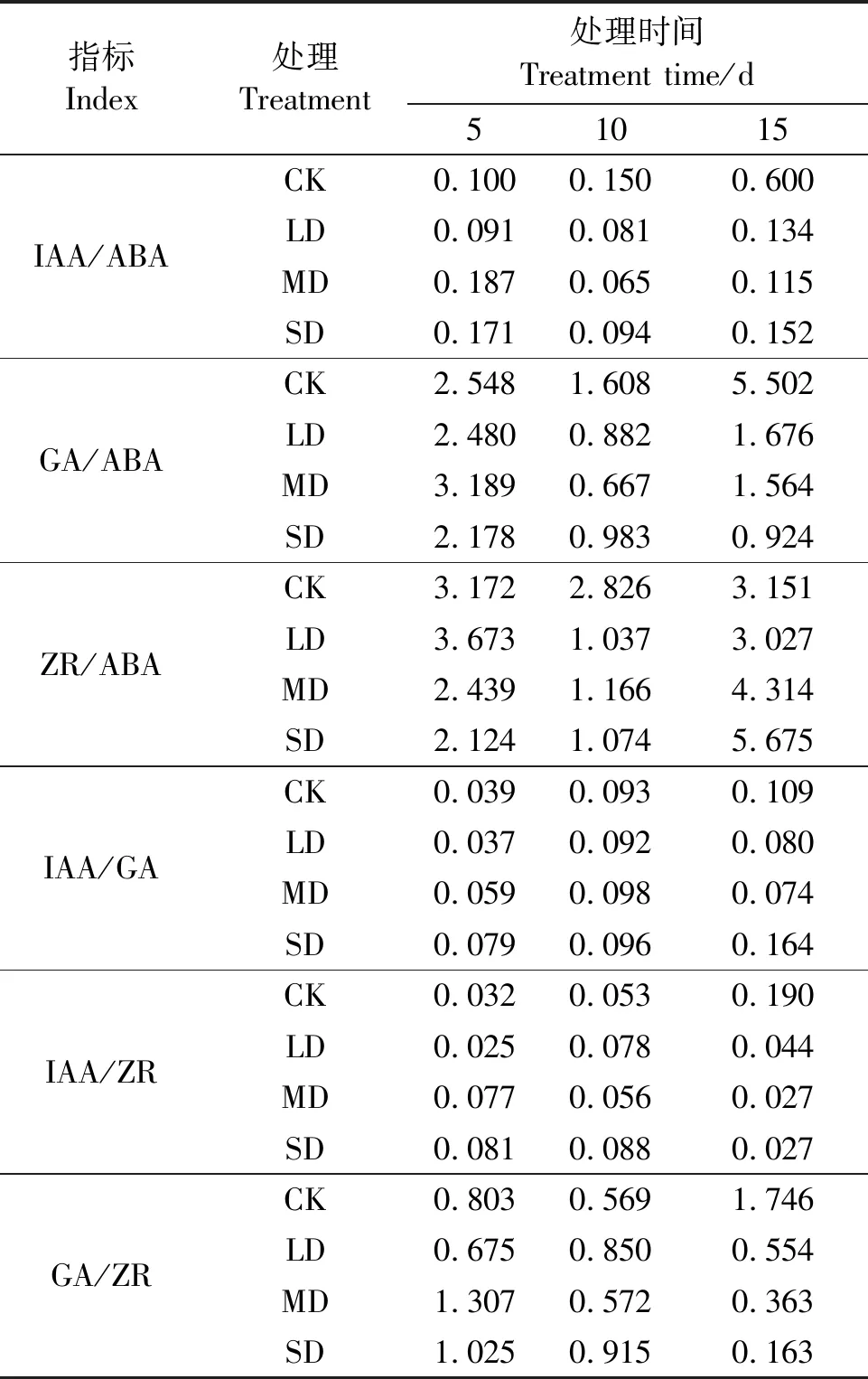
表1 干旱胁迫下栀子叶片内源激素的比例变化Table 1 Proportional changes of endogenous phytohormones in Gardenia jasminoides Ellis leaf under drought stress
3 讨论
植物内源激素是植物在特定环境信号下诱导产生的,在极低浓度下就能发挥明显的生理效应,可以单个或者相互协调调控植物的生长、发育与体内代谢[9]。ABA是一种对植物抗逆性、气孔运动以及基因表达等均有重要调节功能的植物激素,在植物众多内源激素中变化最为明显,通常被用来作为评价植物抗旱性的重要指标[10]。本研究发现,LD、MD组栀子叶片ABA含量较CK组在干旱胁迫15 d内逐渐上升,SD组ABA含量较CK组先上升后在胁迫15 d时下降,并且LD、MD、SD 3组栀子叶片ABA含量在胁迫15 d内均高于CK组,这与俞玲等[11]的研究结果相似。本研究结果表明,干旱胁迫下栀子叶片内ABA含量迅速增加以发挥调节功能,包括抑制或关闭气孔开度等,然而,随着胁迫时间延长和程度加深,ABA含量逐渐下降,栀子以体内ABA抵御干旱的保护机制减弱。
IAA、GA、ZR 3种激素均能够促进植物生长发育。IAA分布与含量对植物细胞极性发育、细胞伸长等方面发挥重要作用[12],IAA与逆境胁迫也密切相关。一般来说,逆境胁迫诱导植物IAA氨基酸化合酶上调表达导致IAA失活,进而诱导胁迫相关基因表达[13]。本研究发现,LD、MD、SD 3组栀子叶片IAA含量较CK组先迅速上升后持续下降,在干旱胁迫第5 d时高于CK,后逐渐下降,在胁迫15 d时均显著低于CK组,这与周芳等[14]的研究结果相似。GA能够促进植物气孔关闭、减少植物蒸腾,同时也促进植物生长[9]。本研究中,LD、MD、SD 3组栀子叶片GA含量较CK组变化与IAA一致,这与丁少净等[15]的研究结果一致。ZR可促进细胞分裂、扩大,延缓叶片衰老,干旱胁迫下植物根尖最先感受到胁迫,并抑制根中ZR的合成和运输,根中ZR含量变化比较明显,而不同植物叶片中ZR含量具有不同的变化趋势,且变化幅度不大[14]。本研究发现,LD、MD、SD 3组栀子叶片ZR含量较CK组具有高-低-高的变化趋势,后期ZR含量升高可能起到延缓叶片衰老脱落以维持栀子生命活动的作用,这与苏亚拉其其格等[4]对夏坡蒂品种马铃薯的研究结果一致。这些研究结果表明,短时间干旱胁迫诱导栀子体内IAA、GA含量升高,促使栀子加快生长发育,而随着胁迫时间延长,IAA、GA含量逐渐降低,栀子通过减缓生长、关闭气孔以及诱导抗旱相关基因表达等多种方式响应干旱。同时,栀子在遭受到干旱胁迫后,体内ZR含量不断波动以适应干旱。
干旱胁迫下,植物一方面通过调节体内激素含量而调控自身发育,另一方面通过改变不同激素间比值而影响自身生长。本研究发现,干旱胁迫下栀子叶片IAA/ABA、GA/ABA值较CK组逐渐下降,并且下降幅度较大,说明栀子主要通过抑制生长发育状态以抵御干旱,这一结果与李书平等[9]对干旱胁迫下福建山樱花和日本樱花幼苗的研究结果一致。同时,栀子在遭受到干旱胁迫后叶片内ZR/ABA、IAA/GA、IAA/ZR、GA/ZR值与CK组相比均发生不同的波动,说明栀子通过不同内源激素间平衡来适应干旱胁迫。
