双峰驼源纤维素降解菌的筛选及其对酒糟的降解效果
2021-04-25李国伟何静郭坤杰吉日木图
李国伟, 何静, 郭坤杰, 吉日木图,2*
(1.内蒙古农业大学乳品生物技术与工程教育部重点实验室, 呼和浩特 010018; 2.内蒙古骆驼研究院, 内蒙古 巴丹吉林 737300)
骆驼作为荒漠、半荒漠地区的主要畜种,既是农牧民重要的生活伙伴,又是重要的生产伙伴,其独特的役用性能在边陲地区交通运输中发挥着特殊的功能,被冠以“沙漠之舟”之称。我国养驼历史悠久,长期的自然选择使骆驼具有贴合荒漠地区自然生态条件的生理功能。通过对骆驼肠道微生物的多样性分析,确定骆驼肠道微生物有很好的纤维素降解能力,纤维素降解菌高度富集[1-4]。草食动物的胃肠道中寄生着具有降解纤维素能力的菌群,从中分离筛选得到的纤维素降解菌具有较为独特的生理特性,目前已经在奶牛[5-6]和野生草食性动物如梅花鹿[7-8]、大象、袋鼠和羊驼[9-10]等动物中展开研究。双峰驼作为我国边陲地区的主要畜种,对其肠道中高效纤维素降解菌的研究已经成为骆驼科学研究的重要组成部分之一,可以为提高双峰驼的经济价值,繁荣边区经济,促进边区的安定团结发挥重要作用。
白酒为中国特有的一种蒸馏酒,是世界六大蒸馏酒之一,我国每年会因为酿造白酒而产生大量的白酒糟。白酒糟是谷物发酵成白酒过程中的原料残余物,其营养价值十分丰富,主要包括蛋白质、脂肪、纤维素、钙、磷等营养物质,并富含发酵产物,如酵母和活性因子等[11-12]。白酒糟中含有丰富的粗蛋白,含量可达25%左右,将其当做动物饲料是一个很好的选择,但是由于其在动物体内的消化率低而没有得到广泛应用[13]。近年来,在酒糟中适量添加纤维素降解菌,不仅可以丰富饲料的来源、还能提高饲料的品质、改善酒糟在动物体内消化率低的问题,同时还能丰富动物体内的同源酶类、降低抗营养因子。但大部分筛选得到的纤维素降解菌在生产上具有很大的局限性,如发酵周期长、菌株耐受性差、纤维素酶活力低等,暂不能应用到实际生产中,所以筛选高效的具有特殊酶活性的纤维素降解菌是今后的工作重点。本研究从具有特殊生物学特性的双峰驼粪便中分离筛选能够高效降解纤维素的菌株,并对分离得到的菌株进行鉴定和产酶条件的优化,探究分离得到的菌株对酒糟中纤维素的降解能力,为酒糟的微生物发酵提供理论参考。
1 材料和方法
1.1 材料来源
于内蒙古自治区巴彦淖尔市乌拉特后旗牧场随机采集10峰成年双峰驼的新鲜粪便。
白酒糟由内蒙古河套酒厂提供。
1.2 培养基和溶液
1.2.1富集培养基羧甲基纤维素钠(CMC-Na)10 g、酵母膏粉1 g、硫酸铵1 g、磷酸二氢钾1 g、硫酸镁(MgSO4·7H2O)0.5 g、氯化钠0.5 g、七水合硫酸亚铁(FeSO4·7H2O)0.1 g,蒸馏水1 L,pH 7.0~7.2。
1.2.2涂布划线培养基CMC-Na 5 g、硫酸铵1 g、磷酸二氢钾1 g、MgSO4·7H2O 0.5 g、氯化钠0.5 g、FeSO4·7H2O 0.1 g、琼脂15 g,蒸馏水1 L,pH 7.0~7.2。
1.2.3纤维素刚果红琼脂培养基CMC-Na 5 g、硫酸铵1 g、磷酸二氢钾1 g、MgSO4·7H2O 0.5 g、氯化钠0.5 g、刚果红0.2 g、FeSO4·7H2O 0.1 g、琼脂15 g,蒸馏水1 L,pH 7.0~7.2。
1.2.4发酵培养基CMC-Na 10 g、蛋白胨3 g、硫酸铵1 g、磷酸二氢钾1 g、MgSO4·7H2O 0.5 g、氯化钠0.5 g、FeSO4·7H2O 0.1 g,蒸馏水1 L,pH 7.0~7.2。
1.2.5LB液体培养基蛋白胨10 g、氯化钠5 g、酵母膏粉5 g、葡萄糖1 g,蒸馏水1 L,pH 7.0~7.2。
1.2.63,5-二硝基水杨酸(DNS)试剂的配制 称取酒石酸钾钠182.0 g,3,5-二硝基水杨酸6.3 g,加热溶解。取1 000 mL烧杯,称取21 g氢氧化钠、苯酚5.0 g、无水亚硫酸钠5.0 g,均匀加热并用玻璃棒搅拌至完全溶解,然后将两种溶液混合,冷却后用蒸馏水定容至1 000 mL,然后把溶液移至棕色试剂瓶中,室温避光保存,放置一周至溶液性质稳定后备用[7]。
1.2.7柠檬酸缓冲溶液(pH 4.8) A液:称取柠檬酸21.014 g用蒸馏水溶解后定容至1 000 mL。B液:称取29.41 g柠檬酸钠用蒸馏水溶解后定容至1 000 mL。取230 mL A液和270 mL B液,定容至500 mL即为柠檬酸缓冲液[14]。
1.2.81% CMC-Na溶液 CMC-Na 10 g,柠檬酸缓冲液(pH=4.8)1 L。
1.3 纤维素降解菌的筛选
准确称取新鲜双峰驼粪便样品10 g,放入装有90 mL富集培养基的250 mL三角瓶内,并放入一定量的玻璃珠,在37 ℃、180 r·min-1THZ-98C恒温震荡培养箱(上海一恒)中培养3 d。将培养后的菌液稀释10倍,各吸取稀释度为10-3~10-6倍的菌液100 μL涂于涂布划线培养基上,每个稀释度做3个平行,倒置放入37 ℃培养箱中培养3 d。之后挑选单菌落用牛津杯法[15]接种于纤维素刚果红琼脂培养基中,倒置放入37 ℃培养箱中培养3 d,测定相应透明圈直径(D)和纤维素酶活力。将水解圈的直径和菌落直径(d)比值(D/d)较大的菌落在划线培养基上连续划线,直至得到纯菌落[16]。
1.4 酶活的测定
将解冻的菌液接种于LB液体培养基中,37 ℃、180 r·min-1恒温摇床震荡培养24 h。然后将培养后的菌液离心去除菌体,取上清即得粗酶液。以葡萄糖浓度作为标准[16],采用DNS试剂法测定纤维素酶活力。
CMCase活力的测定:参照韦海婷[7]方法并稍作改动。调整待测粗酶液和DNS显色液的添加量为0.5和1.5 mL。酶活力单位(IU)定义为:1 mL酶液1 min产生1 μmol葡萄糖所需酶量为1个酶活单位。计算公式如下。

(1)
式中,A为根据标准曲线计算的葡萄糖含量(mg·mL-1);v为反应液总体积(mL);M为葡萄糖摩尔质量(180.2 g·mol-1);V为反应中加入的粗酶液体积(mL);T为反应时间(min)。
FPase活力测定:参照韦海婷[7]方法并稍作改动。调整待测粗酶液和DNS显色液的添加量为0.5和1.5 mL。FPase酶活计算公式参照式(1)。
1.5 纤维素降解菌的鉴定
1.5.1形态学观察将复筛纯化后的菌株在培养平板上划线培养,培养24 h观察菌落特征,然后对菌株进行革兰氏染色观察。参照《伯杰氏细菌鉴定手册》[17],使用青岛海博生物技术有限公司的生理生化鉴定管进行靛基质试验、VP试验、MR试验、西蒙氏枸橼酸盐试验、明胶试验、苯丙氨酸脱氨酶试验、氧化酶试验、过氧化氢接触酶试验以及碳源同化试验在内的生理生化试验。
1.5.2分子生物学鉴定将复筛后的菌株送上海美吉生物医药科技有限公司进行16S rRNA测序,将获得的DNA序列与NCBI数据库进行Blast比对分析,在LPSN上选取同源性较高的模式菌株进行系统发育分析,借助MEGA 7.0软件分析并构建系统发育树,确定所选菌株的同源性。
1.6 产酶条件的优化
1.6.1最适接种量的确定分别按1%、2%、3%、4%、5%、6%接种量将种子液接种至装有50 mL、初始pH 7的发酵培养基的三角瓶中,在37 ℃、180 r·min-1恒温震荡培养箱中培养3 d,测定CMCase和FPase活力。
1.6.2最适初始pH的确定将种子液以2%的接种量接种至装有50 mL发酵培养基的三角瓶中,调节初始pH为2、3、4、5、6、7、8、9,在37 ℃、180 r·min-1恒温震荡培养箱中培养3 d,测定CMCase和FPase活力。
1.6.3最适培养温度的确定将种子液以2%的接种量接种至装有50 mL、初始pH 7的发酵培养基的三角瓶中,在温度为25、30、35、40、45 ℃,180 r·min-1恒温震荡培养箱中培养3 d,测定CMCase和FPase活力。
1.6.4最适发酵时间的确定将种子液以2%的接种量接种至装有50 mL,初始pH 7的发酵培养基的三角瓶中,37 ℃、180 r·min-1恒温震荡培养箱中培养,每隔6 h测定一次CMCase和FPase活力,总共培养96 h。
1.6.5响应面试验根据单因素试验结果,选取接种量、初始pH、培养温度、发酵时间4个因素,以CMCase活力为响应值,根据Box-Behnken试验设计原理,设计29个试验点的响应面分析试验,以确定最适产酶条件。响应面试验因素水平见表1。
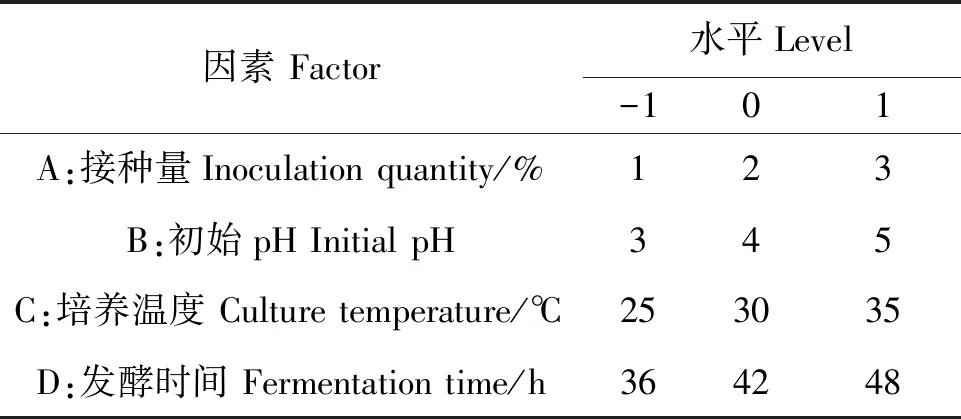
表1 响应面试验因素水平Table 1 Coding level of response surface design factors
1.7 对酒糟中纤维素的降解能力检测
将酒糟烘干后粉碎,过40目筛备用。根据前期筛选的最适产酶条件对YT5-1-1进行优化,将优化后的YT5-1-1以10%的接种量接种于经过预处理的干酒糟中,控制含水量为55%,发酵周期为21 d,分别在第7、14和21 d取样[18]。取发酵酒糟样品10 g,加入90 mL蒸馏水,充分搅拌后直接测pH值。参照GB 6435-2014[19],将发酵酒糟样品在65 ℃烘干后称重,计算干物质含量。采用范式(Van Soest)法[20],使用ANKOM 200i半自动纤维分析仪纤维素分析仪(美国,Ankom)测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量,均3次重复。在待测定的酸性洗涤纤维样品中加入足量72%硫酸浸泡,开始时搅拌滤袋,使滤袋与硫酸充分接触。3 h后将硫酸倒掉,并用热水洗涤至中性,然后用丙酮淋洗3 min。105 ℃烘箱内干燥3 h左右,然后置于干燥器内冷却至室温,称重。消化过程中溶解部分为纤维素,不溶解的残渣为酸性洗涤木质素和酸不溶灰分。根据以下公式[21]计算半纤维素含量(hemicellulose,HC)、半纤维素降解率(degradation rate of hemicellulose,D-HC)、纤维素含量(cellulose,CL)和纤维素降解率(degradation rate of cellulose,D-CL)。
HC=NDF-ADF
(2)
(3)
CL=ADF-经72%硫酸处理后的残渣
(4)
(5)
式中,HC1为降解前的半纤维素含量,HC2为降解后的半纤维素含量,CL1为降解前的纤维素含量,CL2为降解后纤维素的含量。
根据以上公式测得酒糟样品的原始pH为4.0,NDF为51.05%,ADF为35.73%,D-HC 为15.32%,D-CL为35.06%。
1.8 数据统计与分析
数据处理用Microsoft Excel 2016初步处理后,利用GraphPad Prism·6软件进行数据的差异性分析和图表绘制,并借助Design Expert 8.0.6进行响应面优化试验及数据分析。
2 结果和分析
2.1 葡萄糖标准曲线
以还原性糖含量为自变量,对应的吸光度(OD)值为因变量,绘制标准曲线。结果(图1)可知,绘制的葡萄糖标准曲线的线性方程为:y=0.337 3x+0.015 3,R2为0.999 3,R2>0.99,说明该标准曲线的可靠性高,相关性好。方程中的0.015 3为补偿参数。根据此方程,可用待测溶液的吸光度值计算出对应的葡萄糖含量。
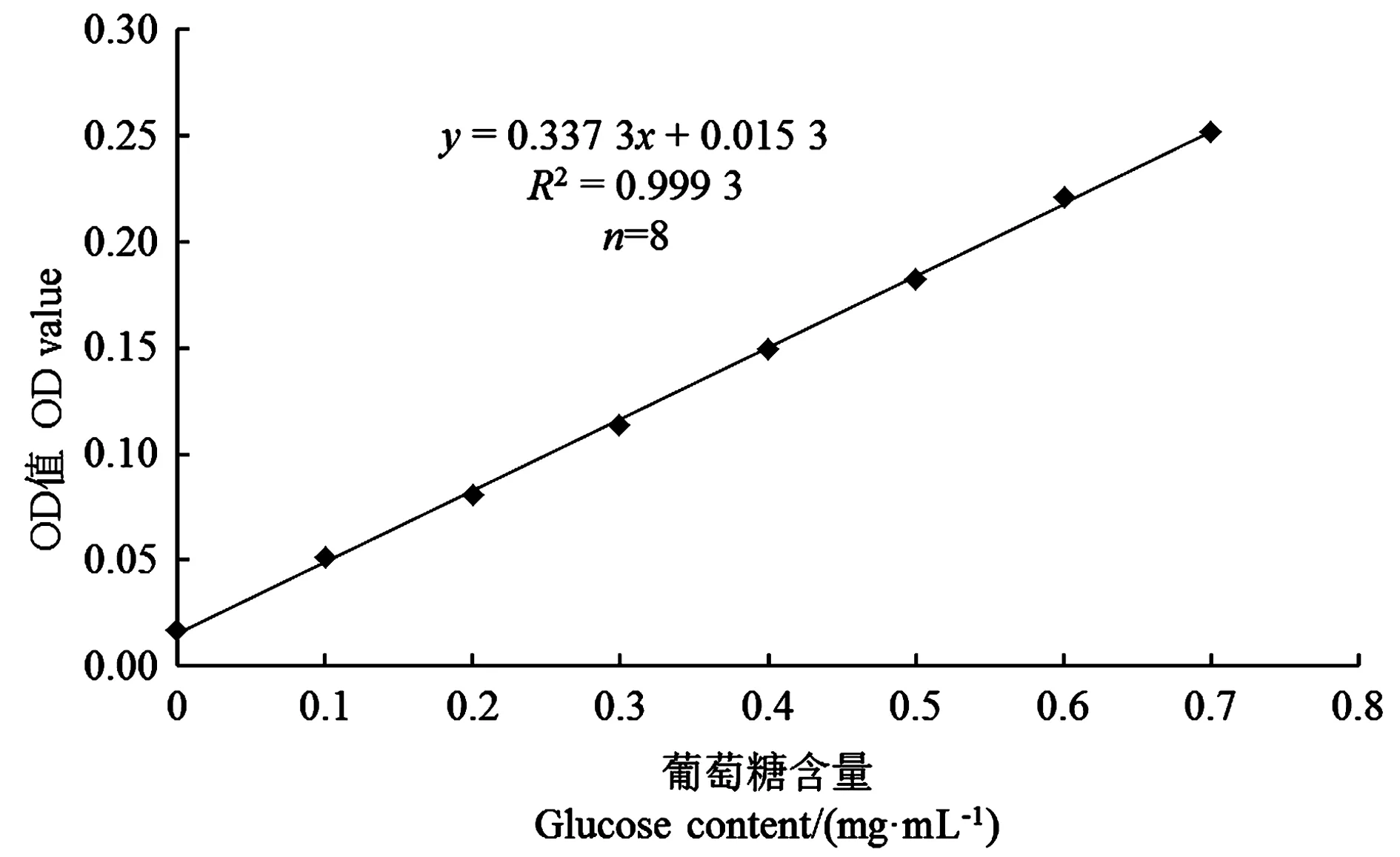
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 纤维素降解菌的筛选结果
通过3次富集,从双峰驼粪便内容物中共筛选出21株能够降解纤维素的菌株,这些菌株的透明圈与菌落直径的比值(D/d)以及CMCase和FPase活力结果(表2)显示,菌株YT5-1-1的D/d值为2.1,CMCase活力为(0.580±0.008)IU·mL-1,FPase活力为(0.820±0.025) IU·mL-1。综合来看,YT5-1-1菌株的纤维素降解能力较强。纤维素降解菌将纤维素刚果红琼脂培养基中的纤维素降解成小分子糖,因为刚果红无法与小分子糖结合而被洗脱掉,呈现透明圈。因此,菌株YT5-1-1在纤维素刚果红琼脂培养基的生长结果(图2)也反映了该菌株具有很强的纤维素降解能力。
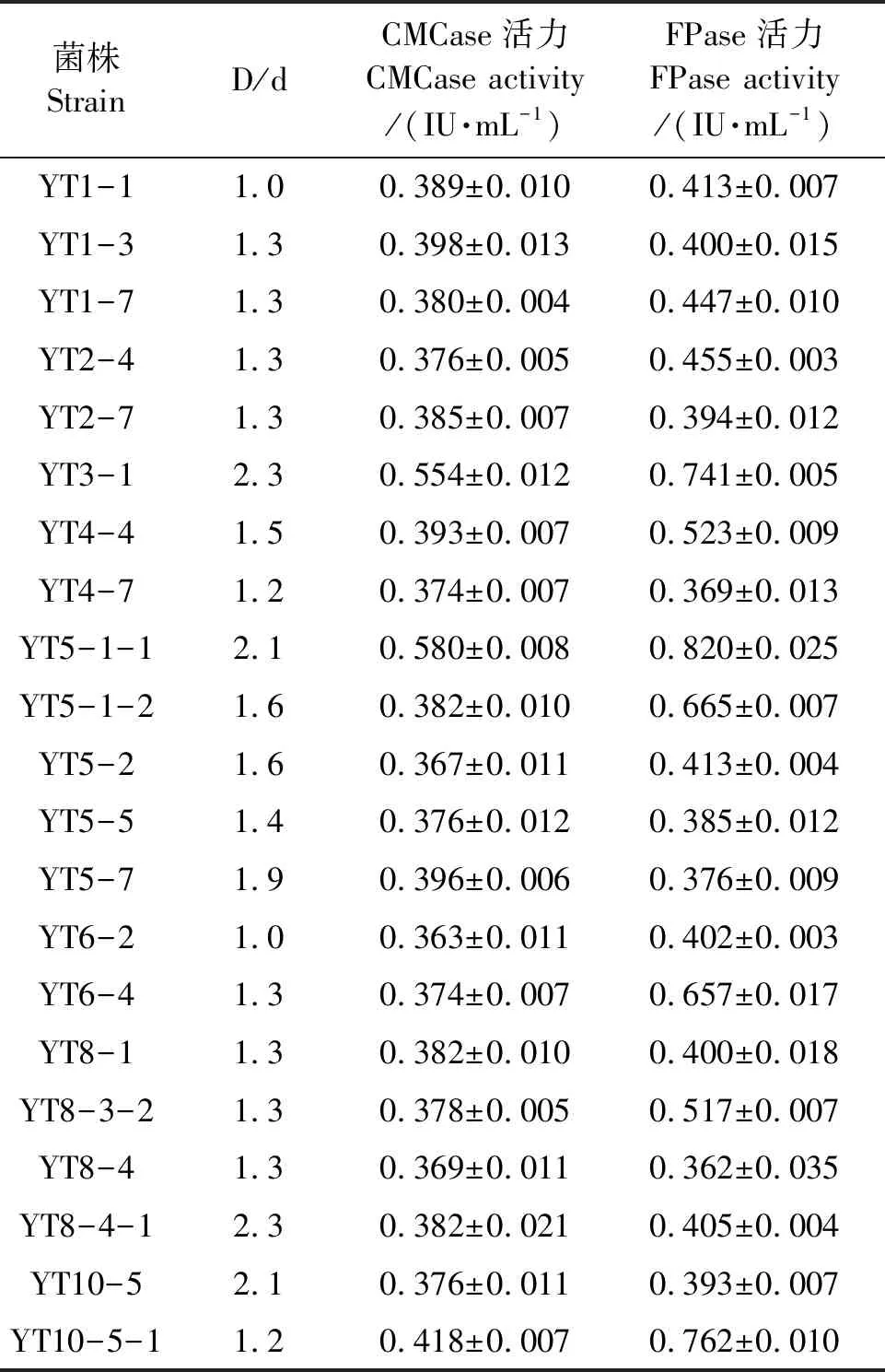
表2 纤维素降解菌的D/d值和纤维素酶活力Table 2 D/d value and cellulase activity of cellulolytic bacteria
2.3 双峰驼粪便中纤维素降解菌的鉴定
2.3.1形态学观察结果筛选得到的菌株YT5-1-1的形态学结果见图3,可见,菌株YT5-1-1的菌落呈白色,圆形,表面光滑湿润,革兰氏染色为阴性,在显微镜下观察为直杆菌,无芽孢。其生理生化特性检测结果(表3)显示,该菌株的靛基质试验、VP试验、西蒙氏枸橼酸盐试验、过氧化氢接触酶试验结果为阳性,说明菌株能产生吲哚,将葡萄糖分解成丙酮酸后脱羧,形成酮醇类的中性物质,能利用柠檬酸盐作为唯一的碳源,并且菌株中含有过氧化氢酶。MR试验、硫化氢试验、明胶试验、苯丙氨酸脱氨酶试验、氧化酶试验结果为阴性,说明菌株将普通糖分解后不会形成酸类物质,而是脱羧成中性物质;不分解含硫氨基酸或含硫化合物,不能使苯丙氨酸脱氨变成苯丙酮酸,不产类蛋白水解酶以及氧化酶。通过碳源同化试验得知,菌株能利用葡萄糖、蔗糖、半乳糖、果糖、乳糖、鼠李糖等多种多糖和甘露醇、山梨醇等醇类物质,但是不能利用纤维二糖。
2.3.2分子生物学鉴定结果基于测序结果,将序列结果与NCBI数据库进行Blast比对分析,在LPSN上选取同源性较高的模式菌株进行系统发育分析,由系统进化树结果(图4)可知,菌株YT5-1-1与香坊肠杆菌(Enterobacterxiangfangensis)亲源关系最近。YT5-1-1序列已提交至NCBI,登陆号为MN515058。综合该菌株的菌落形态、生理生化特性和分子生物学鉴定结果,确定获得的纤维素分解菌YT5-1-1为香坊肠杆菌。
2.4 YT5-1-1菌株产酶条件的优化
2.4.1最适接种量的确定不同 YT5-1-1接种量产生的CMCase和FPase活力结果见图5,可见,在接种量为2%时,CMCase和FPase活力最大;其他接种量条件下,CMCase和FPase活力均低于2%接种量。说明YT5-1-1菌株在接种量为2%时效果最佳,反映YT5-1-1的产酶效果与菌体浓度有关,菌体浓度增大,会提升酶活力,但浓度过大反而会降低酶活力,这可能与培养基的营养物质含量会随着接种量的变化而变化有关。
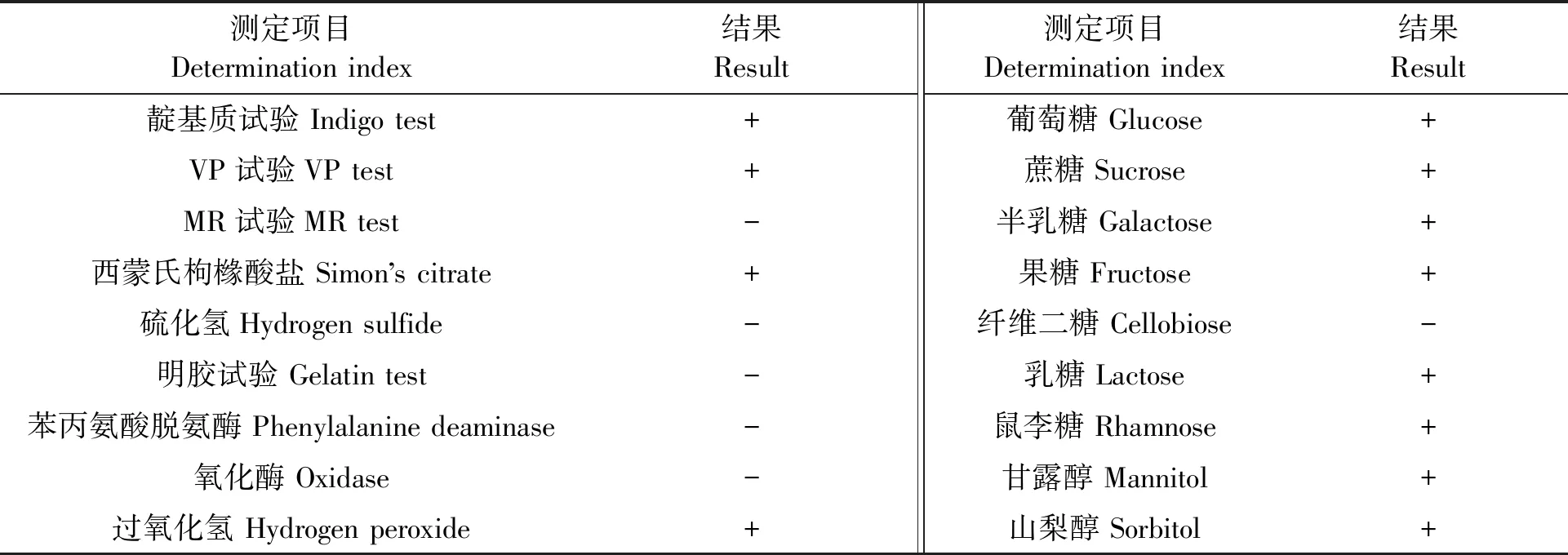
表3 菌株YT5-1-1的生理生化特性Table 3 Physiological-biochemical characteristics of YT5-1-1
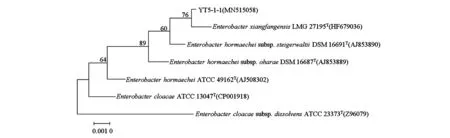
图4 菌株YT5-1-1的系统发育树Fig.4 Phylogenetic tree of YT5-1-1
2.4.2最适初始pH的确定不同初始pH条件下,菌株YT5-1-1所产生的CMCase和FPase活力结果见图6,随着发酵培养基初始pH增加,CMCase和FPase活力逐渐增大,在初始pH为4时,CMCase和FPase活力最大,之后随着pH继续增加,CMCase和FPase活力逐渐下降,在pH为7时降至最低,pH继续增加,酶活力保持不变。整体酶活力在pH为3~5时,CMCase和FPase维持较高的活性,说明菌株YT5-1-1在偏酸性条件下更有利于酶的产生。
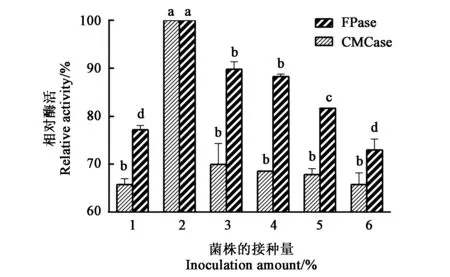
注:同种酶不同字母表示不同处理间的差异在P<0.05水平具有显著性。Note: Different lowercase letters of the same enzyme indicate significant differences between different treatments at P<0.05 level.图5 不同接种量下菌株YT5-1-1的产酶活力Fig.5 Enzymes activities produced by strain YT5-1-1 under different inoculation amounts
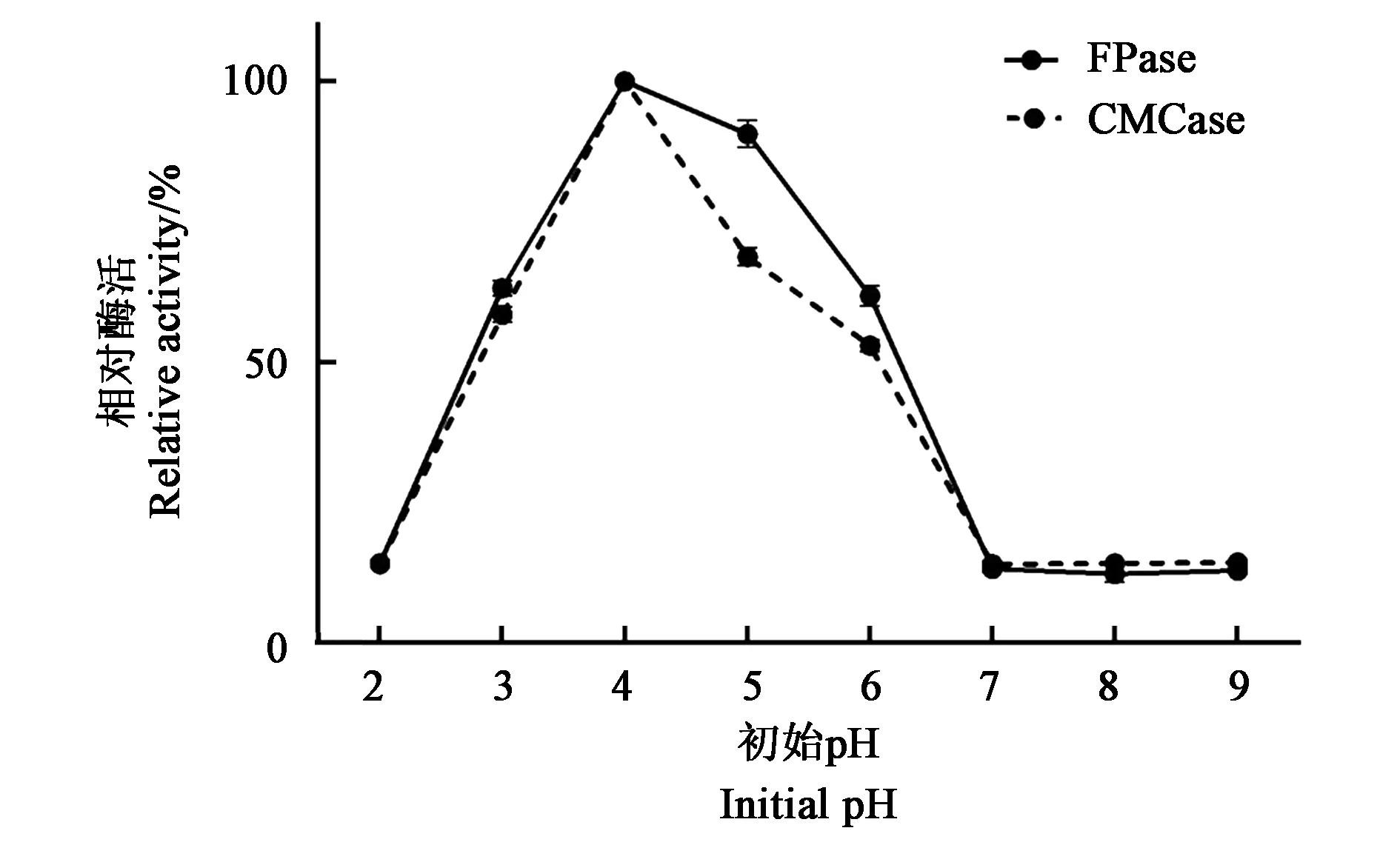
图6 不同初始pH下菌株YT5-1-1的产酶活力Fig.6 Enzymes activities produced by strain YT5-1-1 under different initial pH
2.4.3最适培养温度的确定不同温度条件下CMCase和FPase活力结果见图7,随着培养温度的升高,CMCase和FPase活力逐渐增大,在培养温度为30 ℃时达到最大。之后在30~45 ℃之间时,随着温度继续升高,酶活力呈持续下降趋势。表明菌株YT5-1-1的生长和代谢与温度密切相关,30 ℃是其最佳培养温度。
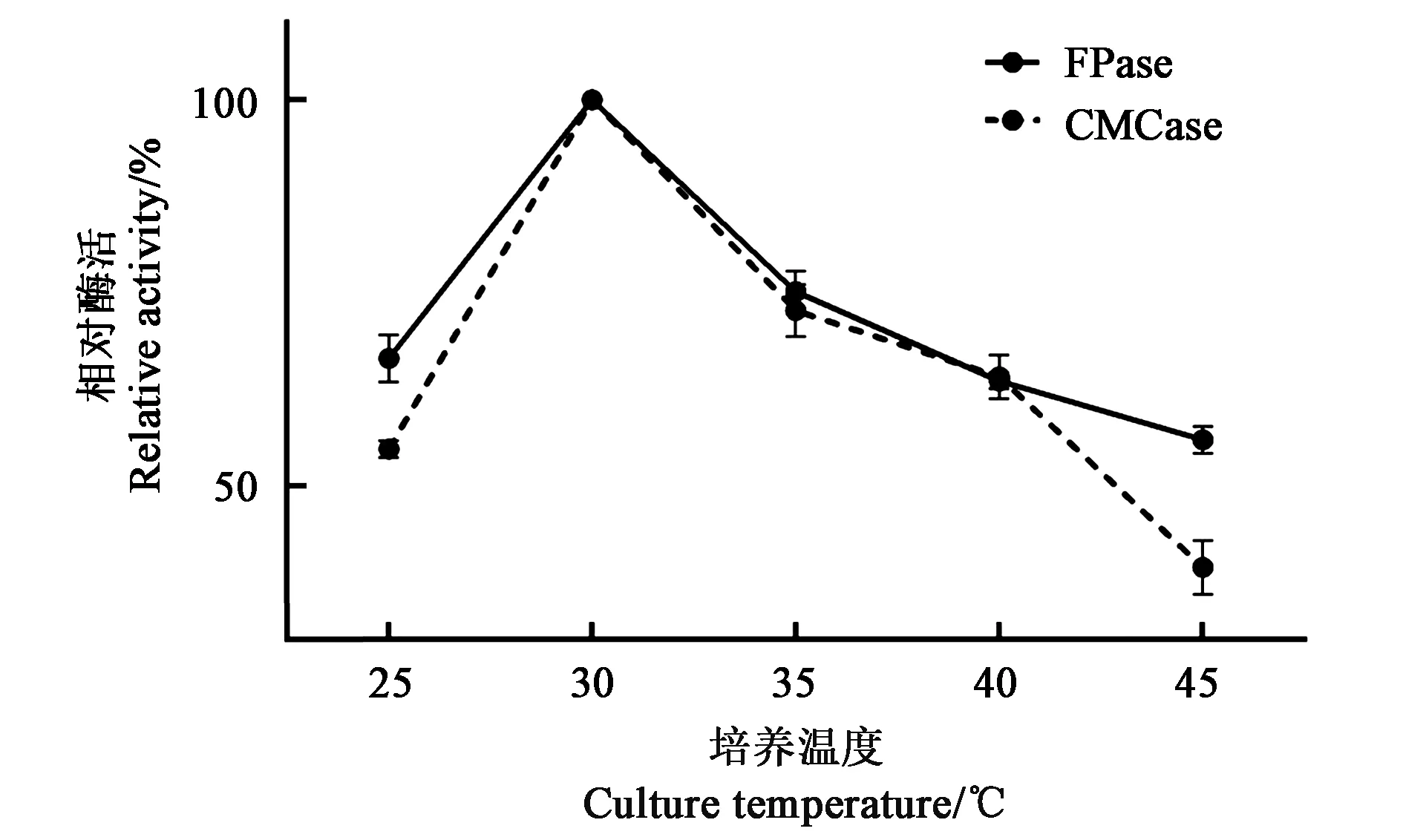
图7 不同培养温度下菌株YT5-1-1的产酶活力Fig.7 Enzymes activities produced bystrain YT5-1-1 under different culture temperatures
2.4.4最适发酵时间的确定在37 ℃、180 r·min-1条件下培养,不同发酵时间的CMCase和FPase活力结果见图8,CMCase和FPase活力随着发酵时间的延长呈现先上升后下降的趋势。在42 h之前,酶活力较低,可能是因为菌株还处于产酶积累期,所以酶活力未达到最高值;随着菌体浓度的增大和底物对CMCase和FPase的诱导,导致酶量积累,在42 h时酶活力达到最大值,分别为(0.556±0.011)和(0.834±0.017)IU·mL-1。延长发酵时间,酶活力持续降低,可能是因为随着发酵时间的增加,营养物质被大量消耗、菌体自身的产酶能力下降,从而导致酶活力下降。
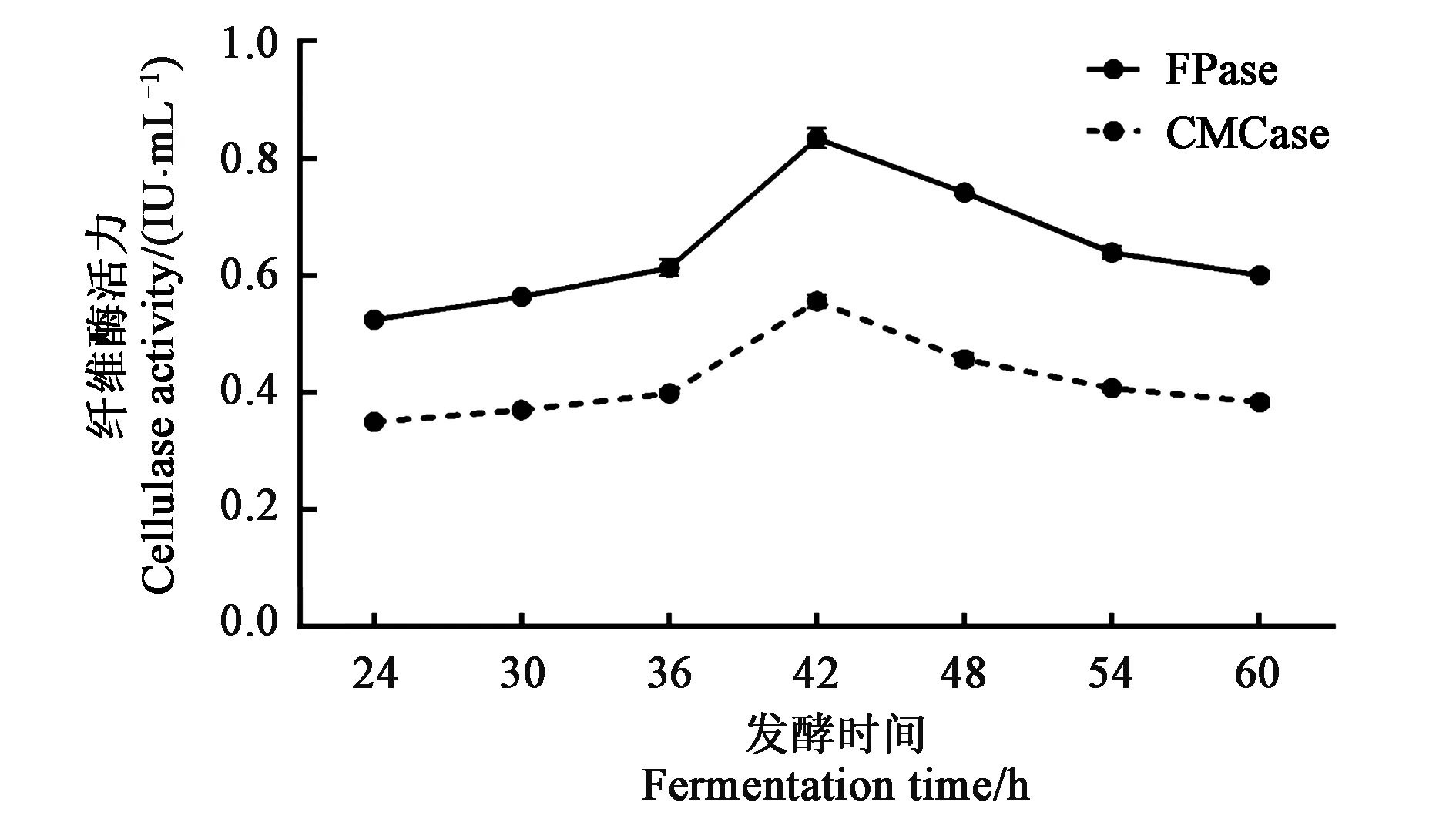
图8 不同发酵时间下菌株YT5-1-1的产酶活力Fig.8 Enzymes activities produced by strain YT5-1-1 under different fermentation times
2.5 响应面试验结果
以接种量、初始pH、培养温度和发酵时间为响应变量,CMCase活力为响应值,采用Design-Expert 软件分析得到自变量与CMCase活力的二次回归方程式:Y=-44.783 05+0.665 07A+2.166 13B+1.563 11C+0.855 5D+0.145AB-0.019 3AC+0.031 458AD-0.020 5BC+0.015 583BD-0.002 65CD-0.520 1A2-0.306 2B2-0.021 869C2-0.010 669D2。式中,Y为CMCase活力 (IU·mL-1),A为接种量(%),B为初始pH,C为培养温度(℃),D为发酵时间(h)。模型的方差分析结果(表4)表明,对CMCase活力的二次多项式模型具有高度显著性(P<0.000 1),方程负相关系数平方(R2)为0.961,失拟项不显著(P=0.797 7)。因此,模型与实际拟合较好,可以用此模型对产CMCase活力条件进行优化。
对方程中变量进行方差分析,结果(表5)可以看出,优化产CMCase活力条件时,影响CMCase活力的主要因素按照主次顺序排列为培养温度>接种量>初始pH>发酵时间,在所选各因素水平范围,变量A、C、AB、AD、A2、B2、C2、D2对Y的影响均达到显著水平。
等高线的椭圆程度反映了交互作用的大小,椭圆形表示两因素交互作用显著,而圆形表示两者交互作用较弱。三维解析表面的陡峭程度可以直观地反映变量与响应量之间的相关性。由于本研究中交互作用对响应值的影响数值较多,因此只分析P<0.05的数据。图9A中,接种量和初始pH所对应的CMCase活力等高线弯曲明显,所以接种量和初始pH的交互项对CMCase活力有影响,且两者的交互作用显著。图9C中,接种量和发酵时间所对应的CMCase活力等高线弯曲程度更大,证明接种量和发酵时间的交互作用对CMCase活力的影响是大于接种量和初始pH的交互作用。通过观察图9B和图9D可知,当接种量范围在1%~2%之间,响应值的上升趋势趋于平缓,而当接种量超过2.5%以后,响应值快速下降,这可能与菌体浓度增加导致生长抑制,从而影响CMCase活力有关;当接种量一定时,响应值随着初始pH和发酵时间的增加,呈现先上升后下降的趋势且相对平缓,这表明初始pH和发酵时间的变化对CMCase活力的影响与发酵时间相比较弱。根据实际情况和Design-Expert软件进行发酵条件的优化,优化的最佳参数为:接种量2.6%、初始pH 4.56、培养温度30 ℃、发酵时间43 h。在此条件下,预测CMCase活力最大为1.819 IU·mL-1。
2.6 YT5-1-1对酒糟中纤维素的降解能力
菌株YT5-1-1发酵酒糟过程中的各项指标结果见表6,可见,试验组与空白组的pH间无显著差异,两组的变化趋势基本相同。在前7 d的发酵过程中,pH基本无变化,7~14 d时,空白组和试验组的pH都出现显著下降,下降到3.76±0.01的水平。在14~21 d时,pH开始显著回升。在酒糟的发酵过程中,各组的pH均处于波动状态但波动幅度不大,且各组的变化情况基本相同,无明显差异。因此认为,菌株YT5-1-1不会对酒糟发酵过程中的pH产生影响。在发酵过程中,各阶段干物质含量都出现降低,在前7 d的发酵过程中,空白组和试验组的干物质含量显著下降,此时空白组的干物质含量下降程度显著高于试验组,达到(37.06±0.76)%。在后续的酒糟发酵过程中,空白组的干物质含量持续下降,而试验组的干物质含量在发酵14~21 d基本处于稳定状态。在酒糟的发酵过程中,空白组和试验组的NDF和ADF含量均随着发酵时间的延长而持续降低;并且相同处理时间的试验组的NDF和ADF含量均显著低于空白组。在前7 d的发酵过程中,空白组和试验组的D-HC无明显差异;在7~14 d,试验组的D-HC含量开始显著高于空白组;直到发酵结束,试验组的D-HC含量较空白组显著提高4.18%;在整个发酵过程中,试验组的D-CL含量一直显著高于空白组,且随着发酵时间的增加,两组的D-CL含量也显著增加,发酵结束时,试验组的D-CL含量较空白组提高了3.46%。发酵结束时,试验组的D-HC和D-CL较发酵前分别提高了11.62%和21.08%。

A:接种量和初始pH对响应值交互作用的等高线图;B:接种量和初始pH对响应值交互作用的三维解析表面;C:接种量和发酵时间对响应值交互作用的等高线图;D:接种量和发酵时间对响应值交互作用的三维解析表面A:Contour plot of interaction between inoculation amount and initial pH on response value;B:Three-dimensional analytical surface of interaction between inoculation amount and initial pH on response value;C:Contour plot of interaction between inoculation amount and fermentation time on response value;D:Three-dimensional analytical surface of interaction between inoculation amount and fermentation time on response value图9 接种量和初始pH、接种量和发酵时间对响应值交互作用的影响Fig.9 Effects of inoculation amount and initial pH, inoculation amount and fermentation time on the interaction of response value
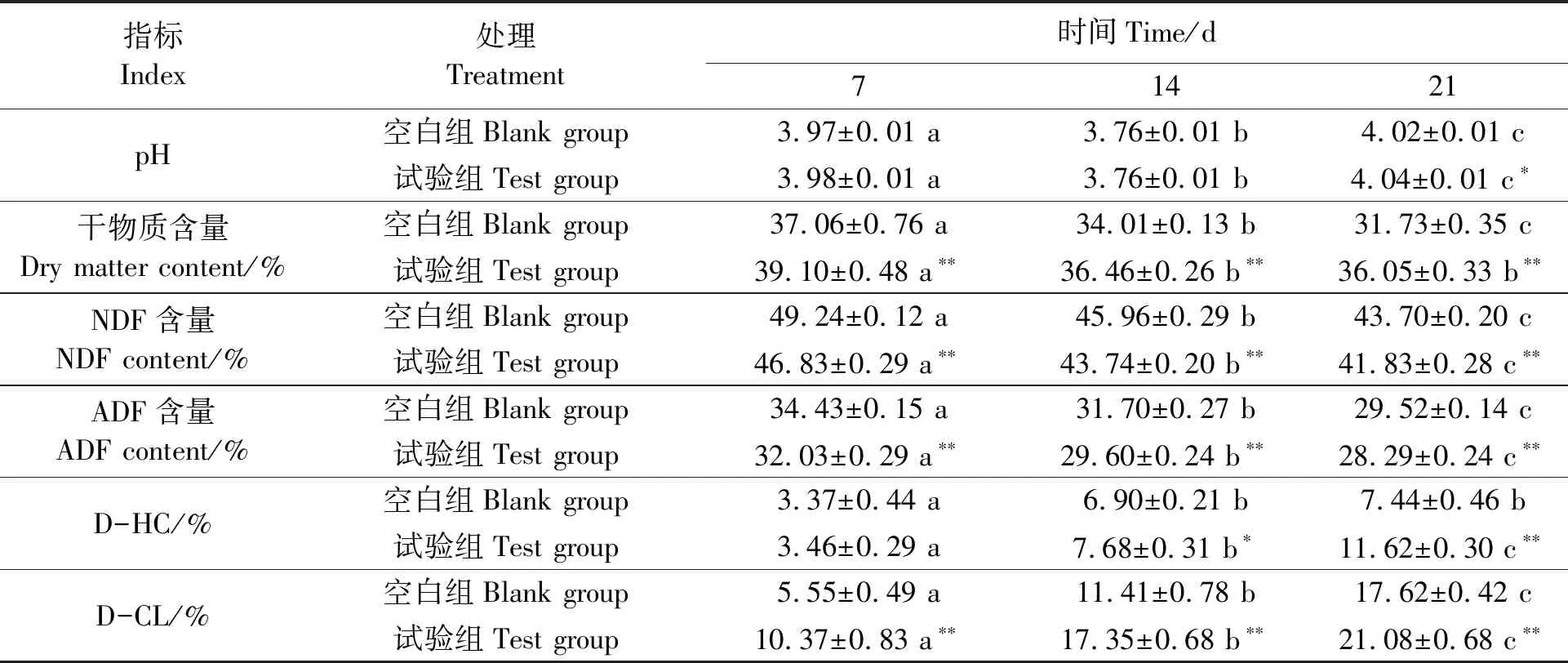
表6 添加YT5-1-1后酒糟指标的变化Table 6 Changes of vinasse parameters after fermentation with YT5-1-1
3 讨论
采用CMC-Na平板法进行筛选,结合刚果红染色,并参照菌落周围透明圈直径/菌落直径比值大小,是分离筛选纤维素分解菌的常用方法[22]。但D/d比值并不能作为衡量纤维素酶活力大小的唯一标准,还需要利用DNS法测定纤维素酶活力进行复筛,一方面是由于纤维素酶是诱导酶,在发酵过程中会受到琼脂中淀粉和明胶等物质的影响,使结果出现假阳性;另一方面纤维素酶活力与D/d比值呈弱相关[23-24]。本研究采用CMC-Na平板筛选产纤维素酶菌株,结合羧甲基纤维素酶和滤纸酶活力,从双峰驼的粪便中筛选出一株具有较高纤维素酶活力的菌株YT5-1-1,初步鉴定该菌株为香坊肠杆菌。香坊肠杆菌属肠杆菌属,广泛分布于自然界,普遍存在于人和动物中。已有研究证实,阴沟肠杆菌和产气肠杆菌具有降解纤维素的能力[25],而本研究关于香坊肠杆菌具有纤维素降解能力的结果是首次报道。目前,香坊肠杆菌已从传统酸面团、腌冬瓜、刺葡萄表皮和甘蔗渣中分离得到[26],而从动物肠道中分离得到,也是首次报道。
在微生物的生长繁殖过程中,接种量、初始pH、培养温度和发酵时间都是影响其生长和代谢的重要因素[27]。本研究先以接种量、初始pH、培养温度和发酵时间这4个对纤维素酶活力影响较大的因素进行单因素试验,然后在单因素的基础上进行响应面优化试验,发现菌株YT5-1-1在接种量为2.6%时酶活力达到最大,YT5-1-1的接种量较低,能很好的节约生产成本。YT5-1-1的整体酶活力在pH小于6的条件下能维持较高的活性,通过响应面优化后YT5-1-1菌株的最适培养pH为4.5,说明它可以对一些偏酸性的纤维素源材料进行水解,这与纤维素酶的最适pH大多在4.0~5.5之间的研究结果[28]一致。培养温度在25~40 ℃时,YT5-1-1的酶活都能达到50%以上,说明它在生产过程中有很好的适应能力,最适培养温度为30 ℃,这与香坊肠杆菌的最适生长温度[29]相同。YT5-1-1的最适发酵时间为42 h,发酵周期较短。利用响应面法对发酵条件进行优化后预测CMCase活力最大为1.819 IU·mL-1,比原来活力0.580 IU·mL-1提高了3.14倍,这与崔秀秀[30 ]以初始pH、发酵温度、接种量为因子对纤维素降解菌进行响应面优化,优化后纤维素的酶活力与优化前提高了2.96倍的结果相似。表明接种量2.6%、初始pH 4.5、培养温度30 ℃和发酵时间42 h,是YT5-1-1菌株的较优培养条件,此条件下预测YT5-1-1的CMCase活力可以大大提高。
目前关于添加纤维素降解菌来改善饲料品质的研究取得了一定进展。易戈等[31]利用热带假丝酵母(Candidatropicalis)发酵白酒酒糟,其中的粗纤维降低了25.49%;卢向阳等[32]利用菌种混合发酵白酒酒糟,粗纤维降低了41.4%,证实纤维素降解菌的添加能有效降低酒糟中的粗纤维含量。本研究分离得到的香坊肠杆菌YT5-1-1,具有较高的酒精耐受度[29],因此可以将其应用在对酒糟中纤维素降解的研究中。根据发酵前后酒糟的pH、干物质含量、中性洗涤纤维含量和酸性洗涤纤维含量的变化来看,YT5-1-1在酒糟发酵过程中,对酒糟pH的影响较小,试验组的干物质含量较空白组显著增加,这可能与酒糟在发酵过程中的蛋白质含量变化[18]有关。空白组的NDF和ADF含量随着发酵时间的延长均出现下降,这可能是因为酒糟样品在发酵过程中与空气接触,导致其进一步降解[33],从而使酒糟中的NDF含量和ADF含量下降。添加菌剂YT5-1-1的试验组的NDF和ADF含量较空白组显著下降,证明YT5-1-1确实能够降解酒糟中的纤维素,从而降低纤维素含量。本研究中,试验组的D-HC和D-CL降解率显著高于空白组,表明酒糟发酵过程中,YT5-1-1能够表现出其最佳的纤维素降解效率。因此,香坊肠杆菌YT5-1-1能显著改善酒糟的饲用价值,具有很大的实际应用价值。
