右美托咪定与利多卡因对颅脑损伤患者术后炎性应激反应及脑损伤的影响
2021-04-24栗付民韩灵龙
杨 雪 栗付民 韩灵龙
许昌市中心医院,河南 许昌461000
颅脑损伤具有病情重、病死率高等特点,属神经外科常见疾病,且近年来其发病率有逐年增高趋势[1-3]。颅脑损伤的死亡原因主要为严重颅内高压、脑水肿及脑挫裂伤等,有效解除颅内高压、清除脑水肿为治疗疾病的关键。血肿清除与去骨瓣减压术可清除血肿快与严重挫伤脑组织等一系列占位病变,减压效果理想,能迅速减轻脑组织受压,效果肯定,但因手术直接创伤或术中缺血缺氧、缺血再灌注损伤等易造成机体产生一系列炎症应激反应,影响脑氧代谢与脑认知功能,增加围术期心脑血管并发症发生风险,危及患者生命[4]。因此,探寻一种颅脑损伤围术期安全有效的麻醉方案一直受到临床工作者重点关注。
研究报道,颅脑手术中理想麻醉手段不仅需麻醉诱导迅速、镇痛充分,还需缓解炎症反应,降低脑氧代谢,尽可能保持内环境稳定及主要脏器灌注,保护脑功能[5]。右美托咪定属新型肾上腺素能受体激动剂,可起到良好镇痛、镇静、抗炎、抗交感等作用,且不存在呼吸抑制作用,有助于缓解机体应激反应情况,稳定生命体征,临床应用逐渐增加[6-7]。2009 年被中国国家药品食品监督管理局批准可应用到机械通气及气管插管时镇静。动物实验显示右美托咪定可减轻大鼠局灶性脑缺血-再灌注损伤,起到脑保护作用[8]。利多卡因属酰胺类麻醉药,可起到良好镇痛、镇静作用,减轻机体炎症应激反应,且能一定程度保护脑功能[9-10]。由此可推测右美托咪定结合利多卡因可更有效减轻机体炎症应激反应,加强脑保护作用。肿瘤坏死因子-α(TNF-α)、超敏C 反应蛋白(hs-CRP)、白细胞介素-6(IL-6)为经典炎症因子,血糖(GLU)、肾上腺素(E)、皮质醇(Cor)为重要应激反应指标,神经元特异性烯醇化酶(NSE)、S-100β蛋白属脑损伤指标,测定上述指标血清水平可为判定患者炎性应激反应和脑损伤情况提供客观依据。但目前临床尚未见右美托咪定结合利多卡因应用于颅脑损伤手术患者的研究报道,本研究首次分析两者结合对颅脑损伤手术患者术后炎性应激反应和脑损伤的影响,以期为临床提供一定参考。
1 资料与方法
1.1 一般资料 选取2018-03—2020-05许昌市中心医院颅脑损伤手术患者102例,以简单随机化法分为观察组(n=51)、对照组(n=51)。2 组性别、体重指数(BMI)、年龄、格拉斯哥昏迷量表(GCS)评分、受伤至入院时间、美国麻醉师协会分级(ASA)、合并疾病等基线资料均衡可比(P>0.05),见表1。本研究经医院伦理委员会批准。
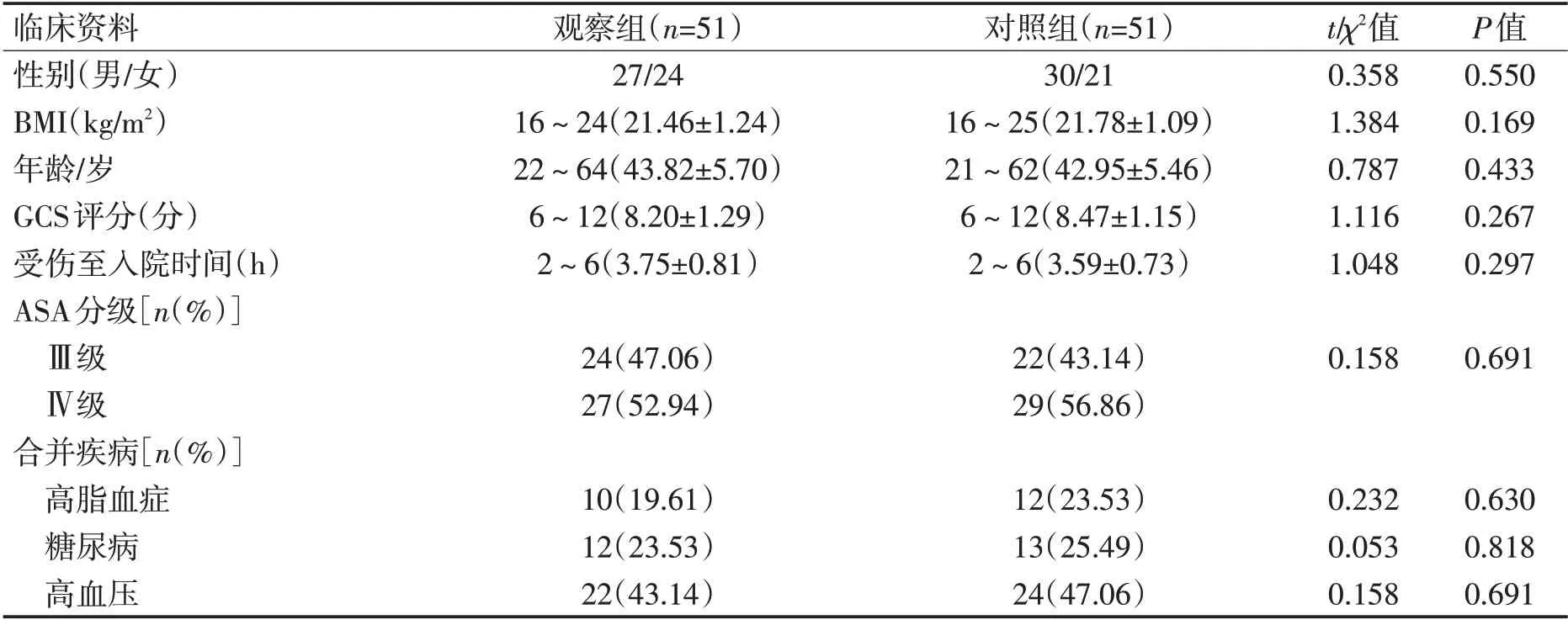
表1 2组一般资料比较Table 1 Comparison of general information of two groups
1.2 选例标准
1.2.1 纳入标准:①经CT 检查确诊为重度颅脑损伤;②手术指征明确,行血肿清除与去骨瓣减压术;③ASA 分级处于Ⅲ~Ⅳ级;④近3 个月未应用镇静、镇痛药物;⑤文化程度中学及以上,术前无认知功能障碍;⑥患者家属知晓本研究麻醉方案,签订知情同意书。
1.2.2 排除标准:①脑疝晚期或脑死亡;②存在呼吸衰竭、心力衰竭、休克等表现;③合并肝、肾、肺等脏器功能严重障碍者;④入院时GCS评分>12分者;⑤合并神经系统疾病、凝血功能障碍者;⑥合并上呼吸道感染者;⑦对右美托咪定、利多卡因过敏者。
1.3 方法
1.3.1 麻醉方法:2组术前均禁食10 h,禁饮4 h,入室后创建外周静脉通路,密切监测血压、血氧饱和度、心电图、心率等情况;①麻醉诱导:静推0.8 mg/kg罗库溴铵,0.5 μg/kg 舒芬太尼,0.2 mg/kg 依托咪酯,0.02 mg/kg 咪达唑仑,诱导后实施气管插管,以麻醉机调节通气,参数设定:潮气量8~10 mL/kg,呼吸比1∶2,呼吸频率12~14次/min,吸入氧浓度为100%,呼气末二氧化碳分压(PETCO2)为3.99~4.66 kPa。②麻醉维持:予以2~3 ng/mL 瑞芬太尼,1.5~2.0 μg/mL 丙泊酚持续靶控输注,并持续吸入七氟醚(浓度在1.0%以下),使电脑双频谱指数维持在40~60,视需要间断予以肌松药顺阿曲库铵。在此基础上,对照组在麻醉诱导前予以1.5 mg/kg 利多卡因(国药集团容生制药有限公司,国药准字H20043676),术中应用2 mg/(kg·h)速度静脉维持到术毕。在对照组基础上,观察组麻醉诱导前予以0.6 μg/kg 右美托咪定(扬子江药业集团有限公司,国药准字H20183220)输注15 min,而后以0.2 μg/(kg·h)速度维持到术毕。术毕患者潮气量达6 mL/kg,血氧饱和度≥95%。自主呼吸恢复、循环稳定且可执行语言指令时采取拔管。
1.3.2 检测方法:麻醉诱导前(T0)、术毕拔管时(T3)、术后12 h(T4)、术后24 h(T5)分别采集受检者5 mL 清晨空腹静脉血样,离心机离心10 min,取血清,冰箱内 70 ℃冻存;以双抗体夹心酶联免疫吸附法测定血清TNF-α、IL-6、E、Cor、NSE、S-100β蛋白水平,试剂盒购于上海基免实业有限公司;免疫比浊法测定血清hs-CRP水平,试剂盒购于北京方程嘉鸿科技有限公司;快速血糖仪测定GLU水平,有关操作均严格按仪器及试剂盒说明书完成。
1.4 观察指标(1)2组T0、插管后即刻(T1)、开颅时(T2)、T3 时血流动力学指标[平均动脉压(MAP)、心率(HR)]水平。(2)2 组T0、T3、T4、T5 时血清炎症因子指标(TNF-α、hs-CRP、IL-6)水平。(3)2组T0、T3、T4、T5时血清应激反应指标(GLU、E、Cor)水平。(4)2组T0、T3、T4、T5 时血清脑损伤指标(NSE、S-100β蛋白)水平。(5)2 组T0、术后3 d、术后1 周认知功能状态,以MMSE 量表评估,满分30 分,分值越低认知功能状态越差[11]。(6)2 组不良反应与术后1 周认知功能障碍发生情况,若术后MMSE 分值≤24 分则判断为认知功能障碍[12]。
1.5 统计学处理 以SPSS 21.0软件分析数据,计量资料以均数±标准差描述,行t 检验;计数资料用率(%)描述,行χ2检验;检验水准α=0.05。
2 结果
2.1 血流动力学 2组T0时MAP及HR水平差异无统计学意义(P>0.05);观察组T1、T2、T3 时MAP 与HR水平较对照组低(P<0.05)。见表2、图1。
表2 2组血流动力学比较 (±s)Table 2 Comparison of hemodynamics of two groups (±s)
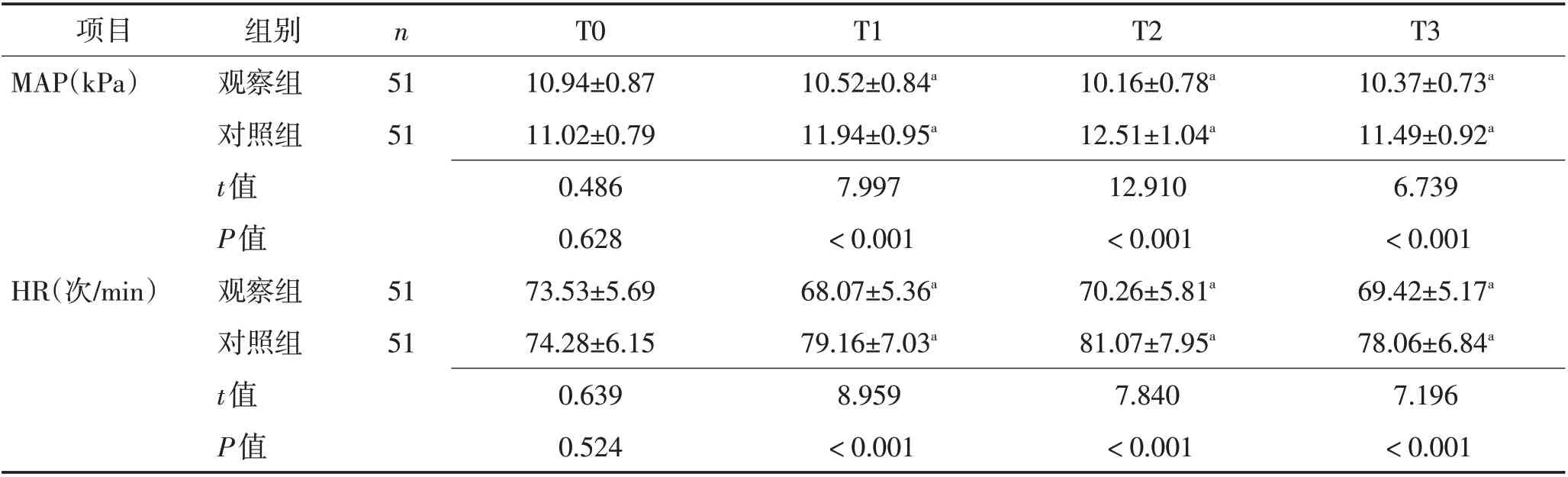
表2 2组血流动力学比较 (±s)Table 2 Comparison of hemodynamics of two groups (±s)
注:与本组T0对比,aP<0.05
项目MAP(kPa)T3 10.37±0.73a 11.49±0.92a 6.739<0.001 69.42±5.17a 78.06±6.84a 7.196<0.001组别观察组对照组t值P值观察组对照组t值P值n 51 51 HR(次/min)51 51 T0 10.94±0.87 11.02±0.79 0.486 0.628 73.53±5.69 74.28±6.15 0.639 0.524 T1 10.52±0.84a 11.94±0.95a 7.997<0.001 68.07±5.36a 79.16±7.03a 8.959<0.001 T2 10.16±0.78a 12.51±1.04a 12.910<0.001 70.26±5.81a 81.07±7.95a 7.840<0.001
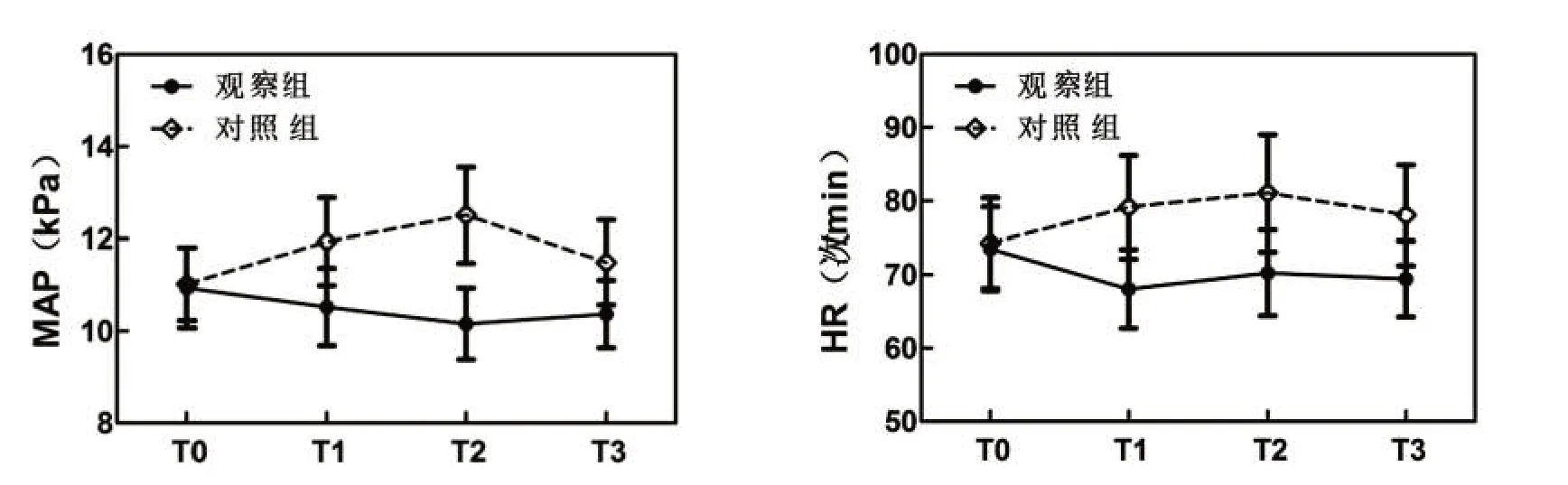
图1 2组血流动力学比较Figure 1 Comparison of hemodynamics of two groups
2.2 炎症因子 2 组T0 时血清TNF-α、hs-CRP、IL-6 水平相比,差异无统计学意义(P>0.05);2 组T3、T4、T5时血清TNF-α、hs-CRP、IL-6水平较T0时提高,但观察组低于对照组(P<0.05)。见表3。
2.3 应激反应 2 组T0 时血清GLU、E、Cor 水平相比,差异无统计学意义(P>0.05);2 组T3、T4、T5 时血清GLU、E、Cor 水平较T0 时增高,但联合组低于Dex组、Dez组(P<0.05)。见表4。
表3 2组血清TNF-α、hs-CRP、IL-6水平比较 (±s)Table 3 Comparison of serum TNF-α, hs-CRP and IL-6 levels between the two groups (±s)

表3 2组血清TNF-α、hs-CRP、IL-6水平比较 (±s)Table 3 Comparison of serum TNF-α, hs-CRP and IL-6 levels between the two groups (±s)
注:与本组T0相比,aP<0.05
项目TNF-α(ng/L)n 51 51 hs-CRP(mg/L)51 51 IL-6(pg/mL)组别观察组对照组t值P值观察组对照组t值P值观察组对照组t值P值51 51 T0 29.07±6.46 28.69±6.70 0.292 0.771 14.81±3.05 14.43±3.26 0.608 0.545 14.25±4.12 13.58±3.79 0.855 0.395 T3 32.74±7.62a 38.26±7.93a 3.584<0.001 52.47±18.39a 76.28±21.51a 6.009<0.001 21.42±7.38a 36.79±9.52a 9.112<0.001 T4 36.53±8.57a 43.15±9.28a 3.743<0.001 83.02±25.84a 126.97±32.69a 7.532<0.001 36.04±10.57a 52.35±13.74a 6.719<0.001 T5 33.49±6.74a 39.62±7.69a 4.281<0.001 67.58±21.40a 109.23±28.61a 8.325<0.001 29.85±8.46a 41.96±10.50a 6.414<0.001
表4 2组血清GLU、E、Cor水平比较 (±s)Table 4 Comparison of serum GLU, E, Cor levels between the two groups (±s)
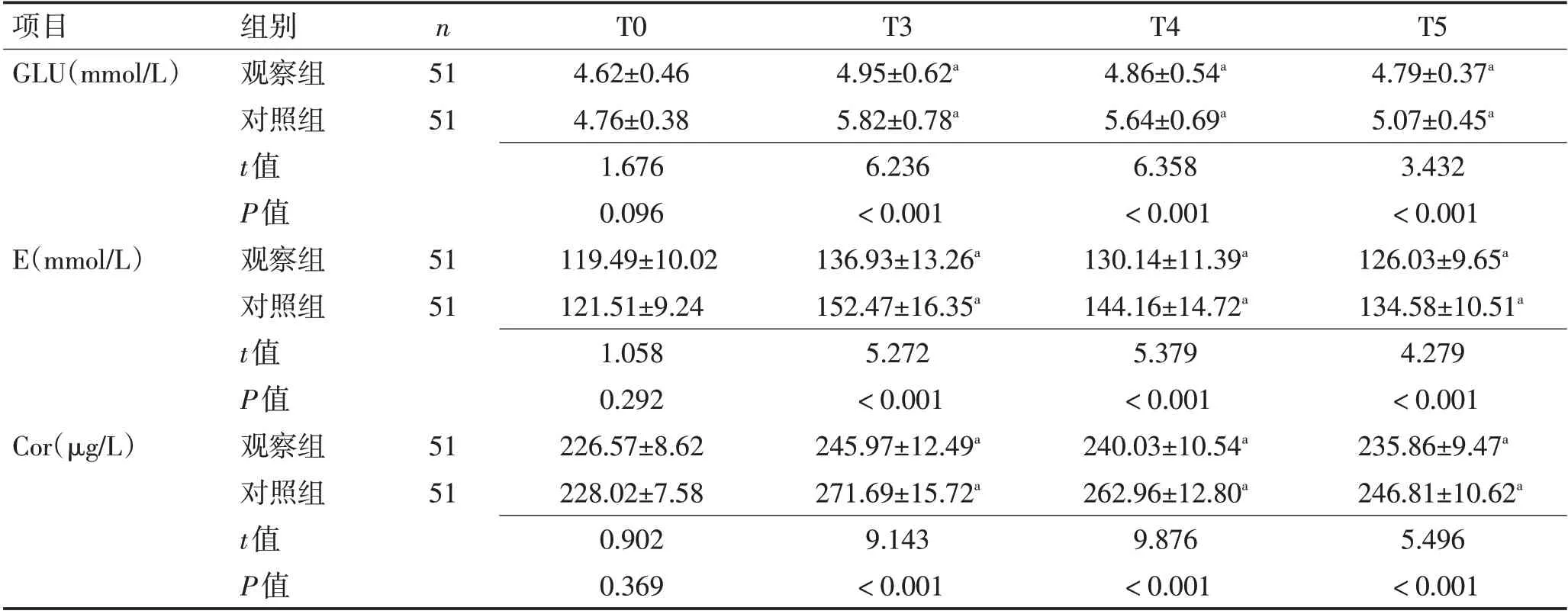
表4 2组血清GLU、E、Cor水平比较 (±s)Table 4 Comparison of serum GLU, E, Cor levels between the two groups (±s)
注:与本组T0相比,aP<0.05
项目GLU(mmol/L)T5 4.79±0.37a 5.07±0.45a 3.432<0.001 126.03±9.65a 134.58±10.51a 4.279<0.001 235.86±9.47a 246.81±10.62a 5.496<0.001组别观察组对照组t值P值观察组对照组t值P值观察组对照组t值P值n 51 51 E(mmol/L)51 51 Cor(μg/L)51 51 T0 4.62±0.46 4.76±0.38 1.676 0.096 119.49±10.02 121.51±9.24 1.058 0.292 226.57±8.62 228.02±7.58 0.902 0.369 T3 4.95±0.62a 5.82±0.78a 6.236<0.001 136.93±13.26a 152.47±16.35a 5.272<0.001 245.97±12.49a 271.69±15.72a 9.143<0.001 T4 4.86±0.54a 5.64±0.69a 6.358<0.001 130.14±11.39a 144.16±14.72a 5.379<0.001 240.03±10.54a 262.96±12.80a 9.876<0.001
2.4 脑损伤 2 组T0 时血清NSE、S-100β蛋白水平相比,差异无统计学意义(P>0.05);2 组T3、T4、T5时NSE、S-100β蛋白水平较T0 时增高,但观察组低于对照组(P<0.05)。见表5。
2.5 MMSE评分 2组T0时MMSE评分间差异无统计学意义(P>0.05);2组术后3 d、术后1周的MMSE评分较T0 时降低,但观察组较对照组高(P<0.05)。见表6。
2.6 不良反应、术后1周认知功能障碍发生情况 2组不良反应发生率差异无统计学意义(P>0.05);观察组术后1 周认知功能障碍发生率低于对照组(P<0.05)。见表7。
表5 2组血清NSE、S-100β蛋白水平比较 (±s,μg/L)Table 5 Comparison of serum NSE and S-100β protein levels between the two groups (±s,μg/L)
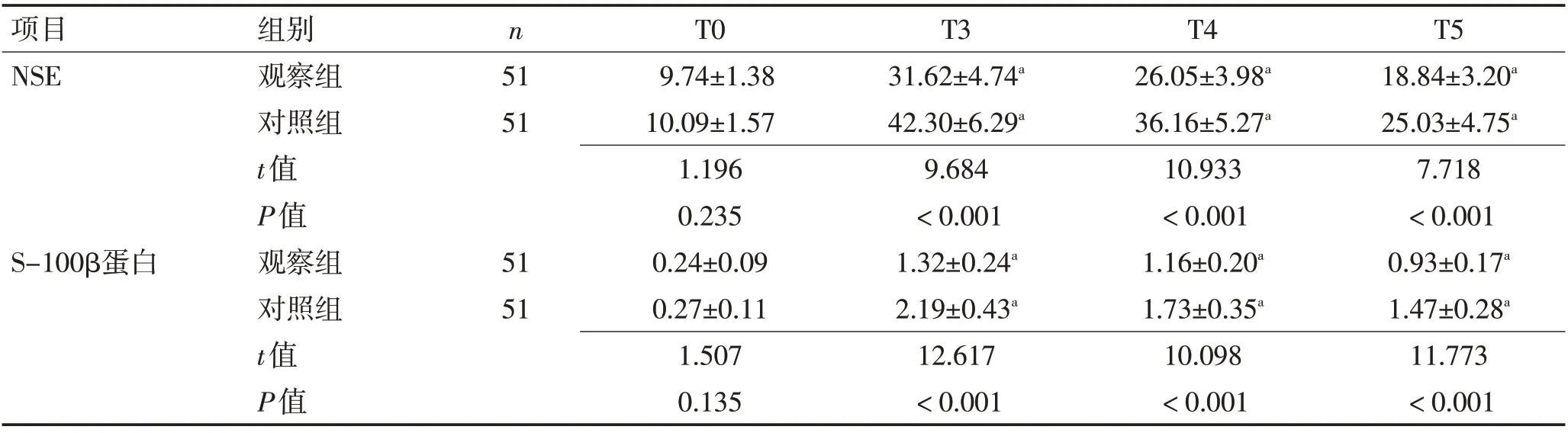
表5 2组血清NSE、S-100β蛋白水平比较 (±s,μg/L)Table 5 Comparison of serum NSE and S-100β protein levels between the two groups (±s,μg/L)
注:与本组T0比较,aP<0.05
项目NSE n组别观察组对照组t值P值观察组对照组t值P值51 51 S-100β蛋白51 51 T0 9.74±1.38 10.09±1.57 1.196 0.235 0.24±0.09 0.27±0.11 1.507 0.135 T3 31.62±4.74a 42.30±6.29a 9.684<0.001 1.32±0.24a 2.19±0.43a 12.617<0.001 T4 26.05±3.98a 36.16±5.27a 10.933<0.001 1.16±0.20a 1.73±0.35a 10.098<0.001 T5 18.84±3.20a 25.03±4.75a 7.718<0.001 0.93±0.17a 1.47±0.28a 11.773<0.001
表6 2组MMSE评分比较 (±s)Table 6 Comparison of MMSE scores of two groups (±s)

表6 2组MMSE评分比较 (±s)Table 6 Comparison of MMSE scores of two groups (±s)
注:与本组T0相比,aP<0.05
术后1周26.64±0.80a 25.58±0.72a 7.033<0.001组别观察组对照组t值P值n 51 51 T0 27.96±0.83 27.82±0.75 0.894 0.374术后3 d 24.37±0.75a 23.25±0.63a 8.166<0.001

表7 2组不良反应、术后1周认知功能障碍发生情况 [n(%)]Table 7 Adverse reactions, the occurrence of cognitive dysfunction one week after surgery of two groups [n(%)]
3 讨论
颅脑损伤患者若具备手术指征,一般推荐及时开展手术治疗,但由于颅脑手术创伤性较大,术中需采取气管插管、开颅、关颅、钻骨等操作,易引起严重炎症应激反应,影响术中血流动力学稳定性,引发心肌梗死、脑梗死等心脑血管疾病,且术中脑组织供血、供氧变化大,易出现脑功能损伤,降低患者临床获益[13-14]。因此,在手术治疗同时探寻一种安全有效麻醉方案一直受到临床重点关注。临床研究认为,理想的颅脑手术麻醉方案不仅要确保足够麻醉深度,减轻炎症应激,维持血流动力学稳定,且需具备脑保护作用,减轻术中脑功能损伤[15]。利多卡因为神经外科常用麻醉药,有研究报道对神经外科手术患者在异丙酚基础上联用利多卡因静脉麻醉可有效提升麻醉效果,稳定血流动力学情况[16]。利多卡因具有良好镇痛、镇静作用,可有效抑制儿茶酚胺、肾上腺素释放,减轻机体炎症应激反应,维持血流动力学稳定;且可收缩脑与全身大血管,扩张创伤部位微血管,而颅内大血管收缩能迅速降低颅内压,解除脑创伤区域微血管痉挛可改善局部脑组织血供、氧供,提升脑组织自我清除能力,且无“窃血”之嫌[17-18]。研究报道利多卡因可缓解脑缺血后引起的神经损伤,缓解细胞水肿,提高神经细胞膜稳定性,调节细胞代谢,起到脑保护效应[19];同时利多卡因能通过收缩脑与全身大血管,提升脑血管阻力,有效降低脑氧代谢[20]。
右美托咪定可起到中枢性抗交感、镇静、镇痛等作用,适用于气管插管重症患者镇静与围手术期联合用药等。研究报道对小脑幕下肿瘤手术患者应用右美托咪定结合利多卡因麻醉可更有效维持血流动力学平稳[21]。本研究中观察组T1、T2、T3 时MAP、HR 水平与术后1 周认知功能障碍发生率较低,术后3 d、术后1 周的MMSE 评分较高,与上述研究相符,表明右美托咪定结合利多卡因应用于颅脑损伤手术患者可稳定术中血流动力学,且机体认知功能损害轻。考虑原因为右美托咪定能激动突触前膜α2受体,抑制去甲肾上腺素生成及释放,降低外周及中枢神经系统兴奋性,减轻机体应激反应,阻止炎症因子分泌,缓解炎症状态,维持血流动力学稳定[22]。研究报道术后认知功能障碍与麻醉药物应用、炎症应激状态及血流动力学波动密切相关[23]。而右美托咪定具有镇痛、镇静及抗交感等作用,可维持血流动力学平稳,减少全麻药物用量,减轻炎症应激反应,起到脑保护作用,减轻脑认知功能损害[24-26]。
此外,NSE、S-100β蛋白均为脑损伤指标,主要分布在中枢神经系统胶质细胞内,正常状态下表达水平较低,但中枢神经系统遭受损伤后,可被大量释放至血液循环,致使血清NSE、S-100β蛋白水平增高[27]。本研究中观察组T3、T4、T5时NSE、S-100β蛋白水平低于对照组,表明应用右美托咪定结合利多卡因可减轻脑损伤。考虑原因与右美托咪定可起到脑保护作用有关。GLU、E、Cor均为敏感应激反应指标,水平增高与机体应激反应程度呈正相关[28]。本研究发现观察组T3、T4、T5 时GLU、E、Cor 水平低于对照组,表明应用右美托咪定结合利多卡因可缓解机体应激反应。分析原因与右美托咪定可产生镇静、镇痛作用,且能抑制去甲肾上腺素释放,下调外周、中枢神经系统兴奋性有关。TNF-α、hs-CRP、IL-6均为炎症因子,可反映机体炎症反应程度,其表达与脑组织损伤程度有关[29]。本研究中观察组T3、T4、T5 时血清TNF-α、hs-CRP、IL-6 水平低于对照组,提示应用右美托咪定结合利多卡因可减轻机体炎症反应。推究其原因与右美托咪定能抑制交感兴奋性,提升胆碱能抗炎通路活性,阻止单核巨噬细胞炎性因子表达,抑制炎症介质分泌有关[30-40]。本研究显示应用右美托咪定结合利多卡因不会显著增加不良反应,安全性良好。
右美托咪定结合利多卡因应用于颅脑损伤手术患者能维持术中血流动力学稳定,减轻机体炎症应激反应与脑损伤、认知功能损害,且安全性良好。但由于研究条件限制,本研究为单中心研究,且选取样本量较少,仍有待将来采取多中心、大样本研究进一步论证。
