伊立替康联合阿帕替尼辅助治疗术后转移性胃癌临床观察
2021-04-23李磊王韬王一飞费建东宋小涛胡振顺
李磊,王韬,王一飞,费建东,宋小涛,胡振顺
河北北方学院附属第一医院,河北张家口075000
胃癌为临床多发恶性肿瘤,近年来受膳食结构及生活习惯转变、环境恶化等因素影响,其发病率持续升高[1-2]。外科手术是临床治疗胃癌的重要手段,可有效切除病灶,但患者术后存在复发转移风险,而针对术后转移性胃癌患者应如何进行安全有效的治疗目前仍是研究热点[3-5]。伊立替康在术后转移性胃癌的治疗中较常用,属于半合成水溶性喜树碱衍生物,为DNA 拓扑异构酶Ⅰ抑制剂,可阻断DNA 复制,产生细胞毒性,诱导 DNA 单链损伤[6-7]。研究发现,抗血管生成靶向治疗具有显著的抗肿瘤活性,并能增强化疗药物活性[8]。阿帕替尼是我国研制的小分子血管内皮生长因子受体靶向治疗药物,可通过阻断血管内皮通路,发挥抑制肿瘤血管生成与肿瘤生长的作用[9]。本研究观察了伊立替康联合阿帕替尼辅助治疗对术后转移性胃癌患者生存质量、血清学指标的影响及安全性。现报告如下。
1 资料与方法
1.1 临床资料 纳入标准:①经病理检查确诊为胃癌;②临床分期为Ⅱ~Ⅲb 期;③采取根治术治疗后证实存在疾病进展,CT 等检查提示存在可测量病灶;④预计生存期≥3 个月;⑤ECOG 评分为 0~2 分。排除标准:①合并其他良恶性肿瘤;②合并肾、肝等脏器器质性病变;③存在骨髓抑制等化疗禁忌证;④存在活动性出血或出血倾向;⑤正在采取抗凝或溶栓治疗;⑥合并难以控制的高血压;⑦过敏体质或对研究药物过敏。选取2016 年11 月—2019 年2 月我院收治并符合上述标准的术后转移性胃癌患者45例,依据简单随机数字表法分为观察组23例与对照组 22 例。观察组男 13 例、女 10 例,年龄 51~76(66.03±3.97)岁,病理类型:印戒细胞癌1例、中低分化腺癌9例、低分化腺癌7例、黏液腺癌6例,临床分期:Ⅱ期 3 例、Ⅲa 期 9 例、Ⅲb 期 11 例,病灶直径(4.81±0.51)cm。对照组男15例、女7例,年龄50~79(64.91 ± 4.10)岁,病理类型:印戒细胞癌1例、中低分化腺癌10 例、低分化腺癌5 例、黏液腺癌6 例,临床分期:Ⅱ期2例、Ⅲa期12例、Ⅲb期8例,病灶直径(4.65 ± 0.49)cm。两组上述资料均具有可比性(P均>0.05)。本研究通过我院伦理委员会审核,患者均签署知情同意书。
1.2 治疗方法 两组均静脉滴注奥沙利铂130 mg/(m2·d),2 h 内滴注完毕;口服替吉奥,根据体表面积确定用药剂量,体表面积不足1.25 m2者口服40 mg/次、体表面积超出1.25 m2但不足1.5 m2者口服50 mg/次、体表面积超出1.5 m2者口服60 mg/次;均2次/d,治疗2周休息1周为1个疗程,共2~4个疗程。对照组在此基础上静脉滴注伊立替康350 mg/m2,30~90 min内滴注完毕,1次/3周,共治疗4次。观察组在对照组基础上口服阿帕替尼500 mg/次,1次/d,餐后30 min用药,3周为1个疗程,共2~4个疗程。
1.3 指标观察方法 ①疗效:依据RECIST 标准[10]评估疗效,已知病灶消失且持续≥4 周为完全缓解,肿瘤病灶最大单径之和缩小>30%且持续≥4 周为部分缓解,肿瘤病灶最大单径之和增大>20%或有新病灶出现为进展,其余为稳定。肿瘤控制率=(完全缓解例数+部分缓解例数+稳定例数)/总例数×100%。②血清肿瘤标志物[癌胚抗原(CEA)、糖链抗原242(CA242)、CA199、CA724]及基质金属蛋白酶2(MMP-2)、MMP-9、血管内皮生长因子(VEGF)水平:两组治疗前后抽取空腹外周静脉血5 mL,3 000 r/min 离心10 min,取上清液,-80 ℃保存,采用 ELISA 法检测血清 CEA、CA242、CA199、CA724、MMP-2、MMP-9、VEGF 水平。③生存质量:两组治疗前后依据KPS 量表进行生存质量评分,满分为100 分,分值越高提示生存质量越高[11]。④不良反应:记录两组治疗后血红蛋白减少、血小板下降、恶心呕吐、骨髓抑制发生情况[12]。⑤生存率:术后随访6~12个月,统计两组术后6、9、12个月生存率。
1.4 统计学方法 采用SPSS22.0 统计软件。计量资料以-x±s表示,组间和组内比较分别采用成组t检验和配对t检验;计数资料以例或率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组肿瘤控制率比较 观察组完全缓解6 例、部分缓解10 例、稳定4 例、进展3 例,肿瘤控制率为86.96%,对照组分别为 4、10、3、5 例及77.27%,两组肿瘤控制率比较P>0.05。
2.2 两组治疗前后血清肿瘤标志物及MMP-2、MMP-9、VEGF 水平比较 与治疗前比较,两组治疗后血清CEA、CA242、CA199、CA724及MMP-2、MMP-9、VEGF 水平均降低,且观察组降低更明显(P均<0.05)。见表1。
表1 两组治疗前后血清肿瘤标志物及MMP-2、MMP-9、VEGF水平比较(±s)
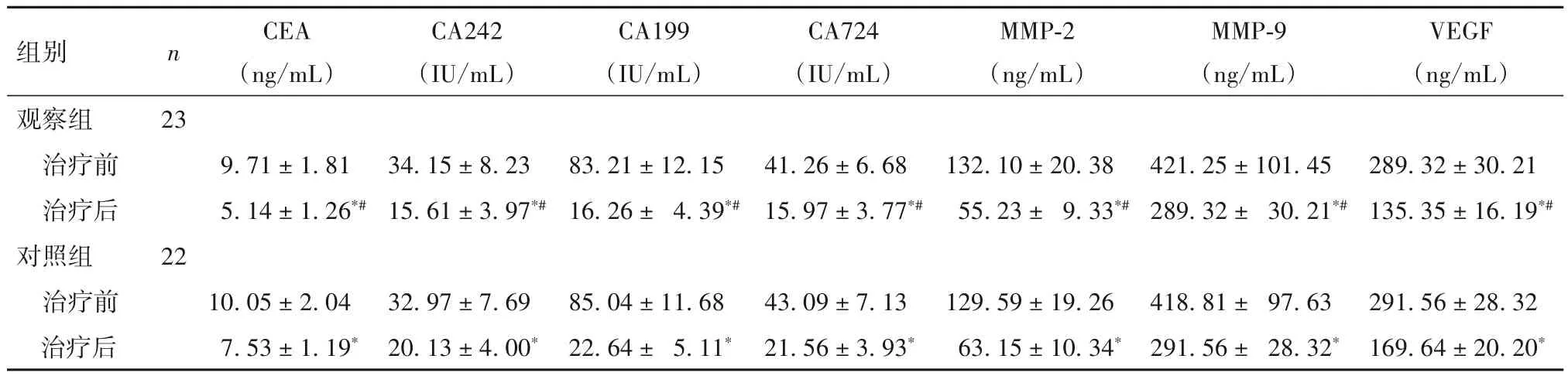
表1 两组治疗前后血清肿瘤标志物及MMP-2、MMP-9、VEGF水平比较(±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别观察组治疗前治疗后对照组治疗前治疗后n 23 22 CEA(ng/mL)9.71±1.81 5.14±1.26*#10.05±2.04 7.53±1.19*CA242(IU/mL)34.15±8.23 15.61±3.97*#32.97±7.69 20.13±4.00*CA199(IU/mL)83.21±12.15 16.26± 4.39*#85.04±11.68 22.64± 5.11*CA724(IU/mL)41.26±6.68 15.97±3.77*#43.09±7.13 21.56±3.93*MMP-2(ng/mL)132.10±20.38 55.23± 9.33*#129.59±19.26 63.15±10.34*MMP-9(ng/mL)421.25±101.45 289.32± 30.21*#418.81± 97.63 291.56± 28.32*VEGF(ng/mL)289.32±30.21 135.35±16.19*#291.56±28.32 169.64±20.20*
2.3 两组治疗前后生存质量评分比较 观察组治疗前后生存质量评分分别为(65.79 ± 5.04)、(78.39 ± 5.53)分,对照组分别为(66.37 ± 4.96)、(73.02±5.19)分;与治疗前比较,两组治疗后生存质量评分均升高,且观察组升高更明显(P均<0.05)。
2.4 两组不良反应发生率比较 观察组术后发生血红蛋白减少5例(21.74%)、血小板下降4例(17.39%)、恶心呕吐6例(26.09%)、骨髓抑制6例(26.09%),对照组 分 别为 4 例(18.18%)、6 例(27.27%)、6 例(27.27%)、5例(22.73%);两组比较P均>0.05。
2.5 两组生存率比较 观察组术后6、9、12 个月生存率分别为95.65%、86.96%、78.26%,对照组分别为90.91%、77.27%、68.18%,两组比较P均>0.05。
3 讨论
手术是临床治疗胃癌的重要方法,但患者术后存在复发转移风险,而针对发生转移的患者目前尚缺乏统一的治疗方案[13]。目前临床多采取以化疗为主的综合治疗措施治疗术后转移性胃癌,虽然具有一定效果,但仍难以达到临床预期,且此类患者预后不佳,故如何改善其生存质量、减少不良反应、提高生存率仍是研究的热点[14]。
伊立替康是半合成喜树碱可溶性衍生物,可作用于真核细胞DNA 的拓扑异构酶,对DNA 转录及复制产生阻碍作用,引发不可逆性DNA 键断裂,最终致使细胞凋亡[15]。研究显示,由于增生及静止的肿瘤细胞内拓扑异构酶水平升高,伊立替康对缓慢及快速生长的肿瘤细胞均能发挥良好的杀伤作用[16]。此外,肿瘤发生、进展、转移均与新生血管形成及供养密切相关,故抑制新生血管生成可能会促进肿瘤细胞凋亡[17]。阿帕替尼为血管内皮生长因子受体2(VEGFR-2)抑制剂,可竞争性结合于细胞中酪氨酸激酶三磷酸腺苷结合位点,阻断VEGF 信号通路传导,抑制VEGF 磷酸化及血管生成因子信号通路激活,进而阻止肿瘤新生血管生成[18]。本研究结果显示,观察组治疗后血清CEA、CA242、CA199、CA724 等肿瘤标志物水平均低于对照组,生存质量评分高于对照组。这表明伊立替康联合阿帕替尼的辅助治疗方案可更有效降低术后转移性胃癌患者血清肿瘤标志物水平,并提高其生存质量。分析其原因:①伊立替康可被多数组织中的羧酸酯酶代谢成SN-38,SN-38 能作用于提纯的拓扑异构酶,且活性更强,并诱导单链DNA损伤,以此阻断DNA复制,产生细胞毒性;该细胞毒性具备时间依赖性,能特异性作用于肿瘤细胞S 期,达到抑制肿瘤进展的目的[19]。②阿帕替尼是全球第一个被证实安全有效的小分子抗血管生成靶向药物,可阻止组织VEGF 和VEGFR结合,以阻断丝裂原活化蛋白激酶信号通路,发挥拮抗血管生成的作用。
肿瘤组织需新生血管提供营养物质及氧气来满足肿瘤细胞恶性增殖,血管内皮细胞分化及增殖可促进肿瘤新生血管形成、生长。VEGFR-2 与VEGF结合后可发生自动磷酸化,对血管内皮细胞有丝分裂和血管生成产生调节作用,且VEGF 结合于VEG⁃FR 后还可引起相关级联反应,促进血管内皮细胞有丝分裂,加速肿瘤新生血管生成。同时,VEGF 和VEGFR 的胞外区特异性结合,可激活蛋白激酶C、丝裂原活化蛋白激酶等下游信号通路,促使肿瘤细胞抗凋亡,并抑制体内抗肿瘤免疫应答。因此,VEGF 水平监测在胃癌疗效及预后评估中也具有重要作用。MMPs 与胃癌细胞的侵袭能力关系密切,MMP-2 及 MMP-9 均为 MMPs 家族重要成员,可降解胶原及弹力蛋白等,促使肿瘤细胞向周边正常组织浸润、侵袭、转移。本研究结果表明,观察组治疗后血清 MMP-2、MMP-9、VEGF 水平均低于对照组,提示伊立替康及阿帕替尼联合辅助治疗方案可显著调节术后转移性胃癌患者 MMP-2、MMP-9、VEGF 水平,以抑制病灶侵袭及转移。本研究采用的阿帕替尼剂量较低,不仅能保证治疗效果、延缓疾病进展、提升生存质量,且安全性较高。本研究结果显示,两组肿瘤控制率、生存率、不良反应发生率比较无显著差异,可能与样本量较小有关。
综上所述,伊立替康联合阿帕替尼辅助治疗术后转移性胃癌安全、有效,可显著降低血清肿瘤标志物及 MMP-2、MMP-9、VEGF 水平,提高患者生存质量。
